荷叶黄酮分离鉴定及不同干燥方法对荷叶黄酮及荷叶碱含量影响
凌智辉,肖 蓓,岳芊羽,欧梓轩,谢红旗,2,曾建国,2,陆 英,2*
1湖南农业大学园艺学院;2国家中药材生产(湖南)技术中心,长沙 410128
荷叶是睡莲科莲NelumbonuciferaGaertn.的叶,传统医学认为,荷叶味苦性平,归肝、脾、胃三经,具有清解暑热、升发清阳、凉血止血的作用。现代医学认为荷叶有抑菌[1,2]、抗病毒[3,4]、抗氧化[5,6]、降血糖[7]、降脂减肥[8,9]、抗癌[10,11]等多种功能,被国家卫生部列入药食同源目录中。研究人员从荷叶中分离鉴定了多个黄酮类和生物碱类化合物,然而,2015版《中国药典》中对荷叶质量要求仅为荷叶碱>0.1%;同时,查阅文献可知,不同产地初加工方法对荷叶中黄酮类化合物含量影响鲜见报导。
鉴于黄酮类化合物的多种生物活性,笔者认为,增加对荷叶中主要黄酮类的含量测定更有利于其质量保证。因此,为进一步探明荷叶中主要黄酮类化合物的组成,本研究首先采用高速逆流色谱与制备液相联用技术对荷叶提取液中3个主要黄酮类化合物进行分离,并经质谱和核磁共振技术分别鉴定为金丝桃苷、异槲皮苷和槲皮素-3-O-葡萄糖醛酸苷,这些成分具有重要的生物活性,如抗炎、抗氧化、抗病毒、抗肿瘤、抗动脉粥样硬化、降血压、降血糖、降脂等[12,14],是荷叶功能的物质基础;然后实验进一步以该3个化合物及荷叶碱为指标,对荷叶不同干燥方法及采收时间进行研究,进一步明确不同加工方法对荷叶品质的影响,实验结果对荷叶开发利用及生产实践具有重要指导意义。
1 材料与方法
1.1 材料与试剂
化合物制备分离所用干燥荷叶原料购自养天和大药房湖南农大店;产地初加工荷叶鲜样采自湖南长沙湖南农业大学寸草湖,经湖南农业大学谢红旗教授鉴定为睡莲科植物莲NelumbonuciferaGaertn.的叶;色谱纯乙腈购于美国天地公司;荷叶碱(纯度98%)购于中山市成诺生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
SPD-M20A分析型高效液相色谱仪(日本岛津公司);TBE-300A高速逆流色谱仪(中国上海同田生化技术有限公司);LC-8A制备高效液相色谱仪(日本岛津公司);MODULYOD-230冷冻干燥机(美国热电公司);Milli-Q Reference超纯水机(美国密理博公司);AUW220D电子天平(日本岛津公司)。
1.3 方法
1.3.1 荷叶提取物中活性成分的HPLC分析方法
采用WondasilTMC18柱(4.6 × 250 mm);流动相A:0.2%磷酸水,B:乙腈,梯度洗脱方法为:0~20 min:15%( 28% B;20 ~ 25 min:28%( 40% B;流速1.0 mL/min,柱温30 ℃,检测波长254 nm。
1.3.2 3个荷叶黄酮化合物的分离制备
取购买的干燥荷叶500 g,粉碎,用5 000 mL 40%乙醇35 ℃超声浸提1.0 h,过滤,滤渣同法再提取1次,合并滤液,55 ℃真空浓缩除去乙醇,得荷叶粗提液2 200 mL,用盐酸调节pH值3左右,以3 BV/h流速通过一支装有500 mLAB-8大孔吸附树脂的层析柱,上样完成后静置30 min,水洗至流出液无色,然后用体积浓度70%乙醇以3 BV/h流速洗脱,收集洗脱液,真空浓缩后冷冻干燥,得荷叶黄酮提取物17 g,作为高速逆流色谱分离的上样原料。
按正己烷-乙酸乙酯-正丁醇-甲醇-0.2%冰乙酸水溶液(1∶3∶2∶1∶4,V/V)扩大200倍配制成2 200 mL的溶剂体系,静置过夜后将上下相分离,分别超声脱气10 min。上相为固定相,下相为流动相,正转,转速850 rpm,检测波长254 nm,温度20 ℃,仪器平衡后取上述制备的样品300 mg用下相20 mL溶解进样,进样后采集色谱图。根据色谱图收集流分A(188~220 min)和流分B(235~258 min);将流分B浓缩后用少量甲醇溶解,以乙腈和0.2%冰乙酸水为流动相,20%乙腈等度洗脱,流速6.0 mL/min,分别收集色谱峰1(33~35 min)和色谱峰2(36~38 min);将色谱峰1、2流出液和流分A分别浓缩后冷冻干燥,得化合物1、2、3。
1.3.3 化合物的结构鉴定
采用质谱(MS)、核磁共振(1H NMR和13C NMR)对化合物进行结构鉴定。质谱在湖南农业大学分析测定中心完成,核磁共振谱在湖南师范大学化工研究院分析测试中心完成,溶剂为DMSO。
1.3.4 不同干燥方法及采收时间对荷叶中黄酮和荷叶碱的含量影响研究
1.3.4.1 样品制备
处理1:三种干燥方式样品制备:取同一池塘相邻生长的大小相同9片荷叶分为三组,每组3片,分别采用晒干、阴干、60 ℃烘干三种干燥方式,各组样品干燥后分别粉碎,混匀,过30目筛网。
处理2:不同烘干温度样品制备:取同一池塘相邻生长的大小相同的5片荷叶,每片分成6 等份,分别在50、60、70、80、90、100 ℃下烘干;同温度的干燥样品粉碎后混匀,过 30目筛网。
处理3:烘干前切制与不切制样品制备:取3片大小相同的荷叶,每片对折分成2份,一份切成1.5 cm的条状,另一份不切,在60 ℃下烘干;切制样品与不切制样品分别粉碎后混匀,过30 目筛网;。
处理4:不同采收时间样品制备:分别在7、8、9月中旬采收3片大小相同的荷叶,60 ℃下烘干,粉碎后混匀,过30目筛网。
1.3.4.2 样品含量测定
分别精确称取一定量上述自制干燥化合物1、2、3和荷叶碱标准品,用甲醇超声溶解,配制成1 mg/mL左右的母液,临用前用甲醇对倍稀释至一系列浓度,在“1.3.1”条件下进样,记录峰面积。以化合物质量为横坐标,峰面积为纵坐标,绘制标准曲线,以噪音峰高3 倍为最低检出限。
精密称取不同干燥处理的荷叶样品0.25 g,加入100 mL质量浓度为40%的乙醇,置于55 ℃超声提取30 min,提取完毕后用提取液补充至超声前质量,摇匀后取上清液过0.45 μm有机滤膜,测定目标组分峰面积,根据标准曲线计算样品中各组分含量,并根据含水量换成干品含量。
2 结果与分析
2.1 荷叶中活性成分HPLC分析方法的确定
荷叶提取液的HPLC见图1左,由图可知,色谱峰1、2、3较高,DAD检测器显示它们在254 nm、350 nm处有较大吸收,为黄酮苷类化合物吸收特征,确定为待分离的目标组分,色谱峰4与荷叶碱标准品保留时间一致,确定为荷叶碱。实验中发现,不同型号的色谱柱对荷叶中黄酮类化合物的分离效果有很大的影响。采用Agilent ZORBAX SB C18柱时化合物2和3完全不能分离(图1右),改为WondasilTMC18色谱柱时两者才有一定程度的分离(图1左),因此,最终采用GL Science WondasilTMC18进行分析。
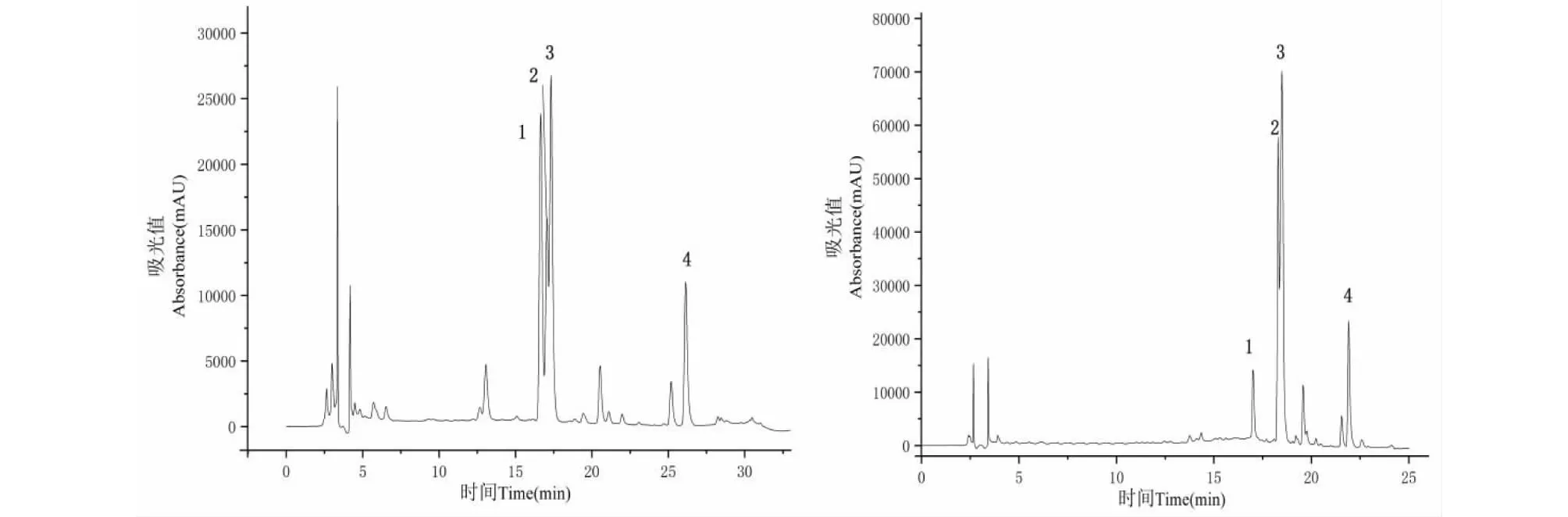
图1 荷叶提取物在不同型号色谱柱HPLC图Fig.1 HPLC analysis of extract from lotus leaf in different chromatographic columns
2.2 荷叶中3个主要黄酮类化合物的制备分离
通过HPLC测定目标组分的分配系数(K值)是选择HSCCC分离溶剂体系的常用方法,不同化合物间的K值相差较大,表示化合物之间的分离度越好,K值越接近,表示难以分离。3个目标组分在多种不同组成的溶剂体系的K值后发现,K1、K2总是很接近,K3与K1、K2相差较大,即HSCCC难以将化合物1与2分离,但二者都能与化合物3分离;同时,HPLC分析显示,化合物1与2在液相色谱柱中具有一定的分离度。因此,实验最终确定,首先通过HSCCC分离获得化合物3及化合物1、2的混合溶液,再通过制备液相分离化合物1、2。
实验采用正己烷-乙酸乙酯-正丁醇-甲醇-0.2%冰乙酸水溶液(1∶3∶2∶1∶4,V/V)为溶剂体系进行分离,在该体系中K1、K2、K3分别为3.02、3.20、4.20。HSCCC图谱见图2,得到流分A和流分B,不同流分的HPLC测定见图3,由图可见,流分A为化合物3,面积归一法测定纯度为98.78%,真空浓缩冷冻干燥后得到干粉12.06 mg。流分B中为化合物1、2的混合物,该流分经制备液相分离,结果见图4,得到5.19 mg纯度为98.36%的化合物1和4.23 mg纯度为96.68%的化合物2。
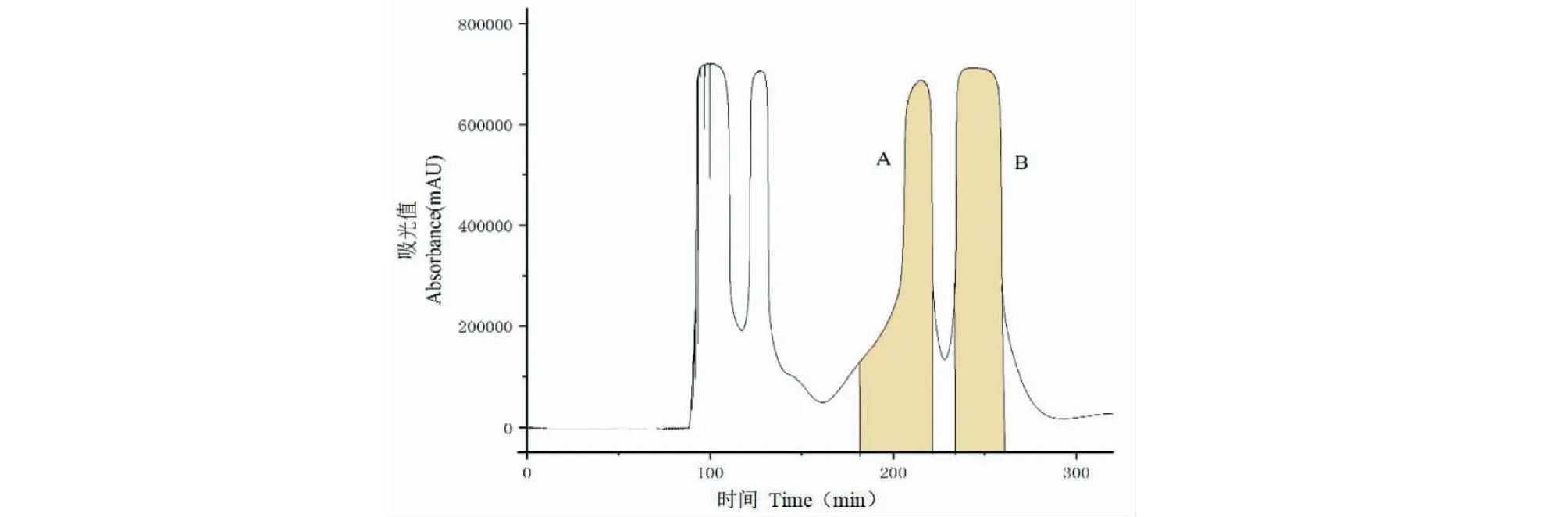
图2 HSCCC分离荷叶黄酮Fig.2 Separation of flavonoids from lotus leaves by HSCCC
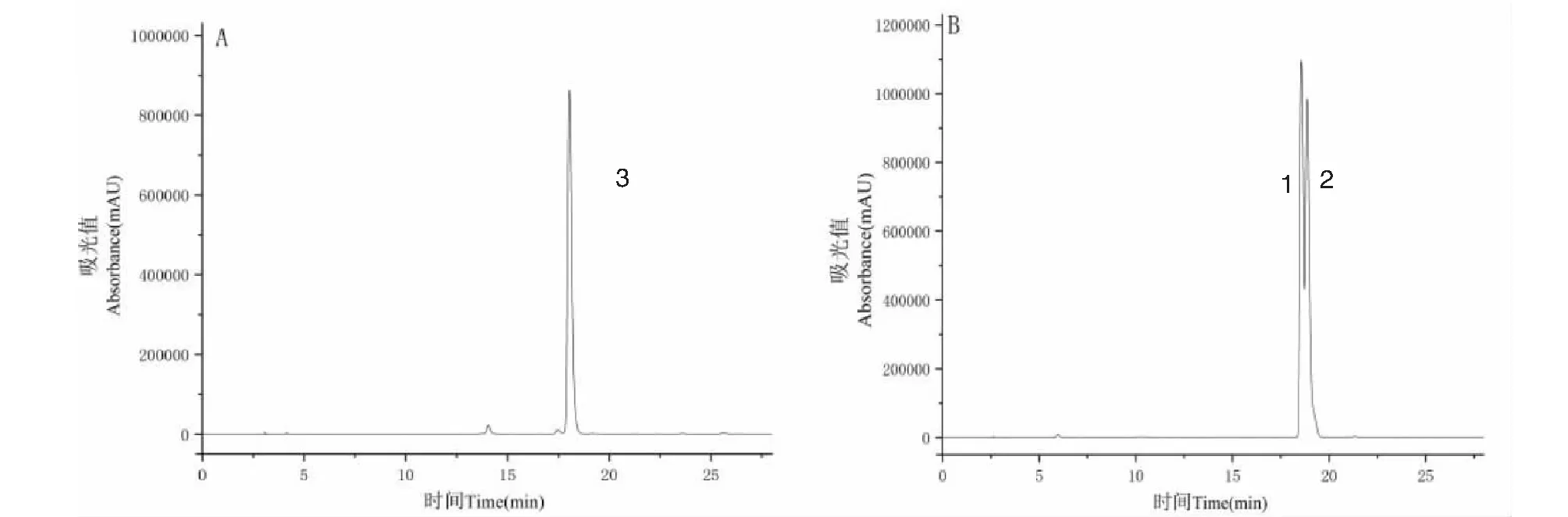
图3 HSCCC分离流分A和流分B的HPLC图Fig.3 HPLC chromatograms of elute A and elute B separated by HSCCC
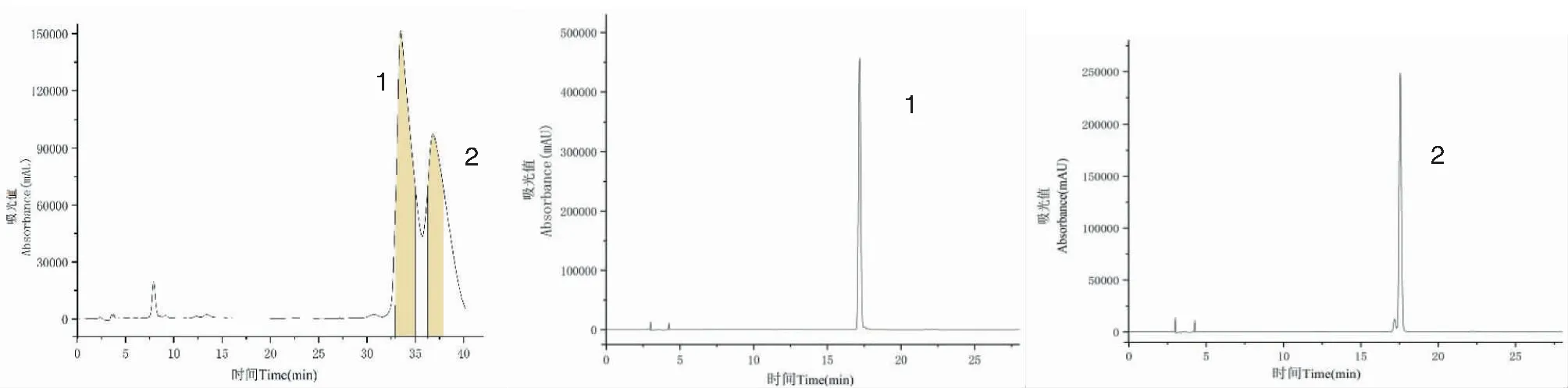
图4 制备HPLC分离流分B及分离物的HPLC图Fig.4 Chromatograms of elute B and isolates separated by Pre-HPLC
2.3 化合物结构鉴定
化合物1黄绿色粉末,Q-TOF-MS分析化合物的[M+H]+为m/z465.102 0,提示分子式为C21H20O12。1H NMR(500 MHz,DMSO-d6)δ:5.40(1H,d,J= 2.0 Hz,Glc H-1′′),6.20(1H,s,H-6),6.43(1H,s,H-8),6.84(1H,d,J= 7.5 Hz,H-5′),7.58(1H,s,H-2′),7.65(1H,d,J= 8.0 Hz,H-6′),12.65(1H,s,5-OH);13C NMR(125 MHz,DMSO-d6)δ:177.9(C-4),165.9(C-7),161.6(C-5),156.6(C-2,C-9),149.3(C-4′),145.6(C-3′),133.7(C-3),122.1(C-6′),121.4(C-1′),116.5(C-5′),115.7(C-2′),103.8(C-10),102.2(C-1′′),99.4(C-6),94.1(C-8),76.3(C-5′′),73.7(C-3′′),71.7(C-2′′),68.3(C-4),60.5(C-6′′)。以上数据与文献[15]报道基本一致,确定为金丝桃苷。
化合物2黄绿色粉末,Q-TOF-MS分析化合物的[M-H]-为m/z463.088 3,提示分子式为C21H20O12。1H NMR(500 MHz,DMSO-d6)δ:5.48(1H, d,J=4.5 Hz,Glc H-1′′),6.20(1H,s,H-6),6.42(1H,s,H-8),6.84(1H,d,J=7.0 Hz,H-5′),7.59(1H,s,H-6′,H-2′),8.33(1H,s,3′-OH),12.6(1H,s,5-OH);13C NMR(125 MHz,DMSO-d6)δ:94.3(C-8),99.24(C-6),104.2(C-10),115.7(C-2′),116.6(C-5′),121.6(C-6′),121.9(C-1′),133.6(C-3),145.39(C-3′),149.1(C-4′),156.5(C-9),156.8(C-2),161.6(C-5),165.1(C-7),177.8(C-4),101.2(Glc-1′),74.5(Glc-2′′),76.9(Glc-3′′),70.3(Glc-4′′),78.1(Glc-5′′),61.4(Glc-6′′)。以上数据与文献[16]报道基本一致,确定为异槲皮苷。
化合物3黄棕色粉末,Q-TOF-MS分析化合物的[M-H]-为477.048 6,提示分子式为C21H18O13。1H NMR(500 MHz,DMSO-d6)δ:3.27~3.40(3H,m,2′′,3′′,4′′-H),3.58(1H,d,J= 9.5 Hz,5′′-H),5.51(1H,d,J= 7.5 Hz,1′′-H),6.21(1H,d,J= 2.0 Hz,6-H),6.41(1H,d,J= 2.0 Hz,8-H),6.84(1H,d,J= 8.5 Hz,6′-H),7.53(1H,d,J= 2.0 Hz,2′-H),7.61(1H,d,J= 2.0 Hz,6′-H),12.57(1H,s,5-OH);13C NMR(125 MHz,DMSO-d6)δ:156.7(C-2,C-9),133.6(C-3),177.6(C-4),161.6(C-5),99.3(C-6),164.6(C-7),94.1(C-8),104.3(C-10),121.3(C-1′),115.7(C-2′),145.4(C-3′),149.1(C-4′),116.6(C-5′),122.1(C-6′),101.6(C-1′′),74.3(C-2′′),76.4(C-3′′),71.8(C-4v),80.8(C-5′′),170.4(C-6′′)。以上数据与文献[17,18]报道基本一致,鉴定为槲皮素-3-O-葡萄糖醛酸苷。
2.4 不同干燥方法及采收时间对荷叶黄酮及荷叶碱含量影响
2.4.1 标准曲线的绘制
以进样量(mg)为横坐标(x),峰面积为纵坐标(y)绘制化合物的标准曲线,结果见表1。由表可知,3个黄酮类化合物和荷叶碱的质量与峰面积呈良好的线性关系,可以用于含量测定。
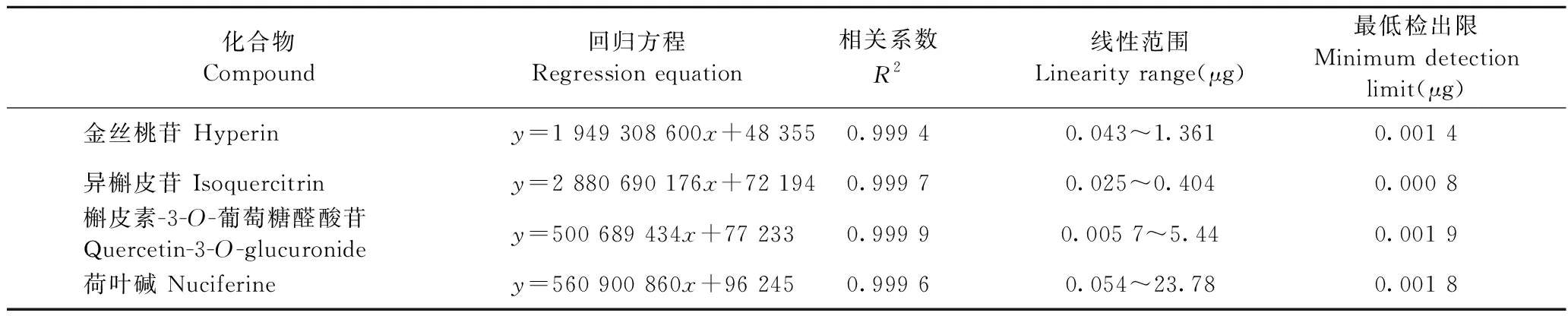
表1 4个化合物标准曲线Table 1 Standard curve of 4 compounds
2.4.2 干燥方式对荷叶中活性成分的影响
整片晒干、阴干和60 ℃烘干处理样品中4个化合物的含量见表2,由表可见,三个黄酮类化合物以槲皮素-3-O-葡萄糖醛酸苷含量最高,约为金丝桃苷的5倍,异槲皮苷的14倍;不同干燥方式样品中黄酮总量为:60 ℃烘干(阴干(晒干,其中60 ℃烘干与晒干、阴干具有显著性差异,而晒干与阴干无显著性差异;三种处理样品中荷叶碱含量相近,不具有显著性差异。总体来说,烘干优于阴干和晒干,阴干与晒干相差不大。
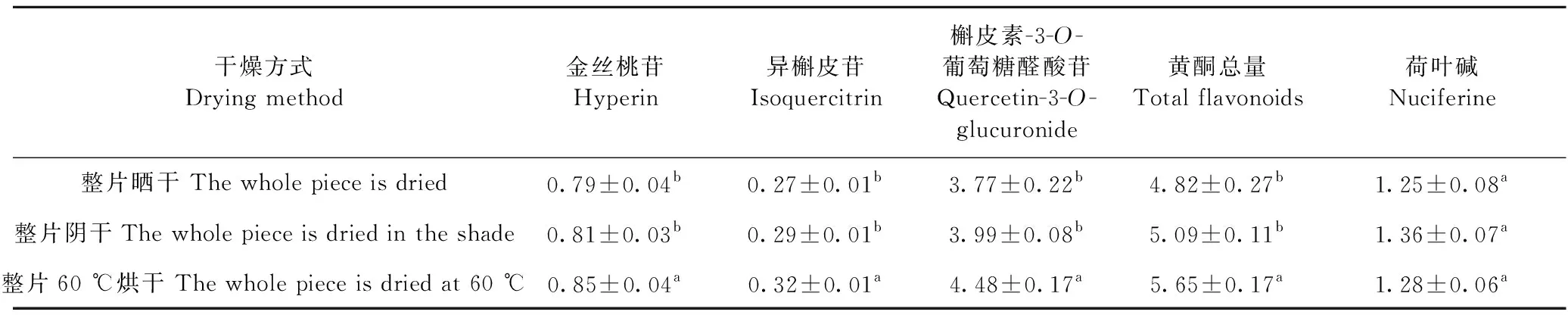
表2 干燥方式对荷叶中活性成分的影响Table 2 Effect of drying methods on activity compounds in lotus leaves (%)
2.4.3 烘干温度对荷叶中活性成分的影响
不同烘干温度处理的样品中各化合物含量见表3,随着烘干温度升高,4个化合物含量呈上升趋势,分为具有显著性差异的三个等级,黄酮含量50~80 ℃最低,90 ℃居中,100 ℃最高;荷叶碱含量50 ℃最低,60~90 ℃居中,100 ℃最高。由此可见,随温度升高,荷叶黄酮和荷叶碱活性成分的保留。可能是低温干燥时,酶具有一定活性,同时时间长,干燥过程前期处于湿热环境,使黄酮和荷叶碱发生部分降解与转化,含量降低;相反,高温时,酶快速失活,同时干燥时间短,水分快速失去,能减少化合物降解与转化。由此可见,在实验设定的干燥温度范围内,高温短时的干燥工艺有利于有效成分的保留,研究结果与文献[19]的牡丹花瓣总黄酮和文献[20]中的黄连总生物碱的干燥结果相似。

表3 烘干温度对荷叶中活性成分的影响 Table 3 Effect of drying temperature on activity compounds in lotus leaves (%)
2.4.4 切制对荷叶中活性成分的影响研究
干燥前趁鲜切制与不切制对4个化合物的影响见表4,结果表明:不切制样品中总黄酮含量显著高于切制处理,且主要源于槲皮素-3-O-葡萄糖醛酸苷的差异;切制与不切制对荷叶碱含量无影响。
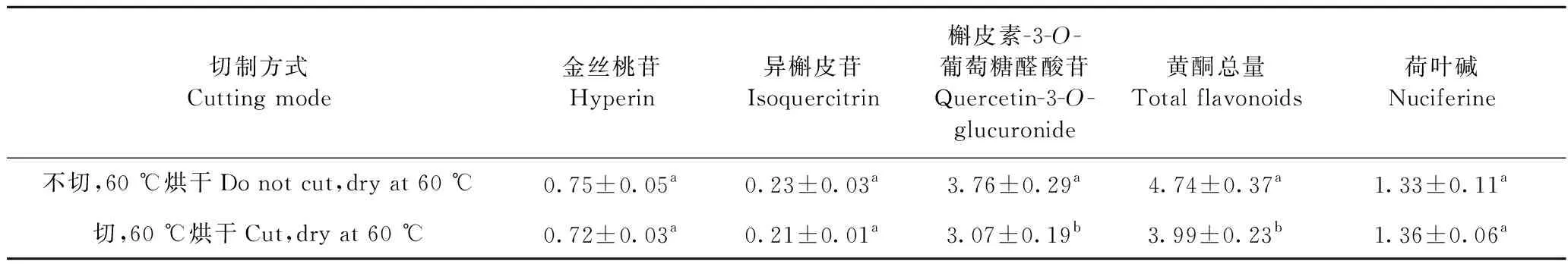
表4 加工切制对荷叶中活性成分的影响Table 4 Effects of cutting on activity compounds in lotus leaves (%)
2.5 采收时间对荷叶中活性成分的影响
不同采收时间的荷叶各组分含量见表5,由表可见,从7月到9月,荷叶总黄酮含量趋于稳定,9月中旬略有下降,但无显著差异;荷叶碱呈上升趋势,8月与9月样品无显著差异,但它们与7月有显著差异。同时可见,三个黄酮化合物,因此,综合黄酮总量与荷叶碱含量,8月中旬到9月中旬为荷叶较佳采收时间。

表5 采收时间对荷叶中活性成分的影响Table 5 Effects of harvest season on activity compounds in lotus leaves (%)
3 结果与讨论
采用HSCCC和制备液相联用方法对荷叶中3个含量较高的黄酮类化合物进行制备分离,经质谱和核磁共振鉴定分别为金丝桃苷、异槲皮苷和槲皮素-3-O-葡萄糖醛酸苷,它们具有抗炎、抗氧化、抗病毒、抗肿瘤、抗动脉粥样硬化、降血压、降血糖、降脂等多种重要的生物活性,是荷叶功能的物质基础,因此对这些活性成分进行含量测定对荷叶加工及开发利用具有重要意义。
不同的干燥方法对中药材中活性成分的影响主要在于温度,温度一方面影响植物鲜样中多种酶的活性,另一方面影响活性成分的稳定性。高温对化合物的影响是双向的,一方面能快速使酶失活,减少干燥时间,有利于活性成分的保留,另一方面高温又会使一些不稳定成分降解变化,不利于活性成分的保留;因此,研究不同中药材适宜的干燥方法对保证中药材质量具有重要作用。本研究结果表明,烘干显著优于阴干和晒干,阴干和晒干无差异;随着烘干温度的升高,各组分含量有上升趋势,100 ℃烘干时含量最高,推测高温使酶快速失活能有效地少活性成分的降解与转化;同时,切制时会导致部分酶与化合物充分接触,使化合物降解,含量下降,但对不同化合物影响不一致,切制后干燥的总黄酮显著低于不切制干燥,对荷叶碱含量无影响;总体来说,荷叶干燥方法以整块高温烘干最好,但无论哪种干燥方式,荷叶碱含量均远远高于2015版《中国药典》要求。同时,从7月到9月,荷叶总黄酮趋于稳定,荷叶碱呈上升趋势,综合黄酮总量与荷叶碱含量,8月和9月为荷叶较佳采收时间。

