豆腐果苷通过抑制TrkA-TRPV1信号通路减轻大鼠膝骨关节炎疼痛
项 婷,贾元威,郭 南,王 萍,王昌茂,詹翠娇,徐新徽,沈 杰*
1皖南医学院;2皖南医学院弋矶山医院,芜湖 241000
膝骨关节炎(knee osteoarthritis,KOA)是一种常见的关节进行性、退行性病变,全世界预估有超过2亿的膝骨关节炎患者[1]。随着我国社会人口结构的老龄化,KOA患病率也在增加[2]。KOA的治疗多以对症治疗为主,疼痛是KOA的主要临床症状,也是KOA治疗的主要目标之一[3]。
TrkA-TRPV1(酪氨酸激酶A-瞬时感受器电位香草酸受体1)是在疼痛信号的发生和传递过程中的关键通路。在疼痛的传导过程中,信号由TrkA受体传导至作为疼痛发生器的TRPV1受体,最后传导至中枢或再反馈到各种其他受体。TRPV1等疼痛相关通道主要在DRG等神经节中表达。TrkA-TRPV1在KOA的疼痛中起着重要作用[4,5]。
目前KOA的药物治疗使用非甾体抗炎药等,但因长期不良反应等原因使临床使用受限[6]。我国地方性天然药物药用植物及其衍生产物,在治疗慢性及疑难疾病方面具有独特优势,目前天然药用植物及其衍生物用于骨关节炎治疗引起广泛关注[7,8],如芍药甙、冠盖藤水提物、黄芩素、白藜芦醇、阿魏酸、胡椒碱及豆腐果苷类似物天麻素等。
豆腐果苷(helicid,4-甲酰苯基β-D-阿咯吡喃糖苷)为我国首次分离鉴定的、天然植物来源的民族药物,结构与天麻素类似,1984年开始应用于临床治疗神经病理性疼痛及炎性疼痛,效果显著,无成瘾性,无长期毒性,副作用低。本研究旨在探讨豆腐果苷在KOA疼痛中的作用,及其是否与DRG中TrkA-TRPV1信号通路有关。
1 材料与仪器
1.1 动物
SPF级Sprague-Dawley雄性大鼠80只,体重为160~180 g,由上海杰思捷实验动物有限公司提供,生产许可证号:SCXK(沪)2018-0004。饲养环境恒温(22±2 ℃),自由饮水饮食,饲养环境为12 h光照/黑暗循环。所有试验操作均符合皖南医学院动物伦理委员会的批准。
1.2 药物
豆腐果苷(TCI Japan公司,纯度> 98%,批号:QCCYK-GS);单碘乙酸钠(MIA,Sigma-Aldrich,≥ 98%,批号:SLBZ7569);水合氯醛(麦克林,AR,> 99%,批号:C10147287);戊巴比妥钠(Sigma,批号:20160925);生理盐水(0.9%氯化钠注射液,安徽双鹤药业有限责任公司,批号:1908202B)。
1.3 实验仪器与试剂
50 μL微量进样器(上海高鸽工贸有限公司);Von-Frey纤维丝(Touch Test,英国);红外热痛测试仪(Biological Reserch Apparatus 21036 Gemonio VA Italy);数显游标卡尺(杭州钢拓工具有限公司);Leica Cryostat 冰冻切片机(CM3000;Nussloch,Germany);TrkA一抗(兔来源,Abcam ab76291);TRPV1一抗(兔来源,Abcam ab6166);二抗(抗兔Abcam ab150078)。
2 实验方法
2.1 造模分组及给药
SD大鼠按照造模前一天机械痛阈值随机分组:即空白组、KOA模型组(简称模型组)、假手术组、KOA模型+豆腐果苷50 mg/kg灌胃给药组(简称给药组)。豆腐果苷目前在抗抑郁和抗神经病理性疼痛中的研究较多。目前尚无豆腐果苷用于治疗骨关节炎的明确报道,无明确的剂量参考。因此本试验中选择在其他模型中都有较好的治疗效果的剂量:50 mg/kg[9]。
参考Philpott等[10]的造模方法造模:大鼠10%水合氯醛(3 mL/kg,ip)麻醉后,一次性膝关节腔注射用无菌0.9%生理盐水溶解的MIA(60 mg/mL);假手术组大鼠膝关节腔内注射无菌0.9%生理盐水50 uL;空白对照组不做处理。MIA注射前一天给药,随后每天于7∶30~8∶30灌胃给予豆腐果苷或生理盐水,给药2周后处死取L4 DRG组织。麻醉前和取组织前均至少禁食12 h。
2.2 观察指标
2.2.1 机械刺激回缩阈值(PWT)
用Von-Frey 纤维丝法[11]进行测定。
将大鼠放在金属筛网上的有机玻璃罩中至少20 min,然后用Von-Frey纤维丝直接刺激大鼠后肢足底中部,持续时间为3~5 s,大鼠出现抬足或舔足行为视为阳性反应,撤除纤维丝后立即缩足也被认为是阳性反应;纤维丝弯曲90度无抬足反应为阴性反应。本试验中用的细丝为0.4~15 g,测定时,力度从2 g开始,若出现阳性反应则降低力度,若为阴性反应则加大力度。在第一次出现不同反应后再进行4次测量,再根据公式计算PWT值,如果观察到对最小克数纤维丝的阳性反应或对最大克数纤维丝的阴性反应,则停止测试PWT为最小(0.4 g)或最大值(15 g)。每次测量时间为给药后4 h左右。
2.2.2 热刺激回缩潜伏期(PWL)
按Hargreaves法[12]用红外热痛刺激仪照射大鼠足底。照射开始至大鼠出现抬腿回避时为PWL。红外强度为55,自动切断时间为30 s,以防止组织损伤。热刺激强度在整个实验过程中维持一致。每只动物测定3次,每次间隔3 min,取3次平均值为大鼠PWL值。每次测量时间为给药后4 h左右。
2.2.3 关节直径差值
用数字电子卡尺测量膝关节直径,记录左右膝关节直径差值。每次测量时间为19∶00~20∶00,造模和处死当天除外。
2.3 组织病理学检测
2.3.1 组织获取
用1%戊巴比妥钠(35 mg/kg)腹腔注射麻醉大鼠后,进行心脏灌注,先用100 mL 0.9%生理盐水,然后用300 mL 4%多聚甲醛(PFA;pH 7.4),灌注后截取大鼠整段腰椎和膝关节。腰椎PFA中固定20 h,分离L4 DRG,PFA中固定24 h,之后在4 ℃环境下采用20%和30%蔗糖梯度脱水,OTC胶包埋,-80 ℃下保存;切片前于-20 ℃中放置2 h,冰冻切片,切片厚度为6 μm,组织切片置37 ℃温箱孵育48 h,取出后室温放置10 min,进行染色或-20 ℃保存。膝关节PFA中固定48 h,解剖、拍照观察后评分。
2.3.2 免疫荧光化学法
组织切片室温放置10 min;2.5%PBST打孔10 min;5%牛血清37 ℃孵育1 h;滴加TrkA(1∶100)或TRPV1(1∶100)抗体,置湿盒4 ℃ 24 h;次日37 ℃恒温箱复温1 h,滴加二抗(1∶500),37 ℃下孵育2 h;DAPI染色8 min;期间均用0.02 mol/L磷酸盐缓冲液洗涤5 min ×3次,晾干后滴加抗荧光淬灭剂封片。使用EWROS显微镜观察并拍照。未滴加一抗的组织切片作为荧光阴性对照,切片显示没有特异性荧光表达。使用Image J,测量DRG切片中TrkA、TRPV1的平均IntDen值,并对DRG中有TrkA、TRPV1表达的细胞进行计数。
2.3.3 关节股骨大体观察评分
大鼠活体观察指标为关节直径差值,病理学观察中大体观察体评分标准如下(0~4分共5级)[13]:0分,关节面光整,色泽如常;1分,关节面粗糙,有小的裂隙且色泽灰暗;2分,关节面糜烂,软骨侵蚀深达软骨浅中层;3分,关节面溃疡形成,软骨侵蚀深达软骨深层;4分,软骨剥脱,软骨下骨质暴露。
2.4 统计学分析

3 实验结果
3.1 机械刺激回缩阈值(PWT)的变化
3.1.1 各组大鼠早中期(MIA注射14天内)PWT值变化
膝关节内注射MIA后,大鼠PWT值明显降低,注射8 h后大鼠PWT值为:模型组=给药组=假手术组<空白组=造模前(P<0.05)。假手术组于注射后1天恢复为正常状态。MIA注射7天后,给药组PWT值于明显高于模型组(P<0.05)。空白组造模前后PWT值变化无统计学意义(P>0.05)。表明豆腐果苷可以抑制OA大鼠的PWT值下降,如图1 所示。
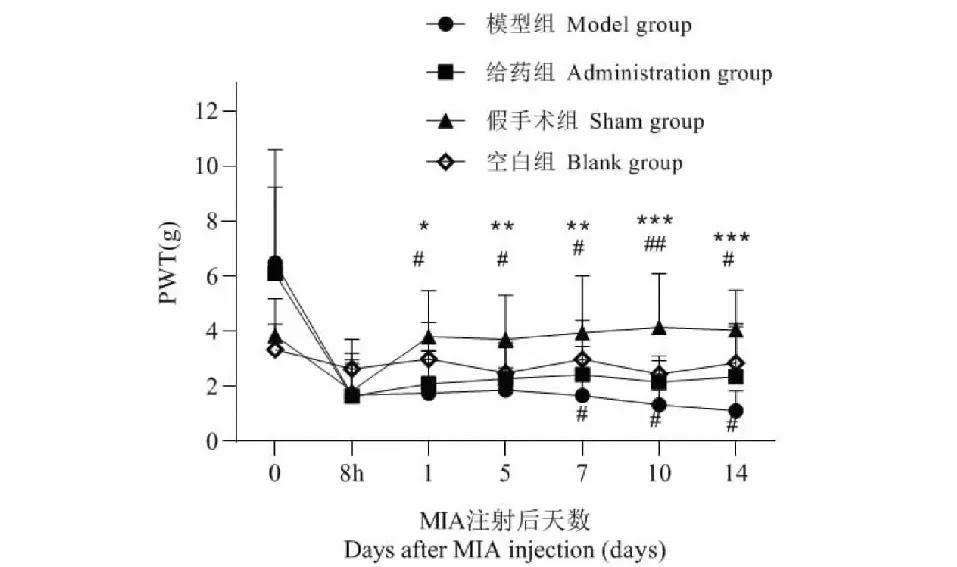
图1 MIA 注射后PWT值变化(n = 12)Fig.1 PWT changes after MIA injection (n = 12) 注:与模型组相比,*** P<0.001,** P<0.01,* P<0.05;与给药组相比,## P<0.01,# P<0.05。Note:Compared with model group, *** P<0.001, ** P<0.01,* P<0.05;Compared with administration group,##P<0.01,# P<0.05.
3.1.2 各组大鼠晚期(MIA注射14天后)PWT变化
造模后14天每组随机处死6只大鼠,剩余6只大鼠继续观察。MIA注射14天后大鼠PWT值变化较小,但给药组PWT值始终高于模型组。表明豆腐果苷长期给药对KOA的疼痛的抑制作用较为稳定,如图2 所示。

图2 MIA注射14天后PWT值变化(n = 6)Fig.2 PWT changes after 14 days of MIA injection (n = 6)注:给药组与模型组相比,给药组PWT值高于模型组,**P<0.01,*P<0.05。Note:Compared with the model group,the PWT of the administration group is higher, ** P<0.01,* P<0.05.
3.2 热刺激回缩潜伏期(PWL)的变化
3.2.1 各组大鼠早中期PWL值变化
膝关节注射MIA导致大鼠PWL值显著降低,产生热痛敏,模型组在注射后5天恢复,给药组可以于注射后1天提前改善热痛敏(P<0.05)。而假手术组和空白组PWL的改变无统计学意义,如图3 所示。
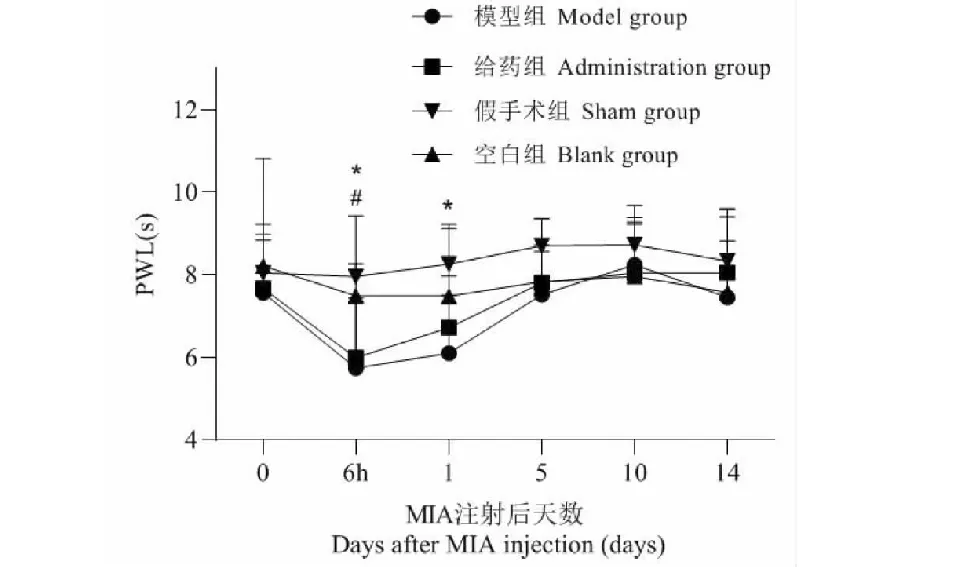
图3 MIA注射后PWL值变化(n = 12)Fig.3 The changes of PWL value after MIA injection(n = 12)注:与模型组相比,*P<0.05;与给药组相比,#P<0.05。Note:Compared with model group,*P<0.05;Compared with administration group,#P<0.05.
3.2.2 各组大鼠晚期PWL值变化
MIA注射14天后,各组大鼠PWL值变化无统计学差异,表明在晚期KOA模型中大鼠热痛阈值无明显改变,如图4 所示。
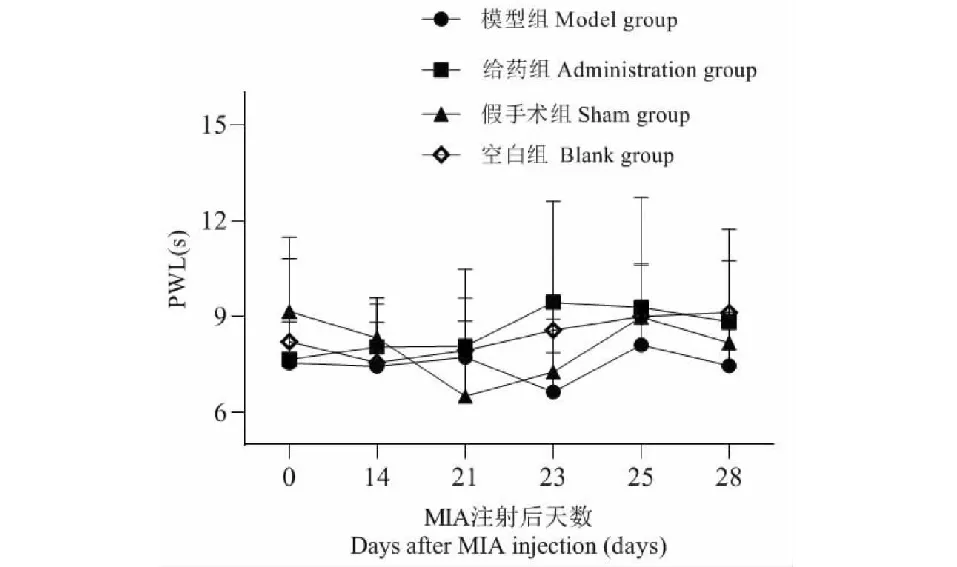
图4 MIA注射14后PWL值变化(n = 6)Fig.4 The changes of PWL value after 14 days of MIA injection (n = 6)注:各组PWL值变化无统计学意义。Note:There is no significant change in PWL.
3.3 大鼠关节的改变
3.3.1 各组大鼠关节直径差值变化
关节直径差值为大鼠活体状态下判断造模是否成功的标准之一。MIA注射后大鼠注射侧膝关节肿胀,关节直径差值显著增加,初步判断模型建立成功。模型组和给药组于MIA注射后3天关节直径差值缩小,但差值仍大于造模前。如图5、图6所示。
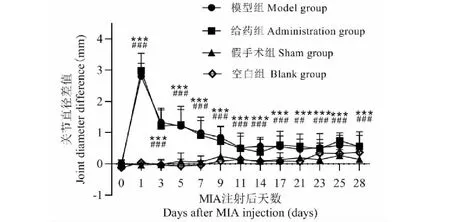
图5 关节直径差值(注射侧-非注射侧)(n = 6)Fig.5 Knee joint diameter differences (injection side - non injection side) (n = 6)注:与注射前相比,模型组:*** P<0.001,给药组:### P<0.001。Note:Compared with before injection,model group:*** P<0.001;administration group:### P<0.001.

图6 MIA注射前后大鼠膝关节照片Fig.6 Photos of knee joint of rats before and after MIA injection注:A和E:注射前;B和F:注射后;C和G:注射后1天;D和H:注射后5天。Note:A and E:Before injection;B and F:After injection;C and G:1 day after injection;D and H:5 days after injection.
3.3.2 各组大鼠关节软骨变化情况
MIA注射14天后处死取膝关节,拍照观察MIA注射侧膝关节股骨软骨改变。结果表明:空白组膝关节股骨表面光滑,软骨正常;假手术组膝关节股骨基本与空白组相同,仅少数股骨表面颜色略灰;模型组膝关节股骨软骨异常增厚,表面粗糙,部分糜烂;给药组膝关节股骨软骨增厚,但膝盖表面比模型组光滑。表明豆腐果苷可能可以抑制OA模型的股骨软骨改变,如图7所示。
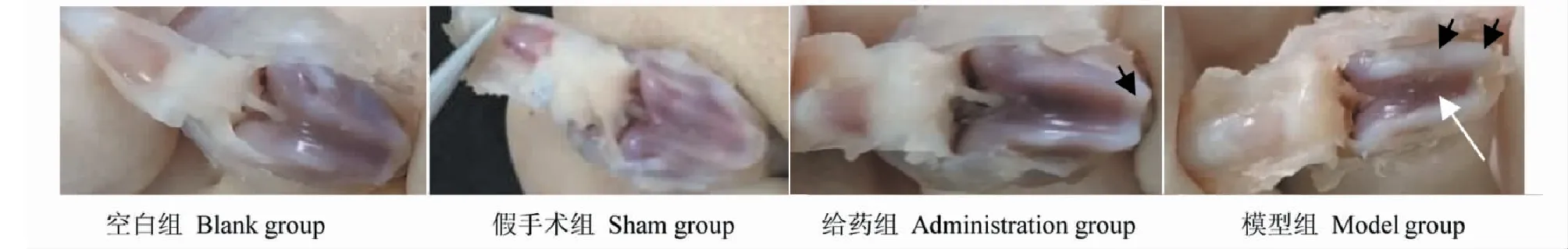
图7 大鼠膝关节股骨照片Fig.7 Photos of femur of rat knee joint 注:如图中箭头所示,给药组膝关节股骨软骨异常增厚;模型组膝关节股骨软骨异常增厚,表面粗糙,部分糜烂。Note:As shown by the arrow in figures,the femoral cartilage of administration group (H) is abnormally thickened;the femoral cartilage of model group is abnormally thickened,with rough surface and partial erosion.
对各组大鼠股骨进行大体观察评分,结果表明与假手术组或空白组相比,模型组和给药组软骨评分都明显升高,结合关节直径差值表明造模成功。其中给药组分值低于模型组,但并未表现出明显的统计学差异(P>0.05)。如表1所示。
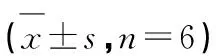
表1 大鼠股骨软骨大体观察评分表Table 1 General observation score of
3.4 大鼠DRG组织中TrkA的表达情况
MIA注射后第14天行为学评估后处死大鼠,取双侧L4 DRG组织。用免疫荧光化学法对组织进行分析。以假手术组作为对照,术侧:模型组中TrkA荧光强度增加了104.05% (P<0.01),给药组增加了49.20%(P<0.01),但显著低于模型组(P<0.05);非术侧:模型组中TrkA荧光强度也增加了48.74%(P<0.01),给药组增加了21.04%,但是非手术侧的变化差异无统计学意义。结果表明MIA膝关节腔内注射不会增加TrkA表达的细胞数,但是可使TrkA在DRG神经元细胞中表达强度增强,豆腐果苷可以抑制TrkA表达增强作用,如图8,图9所示。

图8 L4DRG中TrkA的表达(n = 6)Fig.8 Expression of TrkA in L4 DRG (n=6)注:各组术侧与假手术组相比,** P<0.01;与给药组相比,## P<0.01,# P<0.05;与非术侧相比,△ P<0.05。Note:Compared with the sham group,**P<0.01;Compared with the administration group,## P<0.01, # P<0.05;Compared with the non-operative side,△ P<0.05.
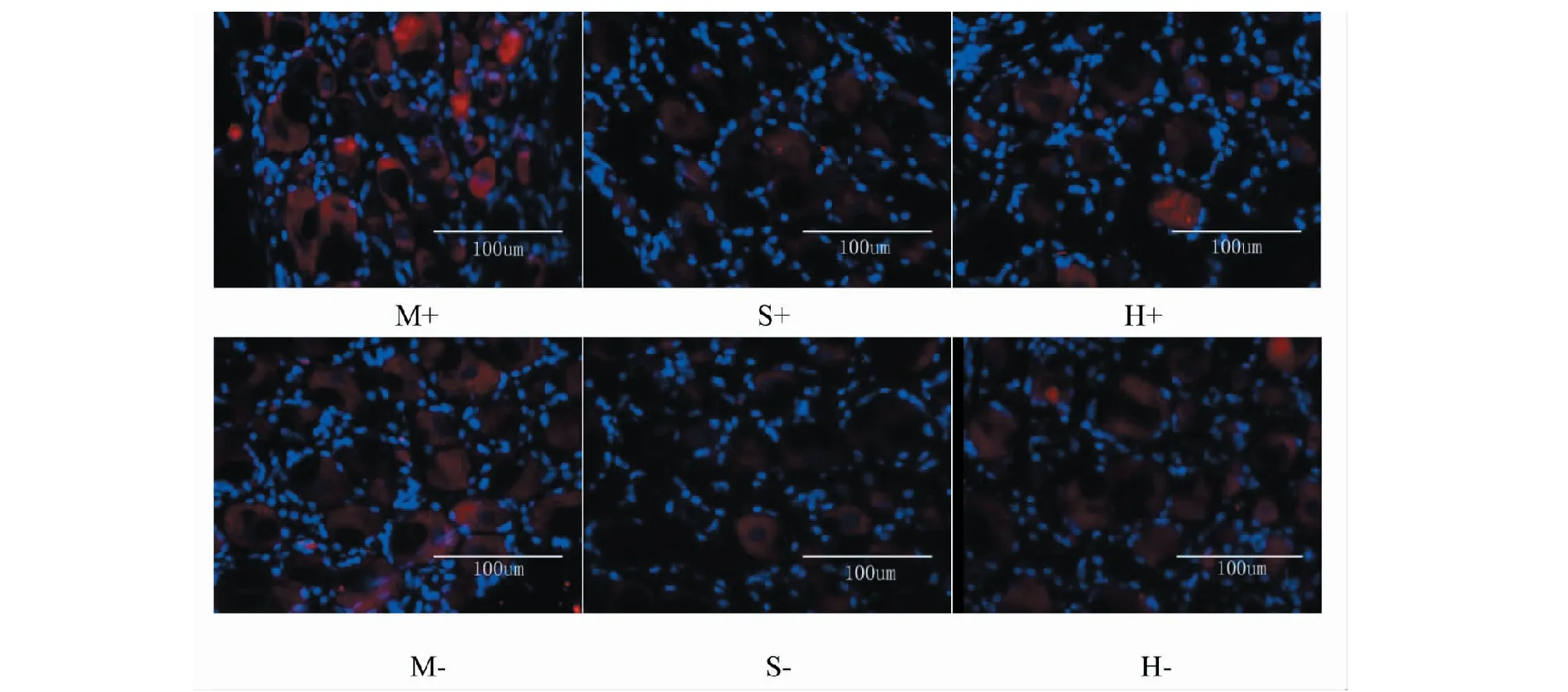
图9 L4 DRG中TrkA免疫荧光照片(EnVISION×400)Fig.9 Photos of TrkA immunofluorescence in L4 DRG注:M+:模型组手术侧;M-:模型组非手术侧;S+:假手术组手术侧;S-:假手术组非手术侧;H+:给药组手术侧;H-:给药组非手术侧。Note:M+:Operation side of model group;M-:Non-operation side of model group;S+:Operation side of sham operation group;S-:Non-operation side of sham operation group;H+:Operation side of administration group;H-:Non-operation side of administration group.
3.5 大鼠DRG组织中TRPV1的表达情况
以假手术组作为对照,TRPV1荧光强度:模型组增加了42.39%(P<0.05),给药组增加了32.49%(P<0.05);与假手术组相比,有TRPV1表达的细胞数:模型组增加了17.56% (P<0.05),给药组与模型组、假手术组之间未呈现统计学意义差距。结果表明MIA膝关节腔内注射会增加TRPV1的荧光强度和细胞数,豆腐果苷给药可以减少TRPV1在DRG中表达的细胞数,但是并未显著减少荧光强度的增加,如图10所示。

图10 L4DRG中TRPV1的表达(n = 6)Fig.10 Expression of TRPV1 in L4 DRG (n = 6)注:与假手术组相比, * P<0.05。Note:Compared with the sham group,* P<0.05.
4 讨论
KOA是常见的关节病变,患病率较高,严重影响患者的生活质量。目前常用的治疗方法为基础治疗、药物治疗和手术治疗。基础治疗一般为控制体重,改变不良生活习惯等,主要为KOA初期的改善措施;药物治疗为单独基础治疗无效时使用非甾体抗炎药等对疼痛和关节病变进行治疗;手术治疗常用关节置换术等,用于药物治疗无效的患者。在KOA的梯度治疗和个体化治疗中,药物治疗接受程度较高,但是因各种不良反应等目前常用的非甾体抗炎药等无法用于长期治疗[6]。
根据骨关节炎诊疗指南(2017版),减轻或消除疼痛是KOA的主要治疗目标之一。因此本实验主要对KOA引起的疼痛进行了研究,结果表明豆腐果苷50 mg/kg可以抑制KOA机械痛,作用稳定,但是始终未能使痛敏完全消失,可能需要改变豆腐果苷剂量,寻找最佳剂量,或尝试与其他药物联合使用以增强疗效,但还有待研究。此外,豆腐果苷50 mg/kg仅对早期KOA的热痛有抑制作用,对中晚期KOA大鼠的PWL值无明显影响。本试验中KOA大鼠仅在早期(造模前7天)出现了热痛敏,而在造模7天后热痛敏消失,PWL值恢复正常,豆腐果苷并不能提高正常大鼠的热痛敏,因此对于中晚期KOA大鼠的PWL值并无升高作用。
NGF-TrkA-TRPV1信号通路是疼痛信号产生和传递的关键通路。当NGF、TrkA、TRPV1先天性缺陷时,动物会产生先天性痛觉不敏[3]。TRPV1作为疼痛发生器,主要分布在DRG等神经节中,可以被多种刺激激活,如物理刺激;IL-1β、TNF-α等炎性因子表达增加;PI3K、PKC、TrkA等通道激活等。TRPV1在KOA的慢性疼痛中可以通过PKC活化在DRG神经元中致敏,且有研究表明TRPV1拮抗剂可以减轻急性炎性关节痛[14]。因此,TRPV1也是KOA治疗的潜在靶标之一。但是值得思考的是:单次关节内注射RTX(树脂毒素,一种TRPV1激动剂)可以对KOA疼痛进行长期缓解[15],与本实验结果不一致。可能是因为RTX持续的刺激使TRPV1去磷酸化而产生了脱敏现象(又称为快速耐受)等,从而使疼痛缓解。本试验中使用的关节内给MIA并未产生脱敏现象,可能是MIA浓度还未达到标准或者是MIA本身并无此作用。
TrkA作为NGF的特异性受体可以通过激活PI3K、PLC等降低TRPV1 的开放阈值;激活p38MAPK的转录和翻译上调TRPV1的表达产生反馈作用,使伤害感受器进一步释放炎性因子而降低痛阈。抑制软骨组织、关节滑膜附近的肥大细胞、滑膜感觉神经元、背根神经节等中的TrkA受体作用,都可以抑制KOA疼痛。NGF-TrkA信号的阻断是抑制KOA疼痛的有效措施,TrkA的选择性抑制剂具有缓解KOA疼痛的潜力[16],如ASP7962、AR786等,目前已进入临床试验阶段。
神经生长因子(NGF)是骨关节炎(OA)疼痛的主要驱动因素,NGF抗体是有效的镇痛药[17],缓解疼痛效果良好持久,但有关节相关的副作用发生,如原发性骨坏死、水肿、肢体感觉异常等,因此NGF抗体的使用还有待优化[18]。
本实验中,豆腐果苷可以抑制KOA大鼠DRG中TrkA、TRPV1的表达水平,是其减轻KOA疼痛的机制之一。在疼痛信号的传递过程中NGF可以与TrkA特异性结合传递疼痛信号,也可与TRPV1受体直接结合,因此推测豆腐果苷可能对NGF的作用也有一定的抑制,但还需研究进一步验证。
目前有研究[19]表明豆腐果苷类似物天麻素可以预防IL-1β诱导的软骨细胞凋亡,抑制核因子κB(NF-κB)途径,减少炎症介质(IL-6、TNF-α)的释放,并减少IL-1β处理的软骨细胞中的基质分解代谢,改善KOA模型大鼠的软骨退化。豆腐果苷与天麻素结构相似,在治疗神经病理性疼痛和炎性疼痛中机制相似,因此我们推测在KOA中,豆腐果苷可能与天麻素有相同的机制,也可以通过抑制炎性介质释放等途径,同时改善KOA大鼠的疼痛和软骨退化,对治疗KOA产生重要作用,但还有有待实验进一步验证。
综上所述,豆腐果苷可以抑制KOA疼痛,抑制TrkA-TRPV1信号通路为其机制之一。但是豆腐果苷用于KOA疼痛的治疗还需要更多的实验进行说明,其具体机制也还需要进一步完善。
致谢:感谢皖南医学院麻醉学实验实训中心和人体解剖教研室提供的仪器和技术支持。

