云南火焰兰转录组SSR分布及其序列特征分析
辛静 辛雅萱 董章宏 瞿绍宏 姚国琼 李凤 屈亚亚 唐军荣
摘要:【目的】分析云南火焰蘭转录组中SSR分布及其序列分布特征,为大量开发EST-SSR引物及开展火焰兰属乃至兰科植物的SSR遗传多样性分析、种质资源评价、遗传图谱构建及遗传育种提供理论依据。【方法】以云南火焰兰无菌苗幼嫩叶片为材料,利用高通量测序技术进行转录组测序,使用Trinity对测序结果进行de novo组装,并以MISA对获得的Unigene进行SSR位点搜索,然后利用Excel 2010对云南火焰兰转录组中SSR出现频率、平均分布距离、基元类型及其重复类型组成等进行统计分析。【结果】从77888条去冗余的Unigenes序列中搜索到5051个SSR位点,其中有414个属于复合型SSR位点,实际以4637个SSR位点进行分析,SSR出现频率为5.95%,平均分布距离13.53 kb。SSR位点中,二核苷酸为主要重复基元类型,数量最多,占SSR总数的52.21%,其次是三核苷酸重复基元,占39.42%,四核苷酸重复基元~六核苷酸重复基元数量较少。其中,二核苷酸重复基元中的主要重复类型为CT/GA,占SSR总数的20.64%,三核苷酸重复基元的主要重复类型为CTT/GAA,占SSR总数的4.70%。SSR基元各重复类型的重复次数以5~8次居多,占SSR总数的73.35%,其中,占比最多的是6次重复,占SSR总数的26.98%,其次是5次和7次,分别占SSR总数的23.08%和14.02%,且SSR数量随各基元重复次数的增加而降低。云南火焰兰转录组中SSR基序的平均长度是18.28 bp,其中大小为12~20 bp的SSR基序占SSR总数的77.49%,21~30 bp基序占SSR总数的17.88%,大于30 bp的基序占SSR总数的4.63%,且SSR分布频率随基序长度的增加而下降。【结论】云南火焰兰转录组SSR中低级基元类型较丰富,开发出多态性高的SSR引物潜力较高,可用于云南火焰兰乃至火焰兰属植物的遗传多样性及种质资源评价、遗传图谱构建及遗传育种等研究。
关键词: 云南火焰兰;转录组;SSR;分布;序列特征;重复基元
中图分类号: S682.31 文献标志码: A 文章编号:2095-1191(2020)07-1634-08
Abstract:【Objective】The analysis of SSR distribution and sequence distribution characteristics in the transcriptome of Renanthera imschootiana Rolfe provided a theoretical basis for the development of EST-SSR primers, SSR genetic diversity analysis, germplasm resource evaluation, genetic map construction and genetic breeding of Renanthera and even Orchidaceae. 【Method】The young leaves of aseptic R. imschootiana seedlings were used as material to perform transcriptome sequencing by high throughput sequencing. The de novo assembly of the sequencing results was conducted by Trinity, SSR loci search was performed using MISA. Excel 2010 was used to analyze the occurrence frequency, average distribution distance, primitive type and the composition of repetition of SSR in the transcriptome of R.imschootiana. 【Result】A total of 5051 SSR loci were searched from 77888 remove redundant Unigenes sequences, among them, 414 were compound SSR loci, then 4637 SSR loci were used as actual research object. SSR occurrence frequency was 5.95% and avera-ge distribution distance was 13.53 kb. In these SSR loci, dinucleotide repeat units were the main type, accounting for 52.21%, followed by the trinucleotide repeat units(39.42%). The proportion of tetranucleotide repeat units to hexanucleotide repeat units was low. The main repeat motif types in dinucleotide was CT/GA , accounting for 20.64% of the total SSR, the main repeat motif types in trinucleotide was CTT/GAA, accounting for 4.70% of the total SSR. The types of SSR repeat units were more of 5-8 repetition times, accounting for 73.35% of the total SSR. The proportion of 6-repetition was the largest with 26.98% proportion of the total SSR, followed by 5-repetition(23.08%) and 7-repetition(14.02%). As the number of primitive repeats increased, SSR reduced. The average length of SSR sequence motif in the transcriptome of R.imschootiana was 18.28 bp, among them, the SSR sequence motif of 12-20 bp was accounting for 77.49% in the total SSR, the SSR motif of 21-30 bp was accounting for 17.88%, and SSR motif over 30 bp was accounting for 4.63% in the total SSR the distribution frequency of SSR reduced with increasing of motif length. 【Conclusion】The transcriptome SSR of R.imschootiana is rich in low-level primitive types and has a high potential to develop SSR primers with high polymorphism, which can be used to study the genetic diversity and germplasm resources evaluation, genetic map construction and genetic breeding of R.imschootiana and even the Renanthera plants.
Key words: Renanthera imschootiana Rolfe; transcriptome; SSR; distribution; sequence characteristics; repeat primitive
Foundation item: Joint Special Project of Agricultural Basic Research in Yunnan[2017FG001(-019)]
0 引言
【研究意义】云南火焰兰(Renanthera imschoo-tiana Rolfe)为兰科(Orchidaceae)火焰兰属(Renanthera)附生植物,因其花色红而艳丽,犹如火焰而得名,主要生长于云南元江县(吴征镒和洪德元,1999;中国科学院昆明植物研究所,2003)。野生云南火焰兰的分布范围狭窄、数量极少,且近年来遭到严重采挖,致使其野生种质资源濒临灭绝,现已被列入《中国生物多样性红色名录——高等植物卷》的极危(CR)物种和《濒危野生动植物种国际贸易公约》附录I物种(李娟等,2018)。利用高通量测序数据,统计并分析云南火焰兰SSR分布及其特征,以期开发出大量SSR引物,对云南火焰兰种质资源评价、保护利用及遗传育种具有重要意义。【前人研究进展】目前,有关云南火焰兰的研究报道主要涉及离体快速繁殖(林丹妮等,2006)、种子无菌萌发和试管育苗(林丹妮等,2008)、杂交育种(曹雯静等,2014;陈和明等,2019)、种质资源评价(姚婧,2015)及种群现状分析(李娟等,2018)等,而有关其分子生物学方面的研究鲜见报道。SSR分子标记具有多态性高、标记数量多、重复性好、覆盖面广等优点,已广泛应用于分子标记辅助选择、遗传多样性分析和遗传图谱构建等领域(王大玮等,2018;张金旺等,2018)。根据SSR的来源可将其分为基因组SSR和EST-SSR两大类型(程小毛和黄晓霞,2011),前者是利用cDNA文库构建和基因组测序的方法获得,该方法步骤繁琐、工作量大且成本高;后者则通过搜索公共数据库中的EST(表达序列标签)或转录组测序数据进行开发,需要大量EST数据支持(赵能等,2017)。叶鹏等(2019a,2019b)先后对药用植物金铁锁(Psammosilene tunicoides)和云南金花茶(Camellia fascicularis)转录组SSR位点信息及序列特征进行分析,结果发现二者的转录组中SSR出现频率均较高,基元类型较丰富,重复频次也较高,从而表现出高的多态性潜力。此外,研究人员还对云南松(Pinus yunnanensis)(蔡年辉等,2015)、杜仲(Eucommia ulmoides)(申响保等,2016)、四球茶(Camellia tetracocca)(黎瑞源等,2017)、木荷(Schima superba)(林艳等,2018)、牛樟(Cinnamomum kanehirae)(郭莺等,2018)、芒果(Mangifera indica)(唐玉娟等,2018)、三七(Panax notoginseng)(揭应碧等,2018)和牡丹(贺丹等,2019)等植物进行转录组SSR位点信息分析,为深入开展植物遗传结构和遗传多样性及分子标记辅助育种提供了前期基础数据。【本研究切入点】云南火焰兰在分子水平的研究基础非常薄弱,至今未见有关云南火焰兰转录组SSR分布及其序列特征的研究报道。【拟解决的问题】对云南火焰兰进行转录组测序,并分析转录组中SSR数量、出现频率及分布距离等,明确云南火焰兰高多态性SSR序列的分布特征,为大量开发EST-SSR引物及开展火焰兰属乃至兰科植物的SSR遗传多样性分析、种质资源评价、遗传图谱构建及遗传育种等提供理论依据。
1 材料与方法
1. 1 试验材料
供试云南火焰兰种植于云南元江县,采集长势好且无病虫害云南火焰兰母株上的果荚,采用种子无菌萌发成苗后,取其幼嫩叶片,迅速放入液氮中保存备用。
1. 2 转录组测序
将云南火焰兰幼嫩叶片采用干冰保存后送至广州基迪奥生物科技有限公司,后续RNA提取、文库构建及测序工作均由该公司完成,测序平台为Illumina HiSeqTM 4000。
1. 3 序列拼接及SSR位点搜索
使用Trinity对云南火焰兰转录组测序结果进行de novo组装,并使用MISA(http://pgrc.ipk-gatersleben.de/misa/)对转录组中所有的Unigenes进行SSR位点搜索,参数设为二核苷酸重复次数至少6次,三核苷酸重复次数至少5次,四核苷酸~六核苷酸重复次数至少4次。
1. 4 统计分析
利用Excel 2010对云南火焰兰转录组中SSR出现频率、平均分布距离、基元类型及其重复类型组成等进行统计分析(张震等,2018;杨帅等,2020),相关计算公式如下:
SSR出现频率=SSR数量/Unigene总数
SSR位点平均分布距离=SSR总序列长度/SSR数量
2 结果与分析
2. 1 云南火焰兰转录组中SSR出现频率和分布距离
通过对云南火焰兰转录组进行组装,共获得77888条去冗余的Unigenes,长度为201~16505 bp,平均长度805 bp,总长度62740868 bp,GC含量42.73%。从中搜索出5051个SSR位点,其中,有414个属于复合型SSR位点,实际以4637个SSR位點进行分析。SSR出现频率为5.95%,平均分布距离13.53 kb(表1),即云南火焰兰转录组中平均13.53 kb就出现1个SSR位点,说明SSR较丰富,为后期SSR引物开发提供了大量的基础数据。
2. 2 云南火焰兰转录组中SSR基元类型
由表1可知,SSR位点中,二核苷酸为主要重复基元类型,数量最多,占SSR总数的52.21%,其次为三核苷酸重复基元,占SSR总数的39.42%;四核苷酸~六核苷酸重复基元数量相对较少;在SSR的平均分布距离方面,以五核苷酸重复基元最高,为1206.56 kb,以二核苷酸重复基元最低,仅为25.92 kb;在重复基元类型的出现频率方面,以二核苷酸重复基元最高,为3.11%;三核苷酸重复基元次之,为2.35%,以五核苷酸重复基元最低,仅占0.07%。可见,云南火焰兰存在较多种类型的SSR基元,是其SSR引物开发的重要保证。
2. 3 云南火焰兰转录组中SSR碱基组成及比例
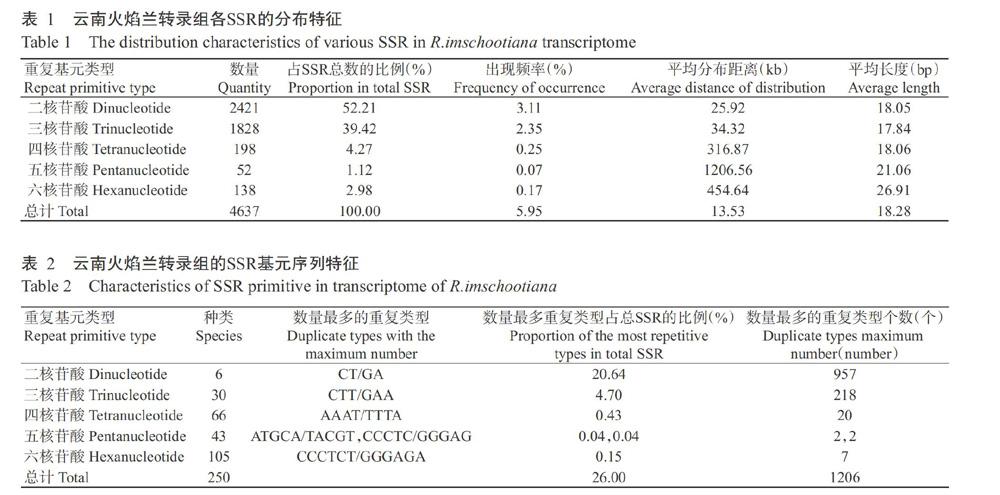
云南火焰兰转录组中的SSR碱基组成及比例如表2所示。云南火焰兰转录组SSR中,二核苷酸~六核苷酸重复基元的重复类型分别有6、30、66、43和105种,共有250种。二核苷酸中重复基元各基序所占比例排序为CT/GA(957个,占SSR总数的20.64%)>TC/AG(851个,占SSR总数的18.35%)>AC/TG(241个,占SSR总数的5.20%)>CA/GT(188个,占SSR总数的4.05%)>AT/TA(172个,占SSR总数的3.71%)>CG/GC(12个,占SSR总数的0.26%),分别占双碱基重复类型的比例为39.53%、35.15%、9.95%、7.77%、7.10%和0.50%(图1-A)。三核苷酸重复基元最多的为CTT/GAA(218个),占SSR总数的4.70%,占三碱基重复类型的11.93%;其次是AAG/TTC(178个),占SSR总数的3.84%,占三碱基重复类型的9.74%;以ATA/TAT最少(6个),占SSR总数的0.13%,占三堿基重复类型的0.33%(图1-B)。四核苷酸重复基元最多的为AAAT/TTTA(20个),占SSR总数的0.43%,占四碱基重复类型的10.10%(图1-C)。五核苷酸重复基元最多的是ATGCA/TACGT(2个)和CCCTC/GGGAG(2个),均占SSR总数的0.04%,占五碱基重复类型的3.85%(图1-D)。六核苷酸重复基元最多的是CCCTCT/GGGAGA(7个),占SSR总数的0.15%,占六碱基重复类型的5.07%(图1-E)。综上所述,云南火焰兰转录组SSR碱基组成中,低级基元类型较丰富,可在该种或该属植物中检出较多的遗传多态性。
2. 4 云南火焰兰转录组中各基元重复次数
SSR基元重复类型的重复次数以5~8次居多,共计3401个,占SSR总数的73.35%,其中,占比最多的是6次重复,共计1251个,占SSR总数的26.98%;其次是5次和7次,分别为1070个和650个,占SSR总数的23.08%和14.02%。三核苷酸重复基元中重复类型最多的是5次,共993个,且SSR数量随各基元重复次数的增加而降低(图2)。
2. 5 云南火焰兰转录组中SSR基序大小
云南火焰兰转录组中大小为12~20 bp的SSR基序共计3593个,占SSR总数的77.49%,说明从该转录组信息开发出多态性高的SSR引物潜力较高。21~30 bp基序有829个,占SSR总数的17.88%;大于30 bp的基序有215个,占SSR总数的4.63%。SSR基序的平均长度是18.28 bp,二核苷酸~六核苷酸的平均长度分别是18.05、17.84、18.06、21.06和26.91 bp(表1),且SSR的分布频率随着基序长度的增加而呈下降趋势(图3)。
3 讨论
本研究对云南火焰兰转录组测序获得的77888条Unigenes进行SSR位点搜索,共获得二核苷酸重复基元~六核苷酸重复基元的SSR位点4637个,SSR出现频率5.95%,平均分布距离13.53 kb。前人研究发现,从墨兰(Cymbidium sinense)转录组测序获得的51764条Unigenes中搜索到4419个SSR位点(陈起馨,2016);从金钗石斛(Dendrobium nobile)转录组测序获得的207283条Unigenes中搜索到32709个SSR位点(李清等,2017);从寒兰(Cymbidium kanran)转录组测序获得的68699条Unigenes中搜索到9837个SSR位点(张亚楠等,2017)。可见,云南火焰兰的SSR位点数量与其亲缘关系较近的物种均存在一定差异。就SSR出现频率而言,本研究云南火焰兰SSR出现频率(5.95%)高于同科的铁皮石斛(Dendrobium officinale)(5.11%)(肖冬长等,2012),却低于同科的金钗石斛(15.78%)(李清等,2017)、寒兰(14.32%)(张亚楠等,2017)和天麻(Gastrodia elata)(8.16%)(周天华等,2017)的SSR出现频率。但就平均分布距离来看,本研究云南火焰兰SSR平均分布距离(13.53 kb)高于同科的墨兰(11.45kb)(陈起馨,2016)、金钗石斛(3.75 kb)(李清等,2017)、寒兰(6.25 kb)(张亚楠等,2017)和白及(Bletilla striata)(4.35 kb)(陈红波,2019),与灯盏花(Erigeron breviscapus)(15.32 kb)(陈茵等,2014)和马尾松(Pinus massoniana)(13.83 kb)(陈晓明等,2018)相当。可见,云南火焰兰转录组中SSR出现频率及其分布距离处于中等水平,且不同物种转录组测序信息存在明显差异,一方面可能是其本身基因组差异的客观表现;另一方面可能是测序组织器官、转录组中Unigene数量和长度、SSR搜索工具及设定筛选参数等差异引起(李俊仁等,2018)。
二核苷酸和三核苷酸是多种植物转录组中SSR的主要基元类型,但各基元类型占比有所差异(李翠婷等,2014;叶鹏等,2019a,2019b)。本研究中SSR以二核苷酸重复基元居多,占SSR总数的52.21%;其次是三核苷酸重复基元,占39.42%。在云南火焰兰转录组中,二核苷酸重复基元以CT/GA为主,占SSR总数的20.64%;三核苷酸重复基元中,以CTT/GAA为主,占SSR总数的4.70%。这与蝴蝶兰(Phalaenopsis spp.)(李冬梅等,2011)、石斛(Dendrobium)(邱道寿等,2013)和天麻(周天华等,2017)等植物的重复类型相同,但在杉木(Cunninghamia lanceolata)(文亚峰等,2015)、思茅松(P. kesiya)(赵能等,2017)和金铁锁(叶鹏等,2019a)等植物中以三核苷酸重复基元类型数量最多,其次是其他核苷酸重复基元类型,造成这种差异的原因可能与物种的不同有关。
SSR多态性是判断其有效性的主要依据,而其主要影响因素是SSR长度(李翠婷等,2014)。研究表明,当SSR长度大于20 bp时多态性较高,长度为12~20 bp时呈多态性中等水平,长度小于12 bp时多态性很低(Temnykh et al.,2001;杨华等,2011)。云南火焰兰转录组中,有4422条SSR基序大小主要集中在12~30 bp,占SSR总数的95.37%,其中,基序大小12~20 bp的SSR有3593条,占SSR总数的77.49%,呈中等多态性;长度大于20 bp的基序有1275条,占SSR总数的27.50%,呈较高多态性。Gao等(2003)研究发现,重复次数和SSR分子标记多态性间呈正相关。Dreisigacker等(2004)研究表明,低级基元SSR多态性普遍高于高级基元SSR。本研究表明,云南火焰兰转录组SSR中低级基元二核苷酸和三核苷酸长度大于20 bp的基序有1022條,占SSR总数的22.04%,推测云南火焰兰SSR具有较高的多态性。因此,该推论可作为潜在的SSR引物序列信息,极大地提高引物设计和开发的目的性,为后续SSR引物的大量开发提供基础数据。
4 结论
云南火焰兰转录组SSR中低级基元类型较丰富,开发出多态性高的SSR引物潜力较高,可用于云南火焰兰乃至火焰兰属植物的遗传多样性及种质资源评价、遗传图谱构建及遗传育种等研究。
参考文献:
蔡年辉,许玉兰,徐杨,邓丽丽,周丽,王大伟,何承忠,段安安. 2015. 云南松转录组SSR的分布及其序列特征[J]. 云南大学学报(自然科学版),37(5):770-778. [Cai N H,Xu Y L,Xu Y,Deng L L,Zhou L,Wang D W,He C Z,Duan A A. 2015. The distribution and characteristics of SSR in trsnscriptome of Pinus yunnanensis[J]. Journal of Yunnan University(Natural Science),37(5):770-778.]
曹雯静,李虹侠,唐源江,吴坤林. 2014. 4个火焰兰属内及属间杂交新组合F1代核型分析[J]. 亚热带植物科学,43(1):19-23. [Cao W J,Li H X,Tang Y J,Wu K L. 2014. Karyotype analysis of four intragenus and intergenus hybridized combinations F1 generation of Renanthera[J]. Subtropical Plant Science,43(1):19-23.]
陈红波. 2019. 基于白及转录组数据的EST-SSR分子标记开发、验证及应用[D]. 遵义:遵义医科大学. [Chen H B. 2019. The development,validation and utilization of EST-SSR markers based on the transcriptome data in Bletilla striata[D]. Zunyi:Zunyi Medical University.]
陈和明,吕复兵,肖文芳,李佐,蒋明殿. 2019. 蝴蝶兰与火焰兰远缘杂交育种初探[J]. 中国农业大学学报,24(8):60-71. [Chen H M,Lü F B,Xiao W F,Li Z,Jiang M D. 2019. Preliminary study on the intergeneric hybridization breeding between Phalaenopsis and Renanthera[J]. Journal of China Agricultural University,24(8):60-71.]
陈起馨. 2016. 兰花分子图谱的构建[D]. 广州: 华南农业大学. [Chen Q X. 2016. A linkage map construction of Cymbidium using SSR marker[D]. Guangzhou:South China Agricultural University.]
陈晓明,李魁鹏,陈博雯,刘青华,周志春. 2018. 马尾松转录组SSR序列特征分析及其分子标记开发[J]. 分子植物育种,16(19):6407-6414. [Chen X M,Li K P,Chen B W,Liu Q H,Zhou Z C. 2018. Characterization analysis of SSR sequences in the transcriptome of Pinus massoniana and its molecular marker development[J]. Molecular Plant Breeding,16(19):6407-6414.]
陈茵,李翠婷,姜倪皓,杨生超,陈军文,杨建文,张广辉. 2014. 灯盏花转录组中SSR位点信息分析及其多态性研究[J]. 中国中药杂志,39(7):1220-1224. [Chen Y,Li C T,Jiang N H,Yang S C,Chen J W,Yang J W,Zhang G H. 2014. SSR information in Erigeron breviscapus transcriptome and polymorphism analysis[J]. China Journal of Chinese Materia Medica,39(7):1220-1224.]
程小毛,黄晓霞. 2011. SSR标记开发及其在植物中的应用[J]. 中国农学通报,27(5):304-307. [Cheng X M,Huang X X. 2011. Development and application of SSR markers in plants[J]. Chinese Agricultural Science Bulletin,27(5):304-307.]
郭鶯,孟红岩,林文珍,林志楷,刘黎卿. 2018. 牛樟EST-SSR标记的开发及遗传多态性分析[J]. 热带作物学报,39(8):1561-1569. [Guo Y,Meng H Y,Lin W Z,Lin Z K,Liu L Q. 2018. Developing EST-SSR markers in Cinnamomum kanehirae and analyzing the genetic polymorphism[J]. Chinese Journal of Tropical Crops,39(8):1561-1569.]
贺丹,吴芳芳,张佼蕊,谢栋博,李小康,刘艺平,栗燕,何松林. 2019. 牡丹转录组SSR信息分析及其分子标记开发[J]. 江苏农业学报,35(6):1428-1433. [He D,Wu F F,Zhang J R,Xie D B,Li X K,Liu Y P,Li Y,He S L. 2019. Analysis of SSR information in transcriptome and development of molecular markers in Paeonia suffruticosa[J]. Jiangsu Journal of Agricultural Science,35(6):1428-1433.]
揭应碧,卢迎春,宋婉玲,韦坤华,张广辉,杨生超. 2018. 三七基因组SSR位点分析和多态性引物开发[J]. 热带作物学报,39(7):1351-1358. [Jie Y B,Lu Y C,Song W L,Wei K H,Zhang G H,Yang S C. 2018. Analysis of SSR loci information in Panax notoginseng genomes and polymorphic primers development[J]. Chinese Journal of Tropical Crops,39(7):1351-1358.]
李翠婷,张广辉,马春花,孟珍贵,陈军文,杨生超. 2014. 野三七转录组中SSR位点信息分析及其多态性研究[J]. 中草药,45(10):1468-1472. [Li C T,Zhang G H,Ma C H,Meng Z G,Chen J W,Yang S C. 2014. Analysis on SSR loci information in transcriptome of Panax vienamensis var. fuscidiscus and its polymorphism[J]. Chinese Traditional and Herbal Drugs,45(10):1468-1472.]
李冬梅,吕复兵,朱根发,洪彦彬,陈小平,梁炫强,操军喜,孙映波. 2011. 蝴蝶兰EST资源的SSR信息分析[J]. 广东农业科学,38(3):117-120. [Li D M,Lü F B,Zhu G F,Hong Y B,Chen X P,Liang X Q,Cao J X,Sun Y B. 2011. Analysis of SSR information in EST resource of Phalaenopsis spp.[J]. Guangdong Agricultural Science,38(3):117-120.]
李娟,石明,吕亚媚,杨锦超,杜凡. 2018. 极危植物云南火焰兰的发现及种群现状[J]. 林业科学研究,31(3):9-14. [Li J,Shi M,Lü Y M,Yang J C,Du F. 2018. Discovery of an extremely endangered species Renanthera imschootiana and its population situation[J]. Forest Research,31(3):9-14.]
李俊仁,陈秀珍,汤小婷,何瑞,詹若挺. 2018. 穿心莲转录组SSR位点信息分析[J]. 中国中药杂志,43(12):2503-2508. [Li J R,Chen X Z,Tang X T,He R,Zhan R T. 2018. SSR loci information analysis in transcriptome of Andrographis paniculata[J]. China Journal of Chinese Materia Medica,43(12):2503-2508.]
李清,李标,郭顺星. 2017. 金钗石斛转录组SSR位点信息分析[J]. 中国中药杂志,42(1):63-69. [Li Q,Li B,Guo S X. 2017. SSR information in transcriptome of Dendro-bium nobile[J]. China Journal of Chinese Materia Medica,42(1):63-69.]
黎瑞源,邢辉,申铁. 2017. 四球茶转录组SSR位点信息分析[J]. 安徽农业大学学报,44(4):558-562. [Li R Y,Xing H,Shen T. 2017. Analysis of SSR information in Camellia tetracocca Zhang transcriptome[J]. Journal of Anhui Agricultural University,44(4):558-562.]
林丹妮,曾宋君,陳之林,段俊. 2006. 云南火焰兰的离体快速繁殖[J]. 植物生理学通讯,42(1):77. [Lin D N,Zeng S J,Chen Z L,Duan J. 2006. In vitro propagation of Renanthera imschootiana Rolfe[J]. Plant Physiology Communication,42(1):77.]
林丹妮,陈之林,段俊,吴坤林,曾庆君. 2008. 云南火焰兰种子无菌萌发和试管育苗[J]. 热带亚热带植物学报,16(1):83-88. [Lin D N,Chen Z L,Duan J,Wu K L,Zeng Q J. 2008. Seed germination in vitro of Renanthera inschootiana Rolfe[J]. Journal of Tropical and Subtropical Botany,16(1):83-88.]
林艳,何紫迪,毛积鹏,蒋开彬,王金榜,黄少伟. 2018. 木荷基因组SSR位点开发及初步分析[J]. 热带作物学报,39(9):1766-1771. [Lin Y,He Z D,Mao J P,Jiang K B,Wang J B,Huang S W. 2018. Development and preliminary analysis of SSR locus in Schima superba genome[J]. Chinese Journal of Tropical Crops,39(9):1766-1771.]
邱道寿,郑希龙,蔡时可,郑锦荣,罗焕明,张蕾,邓瑞云,李武,刘晓津. 2013. 石斛SSR标记的开发及可转移性分析[J]. 植物科学学报,31(5):500-509. [Qiu D S,Zheng X L,Cai S K,Zheng J R,Luo H M,Zhang L,Deng R Y,Li W,Liu X J. 2013. Development and transfer analysis of SSR in Dendrobium[J]. Plant Science Journal,31(5):500-509.]
申响保,闫文德,梁小翠,孙志强. 2016. 杜仲转录组微卫星特征分析[J]. 经济林研究,34(4):47-51. [Shen X B,Yan W D,Liang X C,Sun Z Q. 2016. Characteristic analysis of microsatellites in Eucommia ulmoides transcriptome[J]. Nonwood Forest Research,34(4):47-51.]
唐玉娟,黄国弟,罗世杏,周俊岸,莫永龙,李日旺,赵英,张宇,宋恩亮,宁琳. 2018. 芒果2个不同花分化时期转录组分析[J]. 南方农业学报,49(7):1257-1264. [Tang Y J,Huang G D,Luo S X,Zhou J A,Mo Y L,Li R W,Zhao Y,Zhang Y,Song E L,Ning L. 2018. Transcriptome of Mangifera indica L. in two different flower bud differentiation stages[J]. Journal of Southern Agriculture,49(7):1257-1264.]
王大玮,保云莹,唐红燕,段安安,蔡年辉,许玉兰,周军,李思广. 2018. 思茅松SSR-PCR反应体系优化研究[J]. 西南林业大学学报(自然科学版),38(5):34-37. [Wang D W,Bao Y Y,Tang H Y,Duan A A,Cai N H,Xu Y L,Zhou J,Li S G. 2018. Optimization of SSR-PCR reaction system in Pinus kesiya var. langbianensis[J]. Journal of Southwest Forestry University(Natural Science),38(5):34-37.]
文亚峰,韩文军,周宏,徐刚标. 2015. 杉木转录组SSR挖掘及EST-SSR标记规模化开发[J]. 林业科学,51(11):40-49. [Wen Y F,Han W J,Zhou H,Xu G B. 2015. SSR mining and development of EST-SSR markers for Cunninghamia lanceolata based on transcriptome sequences[J]. Scientia Silvae Sinicae,51(11):40-49.]
吴征镒,洪德元. 1999. 中国植物志(第19卷)[M]. 北京:科学出版社. [Wu Z Y,Hong D Y. 1999. Flora of China(Vol. 19)[M]. Beijing:Science Press.]
肖冬长,张智俊,管雨. 2012. 铁皮石斛微卫星SSR设计与应用[J]. 生物技术通报,(7):88-92. [Xiao D C,Zhang Z J,Guan Y. 2012. Microsatellite markers primer designing and screening from Dendrobium officinale[J]. Biotechno-logy Bulletin,(7):88-92.]
杨华,陈琪,韦朝领,史成颖,方从兵,宛晓春. 2011. 茶树转录组中SSR位点的信息分析[J]. 安徽农业大学学报,38(6):882-886. [Yang H,Chen Q,Wei C L,Shi C Y,Fang C B,Wan X C. 2011. Analysis on SSR information in Camellia sinensis transcriptome[J]. Journal of Anhui Agricultural University,38(6):882-886.]
杨帅,杨喜翠,何方,李鲁华,李振华,任明见,徐如宏. 2020. 贵紫麦1号转录组EST-SSR标记发掘与应用[J]. 河南农业科学,49(5):15-30. [Yang S,Yang X C, He F,Li L H, Li Z H, Ren M J,Xu R H. 2020. Exploration and app-lication of EST-SSR markers in Guizimai No.1 transcriptome[J]. Journal of Henan Agricultural Sciences,49(5):15-30.]
姚婧. 2015. 火焰兰种质资源鉴定评价及组织培养技术的研究[D]. 海口:海南大学. [Yao J. 2015. Identification and evaluation of germplasm resources and study on in vitro culture technique of Renanthera spp.[D]. Haikou:Hai-nan University.]
叶鹏,李显煌,陈杰,瞿绍宏,董章宏,雷瀚,刘成,辛培尧,杨生超. 2019a. 金铁锁转录组SSR的分布及其序列特征[J]. 云南农业大学学报(自然科学),34(5):808-814. [Ye P,Li X H,Chen J,Qu S H,Dong Z H,Lei H,Liu C,Xin P Y,Yang S C. 2019a. The distribution and characte-ristics of SSR in transcriptome of Psammosilene tunicoides[J]. Journal of Yunnan Agricultural University(Natural Science),34(5):808-814.]
葉鹏,李显煌,唐军荣,李斌,张贵良,刘成,雷瀚,辛培尧. 2019b. 云南金花茶转录组SSR的分布及其序列特征[J]. 中南林业科技大学学报,39(9):86-91. [Ye P,Li X H,Tang J R,Li B,Zhang G L,Liu C,Lei H,Xin P Y. 2019b. Distribution and characteristics of SSR in transcriptome of Camellia fascicularis[J]. Journal of Central South University of Forestry & Technology,39(9):86-91.]
张金旺,李代丽,尚峰男,阿茹娜,铁龙,王君,姜鹏. 2018. 15个北方杨树栽培品种倍性检测与SSR遗传分析[J]. 西南林业大学学报(自然科学版),38(5):27-33. [Zhang J W,Li D L,Shang F N,A R N,Tie L,Wang J,Jiang P. 2018. Ploidy detection and genetic analysis of SSR mar-kers of 15 Populus cultivars in North China[J]. Journal of Southwest Forestry University(Natural Science),38(5):27-33.]
张亚楠,杨柏云,熊冬金,罗火林. 2017. 寒兰转录组SSR信息分析及其分子标记开发[J]. 南昌大学学报(理科版),41(3):249-254. [Zhang Y N,Yang B Y,Xiong D J,Luo H L. 2017. Analysis on SSR information based on transcriptome and development of molecular markers in Cymbi-diun kanran[J]. Journal of Nanchang University(Natural Science),41(3):249-254.]
张震,许彦明,陈永忠,李志钢,王湘南,陈隆升,彭邵锋,马力,王瑞,李美群,唐炜,彭映赫. 2018. 油茶转录组测序与SSR特征分析[J]. 西南林业大学学报(自然科学),38(6):63-68. [Zhang Z,Xu Y M,Chen Y Z,Li Z G,Wang X N,Chen L S,Peng S F,Ma L,Wang R,Li M Q,Tang W,Peng Y H. 2018. Transcriptome sequencing and analysis of SSR characteristics of Camellia oleifera[J]. Journal of Southwest Forestry University(Natural Science),38(6):63-68.]
赵能,原晓龙,缪福俊,王毅,陈伟,李江,吴涛,王娟. 2017. 思茅松转录组SSR分析及标记开发[J]. 生物技术通报,33(5):71-77. [Zhao N,Yuan X L,Miao F J,Wang Y,Chen W,Li J,Wu T,Wang J. 2017. Development of SSR molecular markers based on transcriptome data of Pinus kesiya var. langbianensis[J]. Biotechnology Bulletin,33(5):71-77.]
中国科学院昆明植物研究所. 2003. 云南植物志(第14卷)[M]. 北京:科学出版社. [Kunming Institute of Botany,Chinese Academy of Sciences. 2003. Flora of Yunnan(Vol.14)[M]. Beijing: Science Press.]
周天华,丁家玺,田伟,王家. 2017. 天麻基因组微卫星特征分析与分子标记开发[J]. 西北植物学報,37(9):1728-1735. [Zhou T H,Ding J X,Tian W,Wang J. 2017. Genomic microsstellite characteristic analysis and molecular marker development for Gastrodia elata BI.[J]. Acta Botanica Boreali-Occidentalia Sinica,37(9):1728-1735.]
Dreisigacker S,Zhang P,Warburton M L,Ginkel M V,Hoi-sington D,Bohn M,Melchinger A E. 2004. SSR and pedi-gree analyses of genetic diversity among CIMMYT wheat lines targeted to different megaenvironments[J]. Crop Science,44(2):381-388.
Gao L F,Tang J F,Li H W,Jia J Z. 2003. Analysis of microsatellites in major crops assessed by computational and experimental approaches[J]. Molecular Breeding,12(3):245-261.
Temnykh S,Declerck G,Lukashova A,Lipovich L,Cartinhour S,McCouch S. 2001. Computational and experimental analysis of microsatellites in rice(Oryza sativa L.):frequency,length variation,transposon associations,and genetic marker potential[J]. Genome Research,11(8):1441-1452.
(责任编辑 陈 燕)

