吡非尼酮可抑制肺泡巨噬细胞中细胞因子/趋化因子释放
龙小平,唐艳华,李建民,王卫忠,欧大明,许丽慧,何菁子,谢立虎
1南华大学附属第一医院呼吸与危重症医学科,湖南衡阳421001 2湖南省人民医院呼吸重症医学科,长沙410005 3南华大学附属第一医院风湿免疫科,湖南衡阳421001
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)和特发性非特异性间质性肺炎(idiopathic nonspecific interstitial pneumonia,iNSIP)都属于原因不明的间质性肺炎。吡非尼酮是兼具抗纤维化、抗炎和抗氧化作用的药物[1- 5],研究显示其治疗IPF的效果令人鼓舞[6-7],但在iNSIP中的研究甚少。本研究评估并比较了吡非尼酮对iNSIP和IPF患者肺泡巨噬细胞(alveolar macrophages,AMs)产生的炎症细胞因子/趋化因子的影响。
对象和方法
对象2015年1月至2018年12月在南华大学附属第一医院确诊的10例iNSIP患者和11例IPF患者,所有患者基本临床症状、肺部高分辨率CT(high-resolution computed tomography,HRCT)和/或组织病理学表现均符合2015年美国胸科学会(American Thoracic Society,ATS)/欧洲呼吸学会(European Respiratory Society,ERS)诊断标准[8]。选择同期具有正常肺泡灌洗液(bronchoalveolar lavage fluid,BALF)细胞分类且没有任何间质性肺疾病(non-interstitial lung disease,non-ILD)的8例患者作为对照。本研究经南华大学附属第一医院伦理委员会批准,所有研究对象均已签署知情同意书。
肺功能检测测量指标包括:用力肺活量(forced vital capacity,FVC)、1秒钟用力呼气量(forced expiratory volume in one second,FEV1)、肺总能力(total lung capacity,TLC)、肺部一氧化碳扩散能力(diffusing capacity of the lung for carbon monoxide,DLco)、动脉血氧分压(partial pressure of oxygen in arterial blood,PaO2),以及与血液样品采集一起进行肺泡-动脉氧梯度(alveolar arterial oxygen gradient,AaDO2)。数值表示为预测值占正常值的百分比。
BALF细胞采集将总体积为200 ml的生理盐水均等分成10份,每份20 ml,依次灌注到右肺中叶,随后立即抽吸回收BALF。将回收的BALF通过两层无菌纱布过滤放置于聚乙烯试管中,于4℃下以500×g离心10 min,倒去上清液,将细胞沉淀用磷酸盐缓冲盐水溶液洗涤3次。常规测定细胞总数、细胞分类和淋巴细胞亚型。细胞存活率采用胎盘蓝染色测定。
AMs培养BALF细胞洗涤3次后,加用10%RPMI 1640溶液(10%灭活的小牛血清、2 mmol/L L-谷氨酰胺、200 U/ml青霉素和200 mcg/ml链霉素)(Seromed;Biochrom KG;Berlin,Germany),将细胞沉淀混匀成为1.0×106/ml密度的细胞悬浮液,随后分加至24孔塑料组织培养平板中(Falcon,Becton Dickinson,Franklin Lakes,NJ,USA),放置于含5%CO2的增湿培养箱中37.0℃温育1 h,使巨噬细胞充分附壁。再采用2%RPMI 1640溶液洗涤3次去除没有附壁的细胞,在黏附有AMs的每个培养孔里加1 ml 10% RPMI 1640溶液,放置于含5%CO2的增湿培养箱中37℃温育24 h,其中,1组添加100 ng脂多糖(lipopolysaccharides,LPS)(Sigma-Aldrich,St Louis,MO,USA);在不含和含100 ng/ml LPS的两种条件下,分别给予浓度为0.03、 0.10和0.30 mg/ml吡非尼酮(Shionogi &Co.,Ltd.,Osaka,Japan)处理(预实验中,AMs培养24 h后,使用胎盘蓝染色测定AMs细胞活性,不同浓度的吡非尼酮对AMs细胞活性均无影响)。温育结束时,吸取培养上清液保存至小试管中,离心去除底层细胞,保留细胞培养上清液,-80℃冰箱储存备用。
细胞因子/趋化因子的测定采用基于荧光珠的多重技术Luminex(Bio-Rad BioPlex200;Bio-Rad Laboratories,Munich,Germany)测定培养的上清液中肿瘤坏死因子(tumor necrosis factor,TNF)-α、可溶性TNF受体(soluble TNF receptor,TNFR)- 1、sTNFR- 2、白细胞介素(interleukin,IL)- 1β、IL- 8、IL- 10、单核-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)、IL- 18、巨噬细胞炎性蛋白(macrophage inflammatory protein,MIP)- 1β、干扰素诱导单核因子(interferon-gama inducible monokines,MIG)/趋化因子(C-X-C motif ligand 9,CXCL)- 9和干扰素诱导蛋白- 10(interferon-gama inducible protein 10,IP- 10)/CXCL10。
统计学处理采用SPSS 22.0统计软件,符合正态分布的计量资料以均数±标准差表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
一般情况所有患者在接受BALF时均未接受皮质类固醇、免疫抑制和/或抗纤维化治疗。2例iNSIP患者(20%)和3例IPF患者(27%)接受经纤维支气管镜冷冻肺活检。iNSIP、IPF和对照组在年龄(F=0.687,P=0.568)、性别(F=0.642,P=0.452)和吸烟状况(F=0.587,P=0.872)方面差异均无统计学意义。iNSIP和IPF组患者的FVC%(P=0.017和P=0.005)、TLC%(P=0.001和P=0.002)和DLco%(P<0.001和P<0.001)均显著低于对照组;BALF中巨噬细胞(P=0.003和P=0.004)显著低于对照组,淋巴细胞(P=0.014和P=0.025)、中性粒细胞(P=0.035和P=0.046)及嗜酸性粒细胞(P=0.001和P=0.032)均显著高于对照组。iNSIP组患者的巨噬细胞明显低于IPF组(P=0.015),淋巴细胞明显高于IPF组(P=0.042)(表1)。
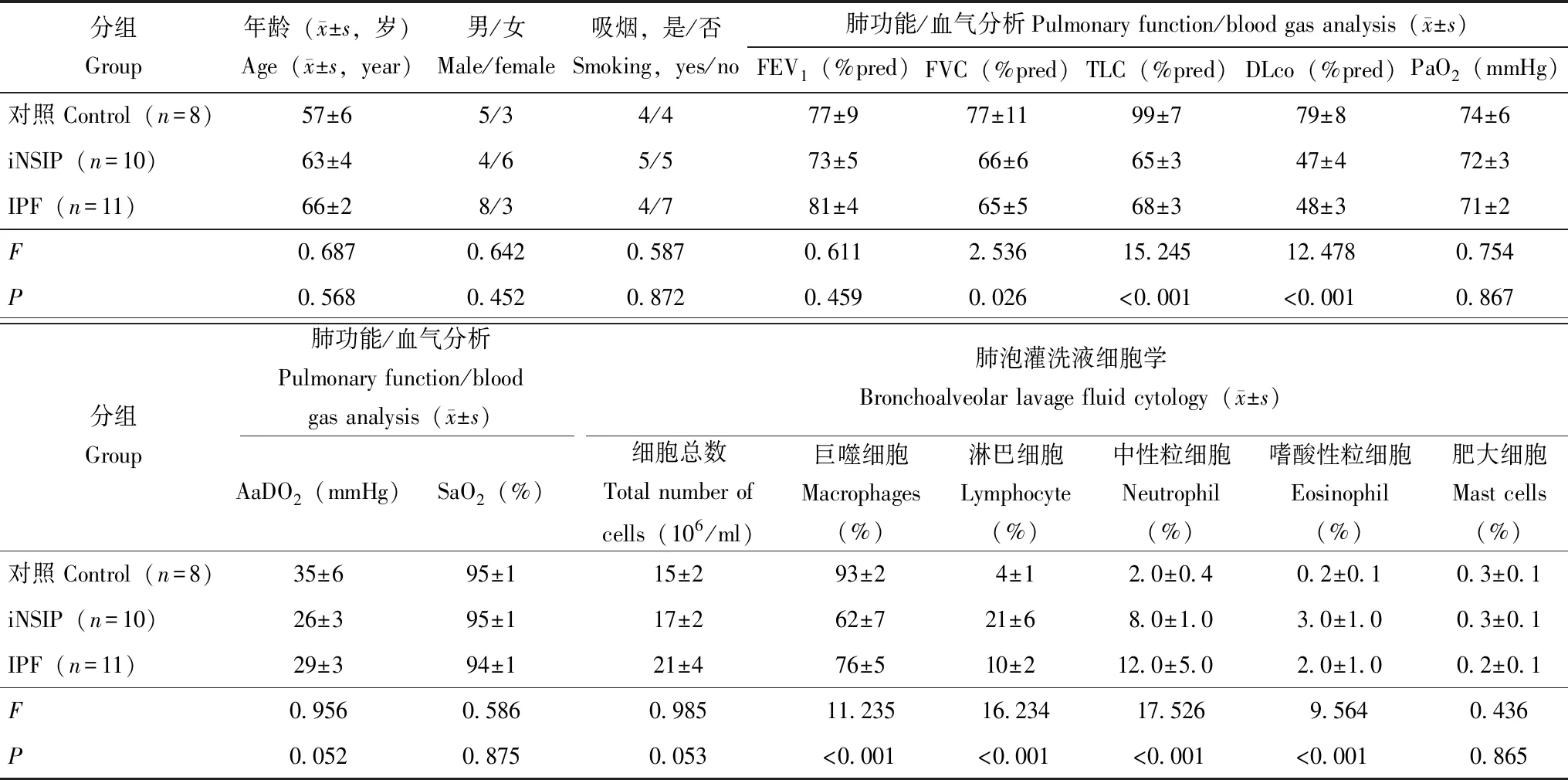
表1 3组患者基本情况比较
基础状态AMs释放细胞因子/趋化因子iNSIP和IPF组患者AMs产生的TNF-α(P<0.001和P<0.001)、sTNFR- 1(P=0.022和P=0.015)、sTNFR- 2(P=0.005和P=0.009)、IL- 1β(P=0.042和P=0.047)、IL- 10(P=0.024和P=0.035)、GM-CSF(P=0.035和P=0.042)、MIP- 1β(P=0.036和P=0.042)、MIG(P<0.001和P=0.024)和IP- 10浓度(P<0.001和P=0.018)均显著高于对照组,iNSIP组患者AMs产生的MIG(P=0.004)和IP- 10浓度(P<0.001)显著高于IPF组,3组患者AMs产生的IL- 18浓度差异无统计学意义(F=0.562,P=0.756)(表2)。
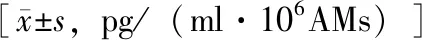
表2 基础状态iNSIP、IPF和对照组患者BALF中AMs释放的细胞因子/趋化因子比较
LPS刺激AMs释放细胞因子/趋化因子加用LPS刺激后,iNSIP和IPF组患者AMs产生的TNF-α(P<0.001和P=0.008)、sTNFR- 1(P=0.007和P=0.006)、sTNFR- 2(P<0.001和P<0.001)、IL- 1β(P<0.001和P<0.001)、IL- 10(P=0.043和P=0.035)、GM-CSF(P<0.001和P<0.001)、MIP- 1β(P<0.001和P<0.001)、MIG(P<0.001和P=0.025)和IP- 10浓度(P<0.001和P=0.004)均显著高于对照组,IL- 18(P=0.035和P=0.041)均显著低于对照组;iNSIP组患者AMs产生的MIG(P<0.001)和IP- 10浓度(P<0.001)显著高于IPF组,LPS不能促进MIG的释放(表3)。
吡非尼酮对AMs细胞因子/趋化因子释放的影响在有和没有LPS刺激的情况下,吡非尼酮可剂量依赖性降低iNSIP组和IPF组患者AMs释放的TNF-α、sTNFR- 1、sTNFR- 2、IL- 1β、IL- 10、GM-CSF、IL- 18、MIP- 1β、MIG和IP- 10表达水平,两组间差异无统计学意义(P均>0.05)(表4、5)。
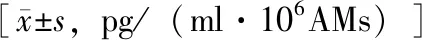
表3 LPS刺激下iNSIP、IPF和对照组患者BALF中AMs释放的细胞因子/趋化因子比较
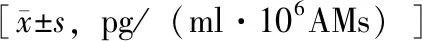
表4 吡非尼酮抑制iNSIP和IPF患者BALF中AMs自发释放的细胞因子/趋化因子效果比较
表5 吡非尼酮抑制iNSIP和IPF患者BALF中AMs在LPS刺激下释放的细胞因子/趋化因子效果比较
讨 论
本研究结果显示,iNSIP和IPF患者BALF中的AMs在体外实验中能产生Th1型细胞因子、Th2型细胞因子、促血管形成趋化因子和抗血管形成趋化因子,均显著高于对照组(IL- 18除外),与以往关于iNSIP和IPF患者研究报道结果类似[9],意味着AMs在编排间质性肺炎(interstitial lung diseases,ILDs)细胞因子/趋化因子网络中起关键作用[10-11]。吡非尼酮能有效抑制上述细胞因子/趋化因子的释放,这种抑制作用在LPS刺激后更为突出,可能与调节caveolin- 1蛋白表达及NLRP3炎性小体激活相关[12-13]。
以往研究表明,iNSIP和IPF中的AMs自发释放高水平的TNF-α、sTNFR- 1、sTNFR- 2、IL- 1β、IL- 10、GM-CSF、MIP- 1β、MIG和IP- 10,而吡非尼酮在0.30 mg/ml时能有效抑制上述细胞因子/趋化因子释放,这些细胞因子/趋化因子在肺部炎症和纤维化病变中扮演着非常重要的角色[11,14],与本研究结果一致。与TNF-α相比,IL- 1是中性粒细胞积聚和细胞因子产生的更强启动子[15],IL- 1β可以模拟博来霉素的作用并诱导小鼠肺纤维化[13,16]。本研究结果显示,吡非尼酮可以显著抑制iNSIP和IPF患者BALF中AMs的IL- 1β释放。TNFR通过蛋白水解切割产生sTNFR,并且它们被认为是TNF-α抑制剂,其可以通过竞争性结合中和TNF-α诱导的细胞毒性和免疫活性[17]。目前已在多种肺部疾病的BALF中观察到sTNFR- 1和sTNFR- 2上调,AMs可能是sTNFR- 2的主要来源,但AMs可能不是肺泡腔中sTNFR- 1的主要来源[9]。在单核细胞/巨噬细胞中,每种可溶性受体的释放通过不同的机制调节,并且sTNFR- 2似乎更容易在LPS、IFN-γ、IL- 1和TNF-α等炎性刺激下大量释放[12],这可以解释本研究中iNSIP、IPF和对照组患者AMs在LPS刺激下细胞培养上清液中检测到sTNFR- 2显著高于sTNFR- 1的原因。
Th- 1和Th- 2细胞因子网络之间存在不平衡,过量的Th- 2细胞因子与肺纤维化的发展有关。IL- 10是Th- 2家族的T细胞衍生细胞因子,具有抗纤维化和促纤维化活性的两面性[12],可能不同的实验条件是最终结果的重要决定因素。在本研究中,与对照组相比,iNSIP和IPF患者BALF中IL- 10和GM-CSF显著增加,吡非尼酮亦能有效抑制AMs中二者的释放。
已知IL- 18、MIP- 1β和MIG、IP- 10(CXCL10)等CXC趋化因子在免疫应答中起着不同的作用:IL- 18、MIP- 1β是有效吸引和激活神经营养因子的血管生成因子,而MIG、IP- 10是血管生成趋化因子,对Th1淋巴细胞和单核细胞上的CXC趋化因子受体3具有亲和力,可被IFN-γ和TNF-α诱导[12,18]。IL- 18、MIP- 1β和MIG、IP- 10的不平衡表达参与各种间质性肺病的发病机制,包括IPF和结节病[18]。在本研究中,iNSIP和IPF组患者AMs释放较高水平的MIP- 1β和MIG、IP- 10(IL- 18除外),而吡非尼酮能显著抑制IL- 18、MIP- 1β和MIG、IP- 10释放。通过抑制血管生成趋化因子IL- 18和MIP- 1β,吡非尼酮或许可以限制或逆转IPF和iNSIP中的新血管形成,为治疗肺纤维化提供更多的理论依据。
综上,本研究结果显示,iNSIP和IPF组患者BLAF的AMs在体外可产生丰富的促炎、促纤维化因子,而吡非尼酮能显著抑制这些细胞因子/趋化因子的释放,且这种抑制作用在iNSIP和IPF组患者间无显著差异。

