派特灵治疗宫颈持续HR-HPV感染疗效分析
李亚光 张炜悦 王伟杰 魏靖文 刘恩令
华北理工大学附属唐山工人医院妇产科 河北唐山 063000
有性生活女性中人乳头瘤病毒(HPV)感染率高达70%以上,多数可在6~24个月内自行清除,但仍有10%~30%发生持续感染[1],进而发展为宫颈上皮内病变甚至宫颈癌。90%的宫颈鳞状上皮内病变和99%的宫颈癌与高危型HPV (HR-HPV)感染有关,其中70%与HPV16及18型有关[2]。免疫细胞及其产生的免疫因子为非特异性免疫的重要组成部分,是对抗HPV的第一道防御屏障。诸多免疫细胞因子不仅参与HPV病毒的清除,还与肿瘤的发生发展密切相关,如白细胞介素-2(IL-2)、白细胞介素-4(IL-4)、肿瘤坏死因子-α(TNF-α)、γ-干扰素(IFN-γ)等[3-5]。有研究发现HPV的一些特性使其发生免疫逃逸现象,逃脱免疫系统的监视。IL-2、IFN-γ、TNF-α为激活或介导免疫反应的细胞因子,在杀伤病原微生物及肿瘤细胞方面起主要作用,而IL-4为抑制免疫反应的相关因子,可以防止免疫反应过强而造成的自身损害。中成药因其在抗病毒方面独特的成效,越来越多的应用到抗HPV治疗中。本研究将评价中药派特灵治疗宫颈持续HR-HPV感染的疗效,并针对宫颈局部免疫细胞因子变化情况进行研究分析。
1 资料与方法
1.1一般资料 以2018年11月~2019年9月唐山工人医院妇科门诊采用cobas4800HPV分型检测方法确定HR-HPV阳性者80例为研究对象, HR-HPV持续感染(≥6个月)。纳入标准 :①间隔6个月连续两次检测HR-HPV阳性者;②TCT≤ASCUS,阴道镜下组织病理学检查正常或慢性炎症者;③有性生活史;④无重要脏器基础疾病及肿瘤病患者;⑤两周内未进行妇科检查及阴道用药、阴道冲洗者;⑥近期无口服抗病毒药物及未接种HPV疫苗;⑦传染病学检查阴性。 排除标准:①免疫功能低下者;②近半年内接受局部或全身免疫增强剂治疗者;③急性生殖道炎症;④妊娠期及哺乳期者;⑤长期使用免疫抑制剂者;⑥患有严重心、肺、肝、肾功能病损者;⑦近2个月内接受局部或全身抗病毒治疗者;⑧不使用安全套防护者;⑼不接受全程治疗及随访者。将80例患者随机分为派特灵组和干扰素栓剂组,各40例。派特灵组年龄25~45岁,平均(35.2±2.8)岁;干扰素组年龄26~49岁,平均(36.4±3.2)岁,两组年龄比较差异无统计学差异(P>0.05)。
1.2治疗方法 派特灵组予派特灵治疗,棉球浸润派特灵稀释液预处理宫颈及阴道壁,带有尾丝的棉球浸满派特灵原液后顶端部分置入宫颈管内约2cm,剩余部分均匀敷在宫颈表面,3小时后自行取出,1次/d,连用3天后停用4天,共用药5周,经期停用。干扰素组予重组人干扰素α2b,患者睡前清洗外阴,将1粒金舒喜栓(重组人干扰素α2b阴道栓剂,北京Kawin公司)置入阴道内,隔日1次,经期停用,共用3个月经周期。所有患者用药期间禁止性生活。
1.3标本收集及实验方法 患者取膀胱截石位,用宫颈刷收集脱落细胞用于高危HPV分型检测(16/18和其他12种)和液基细胞学检测。5mL生理盐水反复冲洗宫颈及阴道上1/3,停留10秒后于后穹窿处吸出(灌洗液中不含血液成分),2000r/min室温离心5分钟后取上清保存于-80℃用于免疫细胞因子检测。ELISA酶联免疫吸附法检测样本中IL-2、IL-4、IFN-γ和TFN-α,以空白孔调零,在450nm波长下测量各孔OD值,以标准品浓度及OD值绘制标准曲线,计算各待测样本孔中免疫因子的浓度。
2 结果
2.1两组患者HR-HPV转阴情况比较 派特灵组和干扰素栓剂组HR-HPV转阴率分别为87.50%、35.00%,两组间比较有统计学差异(χ2=25.208,P=0.00)。见表1。

表1 两组治疗后转阴率比较[例(%)]
2.2宫颈局部免疫因子表达情况 两组患者治疗前阴道灌洗液中IFN-γ、TNF-α、IL-2、IL-4浓度比较差异无统计学意义(P>0.05);治疗后,两组患者上述细胞因子浓度比较差异有统计学意义(P<0.05);两组患者治疗前后相比,上述细胞因子浓度比较差异有统计学意义(P<0.05)。见表2。

表2 两组患者治疗前后阴道灌洗液中IFN-γ、TNF-α、IL-2、IL-4表达水平比较
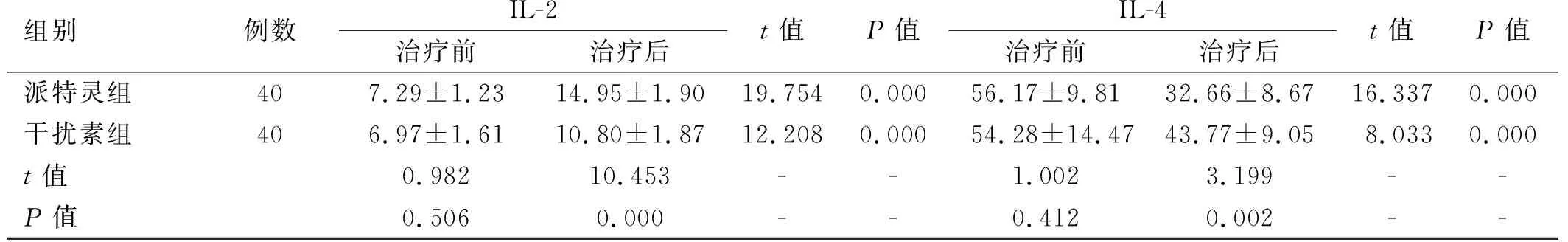
组别例数IL-2治疗前治疗后t值P值IL-4治疗前治疗后t值P值派特灵组407.29±1.2314.95±1.9019.7540.00056.17±9.8132.66±8.6716.3370.000干扰素组406.97±1.6110.80±1.8712.2080.00054.28±14.4743.77±9.058.0330.000t值0.98210.453--1.0023.199--P值0.5060.000--0.4120.002--
各组患者治疗后转阴与否之间比较,上述细胞因子浓度差异有统计学意义(P<0.05);两组转阴患者之间比较TNF-α、IL-2、IL-4浓度差异有统计学意义(P<0.05),IFN-γ浓度差异无统计学意义(P>0.05);两组未转阴患者之间比较,上述四种免疫细胞因子浓度差异无统计学意义(P>0.05)。见表3。

表3 转阴与未转阴患者阴道灌洗液中IFN-γ、TNF-α、IL-2、IL-4表达水平比较

组别IL-2例数转阴例数未转阴t值P值IL-4例数转阴例数未转阴t值P值派特灵组3515.77±1.9558.62±1.777.6640.0003530.07±9.12553.32±9.6710.3960.000干扰素组1412.96±1.74267.38±1.881.7350.0331433.45±10.662654.85±12.394.1790.018t值3.125-1.34--2.896-0.274--P值0.004-0.19--0.007-0.786--
3 讨论
HPV是一种直径约55nm的双链DNA病毒,其传播方式主要与性生活有关,通过肛周及外阴微小皮肤黏膜破损侵入基底层上皮细胞后[6],启动人体宫颈局部免疫反应:包括细胞免疫和体液免疫,其中细胞免疫起主要作用。大多数的HPV感染仅为一过性,病毒颗粒可随脱落的细胞碎屑排出体外,称为一过性感染,病毒清除时间为8~14个月,仅5%~10%可发生持续性感染,这与机体免疫功能受损、免疫抑制以及病毒本身特性相关,病毒DNA整合到宿主细胞的基因中,形成持续感染[7]。HPV病毒长期感染和存在依赖于基底细胞的不断分化,HPV病毒感染机体后难以被抗原提呈细胞识别,在复制时保持低拷贝复制量,衣壳蛋白表达量少、干扰宿主细胞因子表达等多种特点使HPV病毒可以逃脱免疫监视,发生免疫逃逸现象。如前所述,由于HPV病毒局限于皮肤及黏膜,很少进入血液,所以局部细胞免疫为清除病毒的主力。初始CD4+T细胞(Th0)可在不同细胞因子诱导下分别向Th1及Th2细胞分化。Th1细胞主要起免疫活性作用,可诱导一系列免疫反应,IL-2及IFN-γ为Th1细胞相关因子,主要介导细胞免疫。IL-2可促进T细胞增殖并维持T细胞体外长期生长,增强抗病毒能力;IFN-γ具有抗病毒活性,可阻断病毒mRNA表达[8]。Th2细胞因子作用主要为抑制免疫反应[9], IL-4为Th2细胞因子,可抑制Th0细胞向Th1细胞方向转化[10]。TNF-α主要由NK细胞、巨噬细胞表达,也可少量由Th1细胞表达,可降低E6、E7蛋白产生,减少病毒复制[11]。HR-HPV持续感染过程中,Th1/Th2细胞功能平衡发生异常并向Th2细胞方向偏移,使得机体清除病毒的能力减弱[12]。本研究IL-2、IFN-γ作为Th1细胞相关因子, IL-4细胞作为Th2细胞相关因子,TNF-α作为巨噬细胞相关因子,可以发现治疗前与治疗后相比,IL-2及IFN-γ均有显著的升高,而IL-4则有显著下降,说明治疗后与治疗前相比,Th1/Th2平衡向Th1方向恢复,TNF-α有所上升,说明机体抗病毒能力增强。派特灵组与干扰素栓剂组相比,四种免疫细胞因子在治疗后总体上差异均具有统计学意义,在治疗后转阴者中,除IFN-γ外其余三种因子的变化差异两组间仍有显著的统计学差异。考虑本实验纳入研究例数偏少,标本收集及实验中难免有误差导致实验结果存在一定偏差。
派特灵是由中国科学院于1993年研制的一种专门针对HPV感染的纯中药制剂,包含白花蛇舌草、大青叶、苦参、金银花、鸦胆子、蛇床子等二十余种中药。大青叶可干扰HPV DNA复制,从而抑制病毒繁殖;苦参、金银花具有清热解毒功效,可发挥较强抗病毒作用;鸦胆子内含多种生物碱、有机酸、苦味素成分,对癌细胞具有亲和性,可选择性破坏癌细胞膜和线粒体,干扰细胞代谢,从而破坏癌细胞;蛇床子具有剥脱角质细胞的作用,使上皮细胞中的病毒颗粒在完成繁殖释放之前随宿主细胞一起剥脱,从而达到清除病毒的效应。与其他学者关于派特灵用于治疗持续HR-HPV感染的研究相比,本研究转阴率大致相似[13]。
本研究通过对派特灵与干扰素栓剂用药前后HR-HPV感染转阴率及宫颈局部免疫细胞因子变化情况的分析发现,派特灵治疗宫颈持续HR-HPV感染相较于干扰素栓剂在转阴率及免疫学变化方面均具有一定的优势。

