ASF1B对子宫内膜癌细胞恶性行为的影响及相关机制
白驹 斗泽加
据2018年数据显示,全球子宫内膜癌新发病例约38.2 万,死亡9.0 万[1],是女性高发的恶性肿瘤之一。肿瘤细胞的恶性表型是决定肿瘤进展及转归的关键因素,明确子宫内膜癌细胞的恶性行为的分子机制对于子宫内膜癌的临床诊治具有重要意义[2]。ASF1 类蛋白作为组蛋白的伴侣蛋白,在调节染色质核小体结构中发挥促进组蛋白沉积和组蛋白交换的关键作用[3],是重要的表观调控因子。有研究指出,抗沉默功能1B(Anti-Silencing Function 1B,ASF1B)蛋白参与乳腺癌、前列腺癌及肾透明细胞癌等恶性肿瘤的发生发展[4-6],但其在子宫内膜癌中的生物学功能及作用机制仍不明确。本研究通过生物信息技术及分子生物学方法,分析了ASF1B 与子宫内膜癌细胞恶性表型的关系及相关机制。
1 材料与方法
1.1 一般资料
收集2019年01月至2019年12月本院68 例子宫内膜癌手术患者,根据临床和病理标准取肿瘤组织及癌旁组织,手术患者一般信息(年龄、BMI 及分型):平均年龄(52.73±6.48)岁;BMI 指数(25.08±5.15);雌激素依赖型38 例,非雌激素依赖型30 例。本方案通过了本院伦理委员会,患者或家属均已签署知情同意书。
1.2 材料与试剂
HEC-151、KLE 人子宫内膜癌细胞系及人胚胎肾细胞293T(美国ATCC)。CCK-8 试剂盒:Hyclone(美国)。转染脂质体LipofectamineRNAiMAX Reagent:Thermo Scientific(美国)。ASF1B过表达载体及空白载体、siFOXM1、siASF1B 及siRNA 对照载体:吉凯基因(上海)。RNA 提取试剂RNAiso Reagent、RNA 逆转录试剂盒及SYBR Green 核酸荧光染料:Takara(日本)。一抗FOXM1(ab207298,100 μL)、CDK6(ab124821,100 μL)及VEGFB(ab51867,100 μL):Abcam(美国)等。多孔酶标仪(Molecular Devices,型号:SpectraMax Paradigm)、凝胶成像仪(Bio-Rad,型号:GelDocEZ)、Real-time PCR 仪(Bio-Rad,型号:CFX96)。
1.3 子宫内膜癌细胞的培养及传代
培养子宫内膜癌HEC-151 细胞在25 cm2培养瓶中,采用DMEM/F12 培养基+10%FBS+1%青霉素-链霉素溶液培养,于37℃+5% CO2培养箱中培养。传代时使用胰蛋白酶消化,1∶3 传代并继续培养,选取对数生长期的细胞用作后续实验。
1.4 实验设计分组
HEC-151 细胞分为:对照组、过表达组及回复组。对照组转染空白对照载体+siRNA 对照载体;过表达组转染ASF1B 过表达载体+siRNA 对照载体,回复组共转染ASF1B+siFOXM1。KLE 细胞分为:无意义组及干扰组,无意义组转染siRNA对照载体,干扰组转染siRNA 靶向ASF1B 载体。
1.5 Transwell 检测各组细胞侵袭迁移能力
取Matrigel 胶铺于Transwell 上室面,DMEM/F12 无血清培养基水化。铺Matrigel 胶的Transwell小室作为侵袭模型,未铺胶的作为迁移模型。100 μL 的各组细胞悬液接种于上室面。24 h 后棉签轻轻擦掉上室面的细胞,4%多聚甲醛固定15 min,0.1%结晶紫染色,进行细胞计数并进行统计学分析。
1.6 CCK-8 检测各组细胞增殖能力
各组细胞均以每孔2 000 个接种至96 孔板中,用DMEM/F12 培养基+10%FBS+1%青霉素-链霉素溶液培养,在培养0、24、48、72 及96 h 时,每孔加入10 μL CCK-8,孵育2 h,酶标仪检测450 nm处吸光度(OD)。各时间点与0 h 吸光度的比值表示细胞的相对增殖能力。24 h 计算公式:[(OD24h-OD24h空白)/(OD0h-OD0h空白)]×100%,48、72和96 h 计算方法同24 h。
1.7 Western Blot 检测各组细胞中FOXM1、CDK6及VEGFB 蛋白的表达水平
RIPA 裂解液与蛋白酶抑制剂混合后冰上裂解各组细胞,加上样缓冲液煮沸10 min。选用β-actin 作为内参。BCA 试剂盒测定蛋白浓度,同时选取20 μL 的目的蛋白先进行β-actin 抗体的电泳(一抗浓度1∶400),比较各组之间的灰度值,调整后进行FOXM1、CDK6 及VEGFB 的电泳。200 mA 90 min 湿转至PVDF 膜,TBSTw 封闭液封闭1 h,一抗4℃过夜,二抗37℃1 h,发光液曝光显影。
1.8 qPCR 检测各组组织或细胞中ASF1B、FOXM1、CDK6 及VEGFB 的表达含量
使用TRIzol 提取各组细胞或组织中的Total-RNA,提取完成后检测RNA 纯度后。参考逆转录试剂盒说明书(Roche),将提取后的RNA 进行逆转录,得到cDNA 产物。根据SYBR GREEN 试剂盒说明(Roche),进行PCR 反应,β-actin 作为内参,并进行定量分析,目的基因的引物如表1所示。
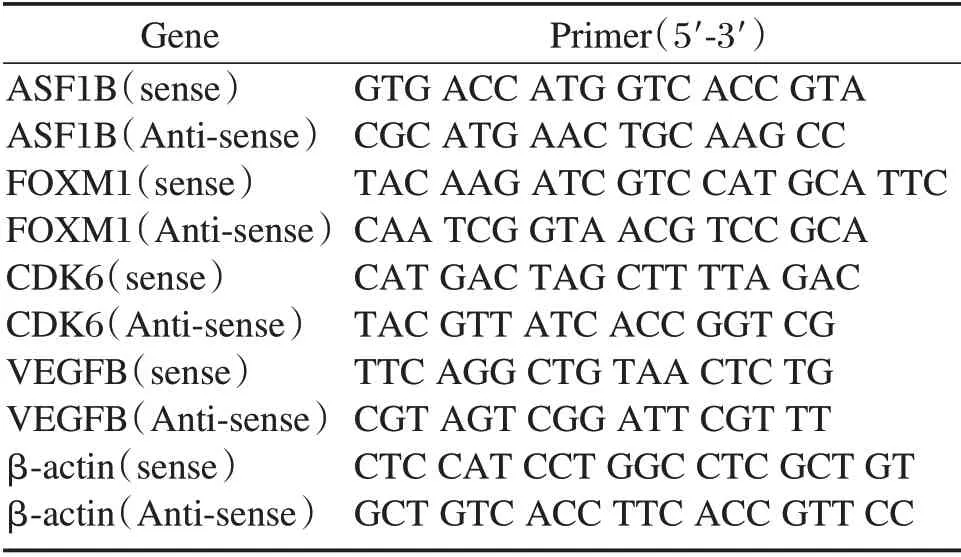
表1 β-actin、ASF1B、FOXM1、CDK6 及VEGFB 引物序列Table 1 Primer sequences of β-actin,ASF1B,FOXM1,CDK6 and VEGFB
1.9 统计学方法
采用SPSS 23.0 软件进行统计学分析;计量资料采用(±s)表示,两组间比较采用单因素方差分析及Student-Newman-Keuls(SNK);计数资料比较采用卡方检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 生物信息学分析ASF1B 在子宫内膜癌中的表达情况及与患者病理资料的关系
利用UALCAN 数据库发现,ASF1B 基因在子宫内膜癌中表达显著增高(图1A、B),且ASF1B 表达随着患者TNM 分期增高而增加(图1C),高表达ASF1B 与患者浆液性宫颈癌亚型及TP53 突变密切相关(图1D、E)。
2.2 生物信息学分析ASF1B 与FOXM1 及子宫内膜癌患者预后的关系
ASF1B 的表达与TP53 下游分子FOXM1 的表达正相关(图2A、B),预后分析发现ASF1B 的高表达不利于患者预后(图2C)。
2.3 ASF1B 在68 例子宫内膜癌患者的肿瘤组织及癌旁组织中的比较及其与患者临床资料的关系
ASF1B 高表达与肿瘤分期及淋巴结转移的发生显著正相关(P<0.05),而与病理类型及分化程度无显著相关(P>0.05)。ASF1B 在子宫内膜癌组织中呈高表达趋势,与其在癌旁正常组织的表达水平相比,差异有统计学意义(P<0.01),见表2,图3。
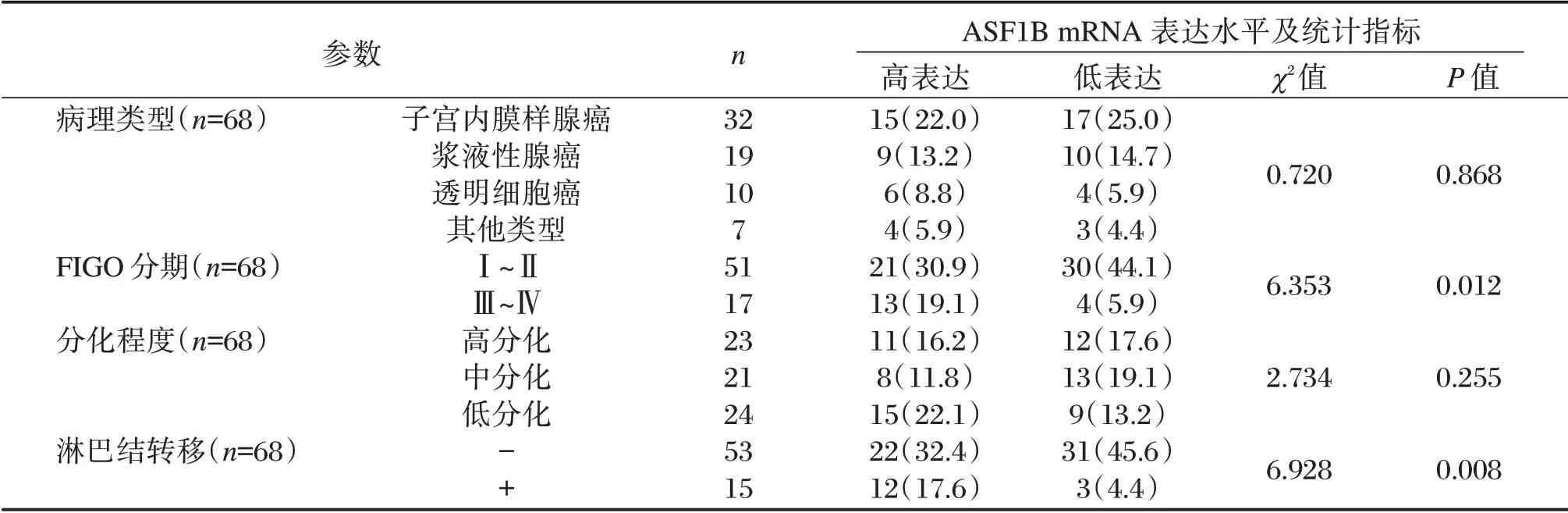
表2 ASF1B mRNA 表达与患者临床资料的关系[n(%)]Table 2 The relationship between asf1b mRNA expression and clinical data of patients[n(%)]
2.4 各组细胞侵袭迁移能力及其比较
相比对照组,过表达组细胞体外转移能力显著增强;而相比过表达组,回复组细胞体外转移能力显著减弱;相比无意义组,干扰组细胞体外转移能力显著减弱。差异有统计学意义(P<0.05),见图4。
2.5 各组细胞增殖能力及其比较
相比对照组,过表达组细胞体外增殖能力在48~96 h 显著增强;而相比过表达组,回复组细胞体外增殖能力在48~96 h 显著减弱;相比无意义组,干扰组细胞体外增殖能力在48~96 h 显著减弱。差异有统计学意义(P<0.05),见图5。
2.6 各组细胞ASF1B、FOXM1、CDK6 及VEGFB的表达及其比较
过表达组细胞ASF1B、FOXM1、CDK6 及VEGFB 的蛋白表达均显著高于对照组;而回复组细胞FOXM1、CDK6 及VEGFB 的蛋白表达均显著低于过表达组;干扰组细胞FOXM1、CDK6 及VEGFB 的蛋白表达均显著低于无意义组。差异有统计学意义(P<0.05),见图6。
2.7 各组细胞FOXM1、CDK6 及VEGFB 的基因表达含量
过表达组细胞FOXM1、CDK6 及VEGFB 的mRNA 表达显著高于对照组;而回复组细胞FOXM1、CDK6 及VEGFB 的mRNA 表达均显著低于过表达组,差异有统计学意义(P<0.05),见表3;干扰组细胞FOXM1、CDK6 及VEGFB 的mRNA表达均显著低于无意义组,差异有统计学意义(P<0.05),见表4。
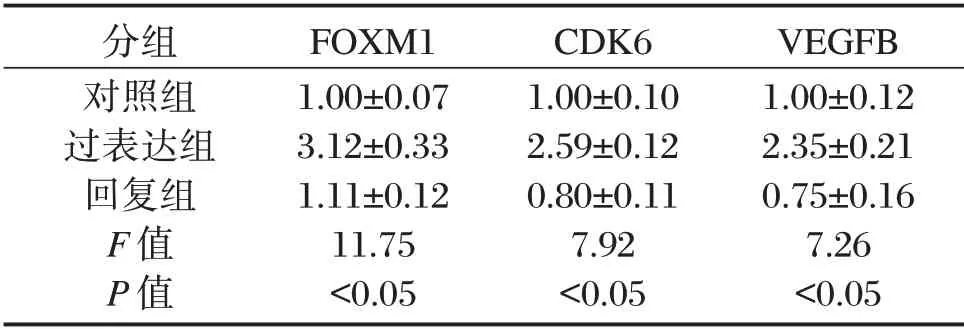
表3 HEC-151 细胞FOXM1、CDK6 及VEGFB 的基因表达含量Table 3 Gene expression levels of FOXM1,CDK6 and VEGFB in HEC-151 cells

表4 KLE 细胞FOXM1、CDK6 及VEGFB 的基因表达含量Table 4 Gene expression levels of FOXM1,CDK6 and VEGFB in KLE cells
3 讨论
抗沉默功能1(ASF1)作为H3/H4 组蛋白伴侣蛋白,参与细胞分裂过程中染色质重塑,并被报道与多种疾病密切相关[7]。有研究指出,过表达ASF1B 可促进肾透明细胞癌细胞的增殖与迁移,与AKT/P70 S6K1 通路的调控密切相关[6];下调ASF1B 可抑制PI3K/AKT 通路,从而诱导癌细胞凋亡[5];ASF1B 和组蛋白H3.3A 相互作用可刺激肿瘤细胞增殖[8]。因此,ASF1B 可能作为潜在的肿瘤靶标参与多种恶性肿瘤的发生发展。前期通过生物信息手段发现ASF1B 与已知的原癌基因FOXM1 在子宫内膜癌中表达显著相关,而FOXM1 的表达是肿瘤组织复发和耐药的关键因素[9],下调FOXM1 的表达可降低肿瘤细胞的活性[10]。这提示ASF1B 可能通过调控FOXM1 在子宫内膜癌中发挥生物学作用。
考虑到ASF1B 在子宫内膜癌中可能的生物学价值,研究通过生物信息技术及临床组织验证发现,ASF1B 在子宫内膜癌组织中高表达,且与患者高临床分期、淋巴结转移及预后不良相关,这提示ASF1B 可能参与子宫内膜癌的发生发展。同时,生物信息学技术分析显示原癌基因FOXM1 与ASF1B 表达在子宫内膜癌中高度正相关,提示ASF1B 可能通过调控原癌基因FOXM1 在子宫内膜癌中发挥生物学作用,进一步的体外研究显示,ASF1B 对FOXM1 及其下游分子CDK6 及VEGFB 存在正调控作用,且可显著促进细胞增殖及转移能力,回复性干扰FOXM1 则显著抑制ASF1B 过表达后的生物学效应,干扰ASF1B 则可抑制FOXM1 及其下游通路,并减弱细胞增殖及转移能力,这些证据表明ASF1B 能有效介导FOXM1 的表达,从而促进子宫内膜癌细胞的恶性表型。
综上所述,ASF1B 在子宫内膜癌的发生与发展中发挥着重要作用,其可通过增强FOXM1 的表达促进子宫内膜癌细胞的恶性表型。本研究结论为子宫内膜癌的治疗提供了新的干预靶点。虽然本研究在细胞水平证实ASF1B 与FOXM1 在子宫内膜癌细胞恶性表型中的作用,但干扰ASF1B 与FOXM1 可以作为子宫内膜癌的治疗策略仍需通过动物实验进一步明确,最终可推广于临床诊断与治疗中[11]。