内听道脑膜瘤的诊断与手术策略
陈立华 张洪钿 孙恺 陈文锦 徐如祥
随着神经影像技术的发展和医生认识的提高,越来越多的小型内听道内肿瘤被发现。然而,发生在内听道的脑膜瘤非常罕见。原发性内听道脑膜瘤(internal auditory canal meningioma,IAC-M)是桥小脑角(cerebellopontine angle,CPA)脑膜瘤罕见的、特殊的肿瘤类型,肿瘤起源于内听道内的硬膜,主体在内听道内,大部分为个案报道,因此术前区分IAC-M和内听道内前庭神经鞘瘤(vestibular schwannoma,VS)有重要意义,因为手术策略和手术入路的选择需根据肿瘤类型而定[1-3]。IAC-M 非常罕见,不仅对神经放射诊断提出了的挑战,而且由于处理该类肿瘤的手术经验相对有限,对神经外科手术医生来说也是一个棘手的难题,现围绕IAC-M 的诊断和手术策略作一综述。
一、诊断和鉴别诊断
IAC-M 应区别于该部位其他更常见的肿瘤,如VS(80%~90%)或CPA 侵犯内听道的脑膜瘤(10%~15%),以及内听道内其他类型的肿瘤。发生在内听道的肿瘤绝大多数是第八脑神经(听神经瘤)的神经鞘瘤。IAC-M 的临床表现与听神经瘤相似。
(一)诊断挑战
由IAC-M 与VS 等累及内听道的病变引起的临床症状和影像学特征非常相似,二者在MR T1WI 上均可表现为等低信号,MR T2WI 上表现为可变信号,注射Gd-DTPA 后明显增强,因此术前MRI 对IAC-M 和VS 缺乏足够的鉴别能力,而且由于IAC-M 与VS 缺乏特定的症状和具体的诊断依据,对于二者的术前鉴别比较困难[1-3]。据相关文献报道,大多数IAC-M 病例最初诊断时均被怀疑是VS[2-9]。为确保IAC-M 准确诊断,术中应进行快速的病理诊断,以帮助患者量身定制合理的治疗方案[10]。
准确诊断的意义:(1)有助于制定正确的手术策略。尽管VS 在内听道内病变中占比较大,但包括脑膜瘤在内的其他不太常见的病理异常也应被考虑,并调整相应的手术策略,以便更好地暴露和更广泛地切除困难病变[11,12]。正确术前诊断的潜在优势是制定脑膜瘤的根治性切除方案,如受累的内听道硬膜需要用金刚石钻打开,但不影响颅神经;脑膜瘤侵犯周围骨质,存在复发的可能,应切除周围的硬脑膜和受累的骨质。另外,准确的术前肿瘤鉴别有助于选择最佳的手术入路,因此IAC-M 需要与VS 鉴别诊断[13]。(2)有助于预测面听神经保留率。在继发性累及内听道的患者中,94%的患者可获得面神经和耳蜗神经的解剖保存,而起源于内听道内的原发性内听道硬膜瘤或内听道内的肿瘤,分别占比80%和75%。肿瘤向内听道内扩展时,面听神经的功能保留率分别为86%和77%,而在内听道内的肿瘤,面听神经的功能保留仅为60%,甚至更差。(3)有助于预测肿瘤复发。脑膜瘤即使在大体完全切除后也有复发的趋势,残余病灶是复发的最重要因素。广泛累及内听道的原发性脑膜瘤有侵袭内耳和颞骨的倾向,肿瘤难以做到根治性切除,复发是必然的[3]。
因此,术前无论肿瘤的影像学特征是否符合脑膜瘤,均应与IAC-M 进行鉴别诊断,这是必要的[2,5,8]。
(二)鉴别诊断
由于IAC-M 在术前很难与VS 区分,因此针对完全位于内听道内的肿瘤,即使临床和影像上倾向于VS,鉴别诊断上也应考虑脑膜瘤的可能[5]。
1.CPA 脑膜瘤鉴别:CPA 脑膜瘤通常可以在MRI 上与VS 鉴别。与VS 不同,大多数CPA 脑膜瘤起源于后岩骨,在内听道的前或后,呈半月形附于岩骨背面,沿着岩后表面有广泛的基底,信号均一,强化较听神经瘤更加明显,脑膜尾征是具有诊断意义的表现。但IAC-M 长大后亦可生长至CPA内,表现为CPA 混合型脑膜瘤的特征,这就需要对继发性与原发性IAC-M 相鉴别。Roser 等[14]报道的72 例累及内听道硬膜患者中34 例需要打开内听道才能做到肿瘤全切除。对于继发性IAC-M,约47.2%的患者需要打开内听道;而原发性IAC-M 均需要打开内听道才能处理肿瘤的基底。CPA 脑膜瘤突入内听道与原发性IAC-M 突入CPA 池的鉴别要点:(1)原发性IAC-M,只有在内听道口周围的硬膜有血管增生,血管增生围绕内听道口;而CPA 脑膜瘤,其后岩骨均可见血管增生。(2)CPA 脑膜瘤突入内听道内时,内听道底可见脑脊液池,肿瘤在内听道内的形态是楔形;而原发性IAC-M,往往在内听道口周围有肿瘤的束腰征,内听道底无脑脊液池。
2.内听道内VS 鉴别:笔者回顾性分析IAC-M 的特征,对IAC-M 和VS 的鉴别要点总结如下:(1)肿瘤位置:VS 在内听道的中心位置;IAC-M 位置不定,取决于肿瘤的起源部位。(2)内听道的形态:VS 的内听道呈扩大状;IAC-M 的内听道受肿瘤侵蚀,或内听道壁增生。(3)周围骨质:VS 一般不累及周围骨质;IAC-M 往往累及周围的结构,如内耳、前庭、迷路。内听道扩大在VS 很常见,而内听道周围的骨侵犯提示脑膜瘤,脑膜瘤可能侵入迷路和耳蜗,并渗透到周围的岩骨腔内和乳突气房。(4)T1 轴位像:VS 垂直于岩骨,IAC-M 与岩骨平行。(5)肿瘤与岩骨壁之间的夹角:VS 呈锐角,IAC-M 呈钝角。(6)脑膜尾征:VS 无脑膜尾征,IAC-M 有脑膜尾征。(7)肿瘤的扩展模式:内听道内肿瘤可分为单纯的内听道内肿瘤、内听道内肿瘤伴CPA 延伸、内听道内肿瘤伴周围骨质侵犯、内听道内肿瘤同时伴有CPA 延伸和侵犯周围骨质。虽然很难将单纯IAC-M 与VS 区分开来,但肿瘤的扩展模式可能为正确诊断提供信息。内听道内小型脑膜瘤向CPA 扩展,通常有一个较宽的基底部;而VS 经常表现为球形(冰激凌外观)。Bacciu 等[15]报道的13 例IAC-M 患者,其中有4 例可观察到肿瘤向CPA扩展,肿瘤有宽广的基底。
二、显微手术治疗策略
内听道内肿瘤经放射外科治疗后,肿瘤体积也许能处理稳定,甚至生长停滞,但颅神经刺激的症状可能无法缓解。此外,放射治疗后肿瘤只是得到控制,而显微外科手术则可以切除肿瘤。Niranjan 等[16]报道29 例接受伽玛刀立体定向放射治疗的内听道内肿瘤患者,尽管15 例(73%)的听力得到了保留,但以耳鸣为主要表现的13 例患者中,7 例在治疗后的长期随访中继续出现耳鸣。另外,组织学诊断只能通过显微手术才能明确,鉴于目前良好的手术效果,笔者推荐显微手术作为主要的治疗选择,当随诊时肿瘤进行性生长,或肿瘤生长导致严重的神经功能缺损时,建议进行手术,但保留单侧听力的需要更倾向于保守治疗。
(一)手术目标
IAC-M 的手术策略和技术与继发性累及内听道内的脑膜瘤没有区别。IAC-M 的主要目标应是在保持面神经功能和尽可能保持正常听力的情况下,实现肿瘤安全、完全的切除(SimpsonⅠ或Ⅱ级),全切除肿瘤及受累的硬脑膜和内听道骨质。由于脑膜瘤往往侵犯骨和硬脑膜,脑膜瘤的复发率高于VS。手术切除这些肿瘤的目的应该是广泛切除受肿瘤侵袭的内听道内硬脑膜和周围的岩骨,以防止复发。解剖保护面神经及蜗神经是容易的,术前耳鸣可能完全消失或改善,但术后面听神经功能的保留率很难达到100%的恢复,术后面部度无力是常见的表现。除了试图保留面神经功能,听力的保存也应该是IAC-M 手术的目标。
(二)手术入路方式
手术入路的选择和手术切除的策略与内听道内VS 病例类似,尽管不同术者采用不同的手术入路,但手术入路的选择主要取决于术前听力、内听道的肿瘤位置以及术者的偏好,主要有3 种手术入路可供选择:经迷路后入路、颞下中窝入路和乙状窦后入路[10]。入路的选择对于非听神经瘤的切除尤其重要,即使肿瘤相对较大,听力往往也可以得到保护,因为IAC-M 不像神经鞘瘤会累及听神经及其血液供应[18]。Bacciu 等[15]报道的34 例IAC-M 患者中,13 例采用经颅迷路入路,13 例采用乙状窦后入路,8 例采用颅中窝入路。在有听力患者中,磨除内听道外侧壁和内听道的底部5~10 mm 的骨质而不损伤迷路是难以做到的。因此,术前必须平衡术后肿瘤复发的风险与保留听力的机会和利弊[19]。
1.经迷路入路:若肿瘤已侵入颞骨的外侧部位,应选择该入路方式。经迷路入路具有创伤小的特点,但其不能保护听力。若存在以下几种情况,可选择经迷路入路:(1)术前听力完全丧失,并伴有中耳结构肿瘤侵犯的患者;(2)肿瘤已经渗透到内耳囊,需广泛切除肿瘤起源的骨质,听力将会因肿瘤切除丧失;(3)术前无有效听力或老年患者或一般情况较差的患者,手术的目标是尽可能减少对小脑的牵拉,扩大的经迷路入路是合适的入路方式;(4)听力极差或已经丧失听力的内听道内VS 患者。
2.经颅中窝入路:适用于术前保存有效听力的小型IAC-M。对于术前听力良好的病例,需有效地保留听力,乙状窦后入路和中颅窝入路是首选的入路方式,可提供类似的听力保护[20]。扩大的颅中窝入路可显露硬膜外整个内听道内肿瘤的路径,便于安全地切除外侧的肿瘤,但其缺点是面神经可能位于肿瘤和术者之间,从而增加对面神经的操作。Bacciu 等[15]报道经手术病理证实的13 例IAC-M 患者,9 例听力障碍、术前无有效听力患者经迷路入路手术;4 例术前存在有效听力的患者均采用扩大颅中窝入路以保留听力,术后2 例听力保持在术前水平。
3.乙状窦后入路:适用于尚有听力的各型IAC-M。优点是肿瘤和毗邻硬脑膜显露清楚,以及良好的神经和血管控制[21]。对于术前耳聋而无肿瘤侵犯中耳结构的患者,有理由支持枕下外侧乙状窦后入路。在累及内听道的大型CPA 脑膜瘤,术前失聪的患者术后听力仍有可能恢复。因此即使听力较差的患者,也应尽力保护耳蜗神经[17]。如果术前保持有效听力,即使肿瘤较大,乙状窦后入路也是理想的手术入路,尽管保留听力的好处可能会抵消理论上肿瘤复发增加的风险[18]。如果肿瘤到达内听道底,经乙状窦后入路亦可延伸至内听道底,切除前庭和半规管,复发风险极低。Amato 等[22]报道1 例IAC-M 患者采用枕下乙状窦后入路,尽管存在高位颈静脉球,打开内听道后壁非常困难,但肿瘤完全切除,相邻的硬脑膜也部分切除并电凝,术后恢复得很好。Ramina 等[23]报道1 例IAC-M 患者,MRI 显示肿瘤完全位于内听道内,破坏内听道,向CPA 池轻微延伸,术前诊断为VS,经乙状窦后入路,显露肿瘤后,术中见前庭耳蜗复合体向后移位,明确诊断为脑膜瘤。经内听道入路改良为广泛开放内听道,包括内听道前壁,肿瘤达到全切除,术后面神经轻度麻痹(House-Brackmann Ⅲ级),3 个月内完全恢复。但Bacciu 等[15]不建议采用乙状窦后入路,因为其能不完全暴露硬脑膜和内听道的外侧壁,遗漏硬脑膜,增加复发的风险。
(三)肿瘤切除的技巧
IAC-M 的手术经验相对有限,其手术策略和技术与继发性累及内听道内的脑膜瘤没有区别,与内听道内VS 类似,但深入研究发现,二者在手术技巧和策略方面还是存在一定的差异性(表1)。
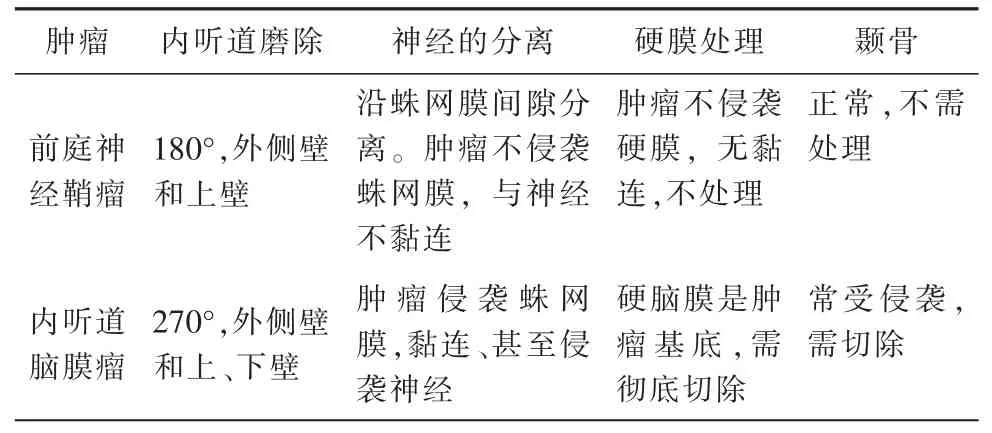
表1 内听道内前庭神经鞘瘤与内听道脑膜瘤的切除要点对比
1.内听道开放:打开内听道是提高累及内听道内肿瘤全切除的关键一步,并不会增加面瘫或听力损失的风险[24]。磨除内听道上、后壁,扩大开放内听道直至内听道底,保护内耳结构。相对于内听道内VS,IAC-M 需更广泛地打开内听道上壁和内听道上结节区骨质,以获得更广泛、更安全的到达肿瘤的路径。在打开内听道时,82%的患者得到全切除,而在不打开内听道时,61%的患者得至全切除。Ishikawa 等[25]报道1 例IAC-M 患者术中磨除内听道后壁,包括肥厚增生的部分、肿瘤附着,完全切除肿瘤,术后MR 检查未见肿瘤残留,术后无面瘫,但耳蜗功能未恢复。IAC-M 与VS 主要的区别是内听道内面神经的累及更为常见[22]。因此,对IAC-M 而言,广泛打开内听道对神经束的显露和保护更为重要。
2.肿瘤分离:仔细分离肿瘤与内听道内的神经血管。仔细的解剖分离和使用面神经监测,有利于成功的切除肿瘤与保留神经功能。在内听道口可见肿瘤的凸起部分,肿瘤表现似脑膜瘤,剪开内听道处硬脑膜,打开肿瘤表面的蛛网膜,切开肿瘤壁,行瘤内减压。减压后从周围结构上分离囊壁,在蛛网膜界面间分离是保护面听神经和动脉(小脑前下动 脉、迷路动脉、小脑后下动脉及其穿支)的关键。然而这些结构有时被包裹,分离时需耐心。IAC-M 常使面听神经发生移位在切除肿瘤过程中要注意面听神经的移位、变形及被肿瘤的包埋情况。只要严格循蛛网膜界面(瘤-面听神经界面、瘤-脑界面)进行分离,一般可保留受累的颅神经。
3.保护内听道内的面神经:面神经功能的保护是IAC-M手术中面临的最重要的问题之一。值得注意的是,脑膜瘤与面神经的解剖关系不同于VS。VS 的面神经被内听道内的肿瘤压迫并向腹侧和下方移位,而脑膜瘤不仅压迫面神经,而且与之密切相关。IAC-M 可能牢牢地附着在面和/或前庭耳蜗神经上,需要仔细解剖。辨认面听神经,沿内听道口逐步将脑膜瘤与内听道壁分离,将肿瘤的内听道底端轻轻地从内听道底端抬起,内听道内肿瘤与面听神经一般黏连较轻,易于用剥离子分离,将脑膜瘤逐步从周围结构中分离出来。脑膜瘤和面神经之间的黏连也比VS 更难分离,即使是较小的肿瘤。细致而锐性的解剖对于避免面神经损伤是非常重要的,即使是小型IAC-M 的病例中也是如此,另外,在少数肿瘤中面神经受肿瘤侵蚀,分离保护就更加困难。持续的冲洗确保分离界面清晰,及时止血并保持视野清晰,有助于保护面听神经。Asaoka 等[9]报道的3 例IAC-M 患者中有2 例面神经完全被肿瘤吞噬,但术前严重受损的面听神经,脑干听觉诱发电位在肿瘤切除后稍有改善,可见到Ⅲ波及Ⅴ波,但其潜伏期仍延长、波幅较低。当肿瘤较大时可长入Meckel 腔、海绵窦和中颅窝,需磨除岩尖。
4.保留有效听力:原发性IAC-M 起源于内听道内部,如果术前尚存有效听力时,应努力尝试保留听力,但肿瘤复发的风险可能增加。因此需要适度磨除一定的骨质,既要做到肿瘤全切除,又要避免耳囊和内耳损伤。Carney 等[18]报道6 例IAC-M 患者,3 例骨质质切除相当有限,迄今尚未发现肿瘤复发,唯一复发的是次全切除的病例。因此,作者认为术中若发现或怀疑脑膜瘤切除不完全,必须毫不犹豫地牺牲听力功能。
5.神经内镜辅助技术:术者必须先熟练显微镜操作再熟悉神经内镜,否则会在切除肿瘤时出现严重残留的情况。采用神经内镜技术可以即时评估手术效果,提高IAC-M 全切率。IAC-M 手术中,因显微镜对内听道底深部肿瘤较难观察,难以达到全切,而神经内镜的多角度观察弥补了显微镜的不足。在显微镜对肿瘤进行大部分切除后,通过神经内镜观察,术者可对肿瘤切除程度进行即时且准确的判断,同时可观察内听道内有无活动性出血。对于部分残留于内听道内的肿瘤,在神经内镜下可进行有选择的切除,而与面听神经、迷路动脉等重要结构黏连紧密的部分则可采取电灼烧,无需盲目追求全切。
(四)术后并发症与预后
1.耳蜗神经损伤:IAC-M 术中发生实质性的耳蜗损伤并不常见,这也许是手术切除IAC-M 后听力得到改善的原因[26]。据报道,脑膜瘤切除后听力恢复,这与“脑膜瘤的症状是由邻近结构压迫引起的,而不是由侵犯引起的”理论是一致的。因此术者必须牢记,与肿瘤相关的耳蜗、面神经束解剖结构的变化,任何情况下都应以保存这些结构为目标。
2.面神经损伤:大多数文献报道IAC-M 术后面神经功能可得到有效的保护。Magliulo 等[27]报道2 例IAC-M 患者,术后面神经功能均恢复到Ⅰ级。Bacciu 等[15]于2007 年报道的13例IAC-M 患者中,术后面神经功能正常(H-BⅠ级或Ⅱ级)10例(77%),中度功能异常(H-B Ⅲ级,7.7%)1 例,2 例术前面神经麻痹术后无明显改善。但Rinaldi 等[13]报道的9 例IAC-M患者,术后均出现不同程度的颅神经麻痹。
综上所述,IAC-M 非常罕见,术前需要与内听道内患者VS 鉴别诊断,对于怀疑IAC-M 的病例,应仔细进行影像学评估,并做好相应的手术计划,调整手术策略,以便更好地暴露肿瘤,使肿瘤获得更广泛、更彻底的切除。正确的术前诊断将促使肿瘤周围硬脑膜的广泛切除,有助于提高手术疗效。
利益冲突所有作者均声明不存在利益冲突

