磷酸化Ti、Zr复合金属氧化物催化六碳糖转化制备5-羟甲基糠醛
赵 源, 曲 杨, 朱玲君, 徐 昊, 陆凯锋, 王树荣
(浙江大学 能源清洁利用国家重点实验室,浙江 杭州 310027)
我国的生物质资源量丰富,但长期以来得不到有效利用。如能将我国资源量丰富的生物质高效转化制取高附加值化学品与生物液体燃料,将有助于解决我国的能源短缺与环境问题。5-羟甲基糠醛(HMF)是一种可以由生物质制取的高附加值平台化合物,HMF可以进一步转化为一系列化学品与生物燃料[1-2],如,HMF可与醛酮类分子通过缩合反应形成可直接用作交通运输燃料的链烷烃[3]。因此,加快生物质资源高效转化制备HMF技术的研发将有助于推动我国能源结构优化,缓解生态环境压力,契合国家重大需求。HMF的制备过程主要包含2个步骤,首先生物质中的纤维素和半纤维素水解生成单糖,随后单糖再脱水转化生成HMF[4]。由于生物质结构复杂,生物质的主要构成单元之一葡萄糖,以及葡萄糖转化过程中的重要中间产物果糖常被用作反应物以探索HMF生成规律,并在此基础上构建新型反应体系[5-6]。目前六碳糖转化制备HMF的研究中使用的溶剂主要包括单相体系与双相体系。水是单相体系中最常见的溶剂,但由于其强极性等性质,HMF在水中的产率较低,且容易与水反应生成其他副产物[7]。因此,常采用有机溶剂-水共溶体系以抑制副反应发生。有机溶剂常选用萃取能力较高的四氢呋喃(THF),从而使得HMF能够更快、更多地从水相转移到有机相[8]。THF不仅起到了萃取剂的作用,同时也能够促进HMF的水合、降解和缩聚副反应的发生[9]。催化剂的选择也是HMF制备技术中最重要的影响因素之一,其主要分为均相催化剂与非均相催化剂。非均相催化剂具有腐蚀性低、热稳定性强、易于分离等优点,因此成为近年来的研究热点。常用的非均相催化剂包括质子化沸石、过渡金属氧化物、炭基催化剂等[6]。其中,复合金属氧化物催化剂能够强化金属氧化物表面酸性,提高反应物转化率与HMF产率。磷酸化金属氧化物因其优秀的酸强度而广为人知,并且适用于多种酸催化反应。Antonetti等[10]使用磷酸锆催化剂在水溶液中催化果糖转化得到了39.4%的HMF产率,并且催化剂循环使用3次后产率仅下降了3%。Atanda等[11]在正丁醇-水混合溶剂中使用磷酸钛催化葡萄糖转化,得到了高达81%的HMF产率,3次循环后HMF产率降低至70%。然而,此前的研究往往着眼于催化剂的构建与HMF的制取,而对催化剂组分构成对糖类水热转化路径的调控机制没有深入研究,特别是催化剂中L酸、B酸对产物生成及演变的影响。因此,本研究选取THF/水作为溶剂体系,制备磷酸化复合金属氧化物(TiZrPO)催化剂,并考察其组分构成对六碳糖脱水转化制备HMF过程的影响;通过改变催化剂中Ti、Zr元素比例,尝试对催化剂酸性分布进行优化,并对比研究了不同酸性分布下的催化性能,以期为生物质原料催化转化制备HMF提供参考。
1 实 验
1.1 材料与仪器
果糖、葡萄糖、5-羟甲基糠醛(HMF)、左旋葡聚糖、钛酸异丙酯和正丁醇锆购置于阿拉丁试剂公司。异丙醇和磷酸购置于国药集团化学试剂有限公司。
Panalytical Axios顺序式波长色散型X射线荧光光谱(XRF)仪,荷兰Panalytical BV公司;Talos-S场发射透射电子显微镜(STEM),美国FEI公司;Nicolet iS50红外光谱(FT-IR)仪,UltiMate 3000高效液相色谱(HPLC)仪,美国Thermo Scientific公司;AutoChem II 2920全自动程序升温化学吸附/脱附(TPD)仪,美国Micromeritics公司;CEM Discover SP聚焦单模微波合成系统,美国CEM公司。
1.2 催化剂TiZrPO的制备
使用钛酸异丙酯和正丁醇锆作为前驱体,按照Ti和Zr物质的量之比(7 ∶3、 1 ∶1与3 ∶7)分别将钛酸异丙酯和正丁醇锆滴加到异丙醇溶液中,使前驱体与异丙醇的物质的量之比为1 ∶40。将所得溶液搅拌均匀后加入磷酸,磷酸的物质的量为Ti和Zr总物质的量的20%,然后搅拌3 h。而后将溶液放置于室温下老化24 h,之后置于110 ℃的烘箱内干燥过夜,并在500 ℃马弗炉中焙烧6 h。3种Ti、Zr物质的量之比(7 ∶3、 1 ∶1与3 ∶7)所制得的催化剂分别记作TiZrPO-1、TiZrPO-2和TiZrPO-3。作为参照,在不加磷酸的条件下制备所得催化剂记作TiZrO,其中Ti和Zr的物质的量之比为1 ∶1。
1.3 催化剂表征
1.3.1XRF分析 使用顺序式波长色散型X射线荧光光谱仪进行XRF分析,测定催化剂中各元素含量。
1.3.2STEM分析 催化剂的形貌与元素分布采用扫描透射电子显微镜进行分析。待测样品在玛瑙研钵中研磨后,取少量分散于无水乙醇中,并用超声波分散,然后用毛细管吸取悬浊液滴在悬挂有碳膜的铜网上,红外灯干燥后送入电镜样品室进行观察。
1.3.3FT-IR分析 采用红外光谱仪测定吡啶吸附傅里叶变换红外光谱(Py-FT-IR)图。将约20 mg催化剂在200 ℃真空下活化1 h,然后冷却至常温常压,采集背景。加过量吡啶静置30 min,然后升温至170 ℃保持30 min以脱除过量吡啶,最后通N2吹扫30 min并在170 ℃条件下采集红外光谱图。
1.3.4NH3-TPD分析 为了测定催化剂的总酸量与酸性强弱,使用全自动程序升温化学吸附仪对催化剂样品进行NH3-TPD分析测试。将100 mg样品在氦气中加热至500 ℃并保持30 min,以去除污染物。然后在100 ℃下通NH3与氦气的混合气体(V(NH3) ∶V(He)=1 ∶9)直到饱和,最后以10 ℃/min 升温至500 ℃进行程序升温脱附,并在500 ℃保持30 min。
1.4 TiZrPO对六碳糖制备HMF的催化
脱水反应在聚焦单模微波合成系统中进行。在一个标准反应过程中,将1 mL水与4 mL四氢呋喃(THF)加入10 mL耐压玻璃反应瓶中,然后加入0.09 g六碳糖、0.03 g催化剂与0.2 g NaCl。反应瓶置于微波反应器中升至170 ℃进行反应,反应过程中使用磁力搅拌。微波的设计最大功率为300 W,本实验中将反应器配套控制软件中的功率大小设置为“High”,控制程序根据实际加热状态对加热功率进行自动调整。反应时间达到设定值后,使用高压空气气流对反应瓶进行快速冷却。冷却后使用0.22 μm有机滤膜对溶液进行过滤,滤液稀释10倍后利用HPLC进行产物分析。相同的实验条件进行3次重复实验,取平均值和标准差进行分析。
1.5 产物分析
使用高效液相色谱仪对果糖、葡萄糖、HMF与左旋葡聚糖进行定量分析,色谱柱为Bio-rad HPX-87H(300 mm×7.8 mm),果糖、葡萄糖、HMF与左旋葡聚糖的保留时间分别为9.55、 8.80、 29.93和11.78 min。检测器使用德国Schambeck SFD公司RI2000型示差折光检测器,流动相使用0.005 mol/L的稀硫酸水溶液,流速为0.6 mL/min,柱温设置为60 ℃,检测器温度为40 ℃。各物质的浓度通过与标准曲线比对求得。六碳糖(HEX)转化率、HMF产率、果糖(FRU)产率和左旋葡聚糖(LG)产率通过以下公式计算得到:
式中:CHEX—六碳糖转化率,%;nHEX,0—反应前加入的六碳糖物质的量,mol;nHEX—反应后剩余的六碳糖物质的量,mol;YHMF—HMF产率,%;nHMF—生成的HMF物质的量,mol;YFRU—果糖产率,%;nFRU—生成的果糖物质的量,mol;nGLU,0—反应前加入的葡萄糖物质的量,mol;YLG—左旋葡聚糖产率,%;nLG—生成的左旋葡聚糖物质的量,mol。
2 结果与讨论
2.1 催化剂表征结果
2.1.1XRF分析 使用XRF测得催化剂中的钛元素、锆元素和磷元素的物质的量之比如表1所示。
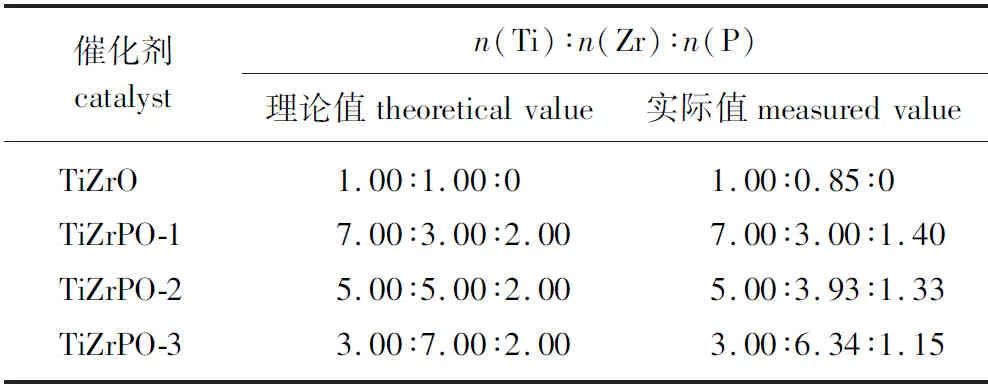
表1 催化剂主要元素组成Table 1 The elemental composition of catalysts
由表1可知,TiZrO、TiZrPO-1、TiZrPO-2和TiZrPO-3中3种元素物质的量之比分别为1.00 ∶0.85 ∶0、7.00 ∶3.00 ∶1.40、 5.00 ∶3.93 ∶1.33和3.00 ∶6.34 ∶1.15,与理论值较为接近。
2.1.2STEM分析 以TiZrPO-2为例,通过扫描透射电子显微镜(STEM)得到TiZrPO催化剂的微观结构,结果如图1所示,分别为STEM图像以及其对应的P、Ti和Zr元素映射图。由图1(a)可看出催化剂为较厚的片层状结构。图1(b)~图1(d)中不同颜色的亮点对应不同的元素种类,可以看出3种元素均匀分布于催化剂中。

a.STEM; b.P; c.Ti; d.Zr
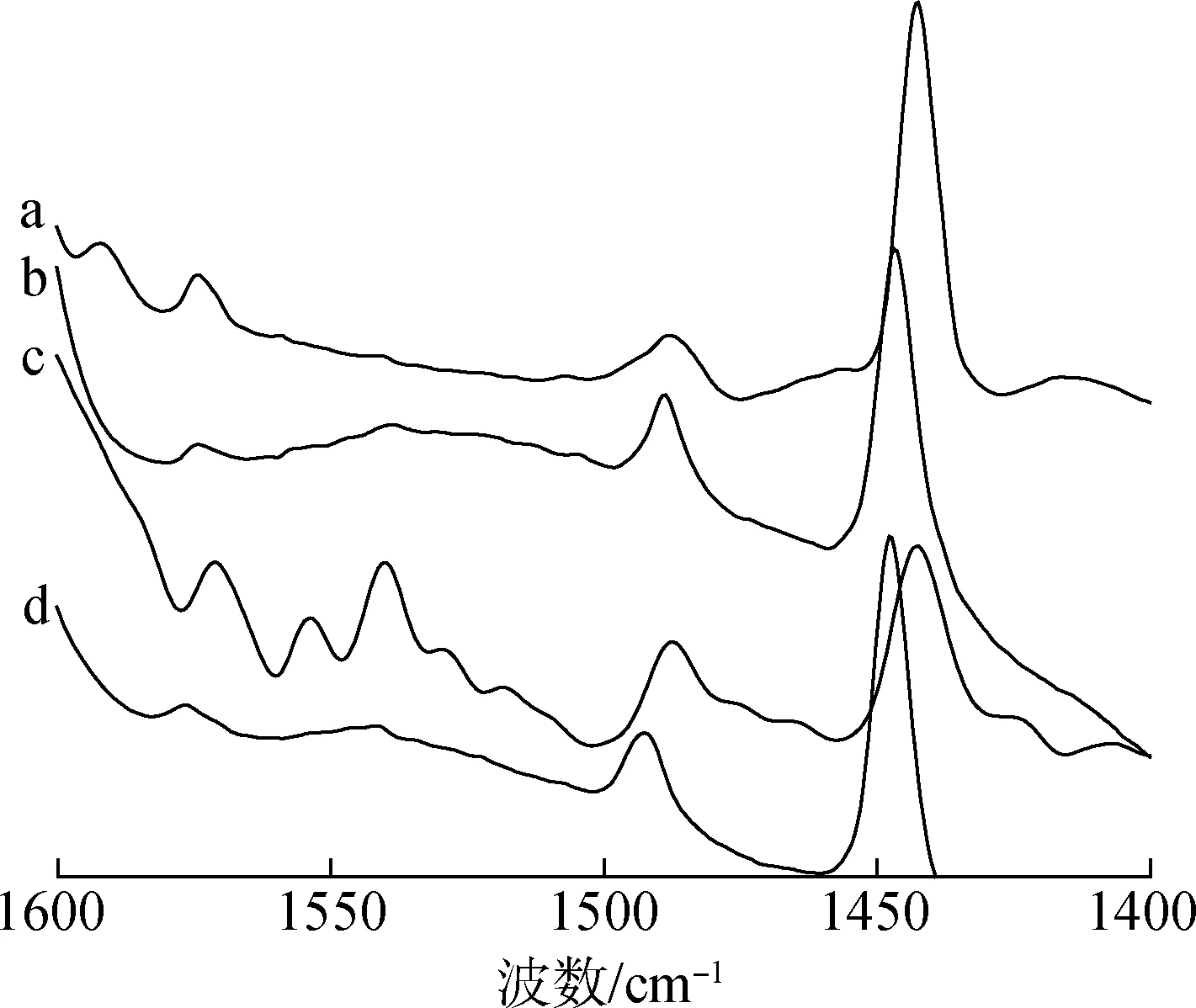
a.TiZrO; b.TiZrPO-1; c.TiZrPO-2; d.TiZrPO-3图2 催化剂吸附吡啶后的FT-IR谱图Fig.2 FT-IR spectra of catalysts after adsorbing pyridine
2.1.3FT-IR分析 图2为170 ℃下记录的4种催化剂的红外吸收光谱图。其中1540 cm-1附近的吸收峰代表B酸酸性位点,1440~1450 cm-1附近的吸收峰代表L酸酸性位点[12]。可以看出,TiZrO在1540 cm-1附近几乎不存在吸收峰,这与Manríquez等与Atanda等观察到的结果相一致[13-14]。TiZrPO-1和TiZrPO-3在该处存在较宽的吸收峰,而TiZrPO-2的吸收峰最为明显。
基于朗伯-比尔定律可以进一步对L酸与B酸酸量进行半定量计算分析,其中酸量与峰面积成正比[15-16],计算结果如表2所示。对比发现,TiZrO的B酸酸量和总酸量最低。引入P元素后,催化剂的B酸酸量和总酸量都有一定程度地增加。这是由于新增了P—OH基团,其中P属于高电负性元素,对羟基上电子具有强吸引作用,使得羟基上H易转化为H+,因此,为催化剂提供了额外的B酸酸量[10]。此外P也可夺取金属上的电子,导致金属上的电子密度降低,更易接受外部电子对,从而提升L酸酸量[17]。
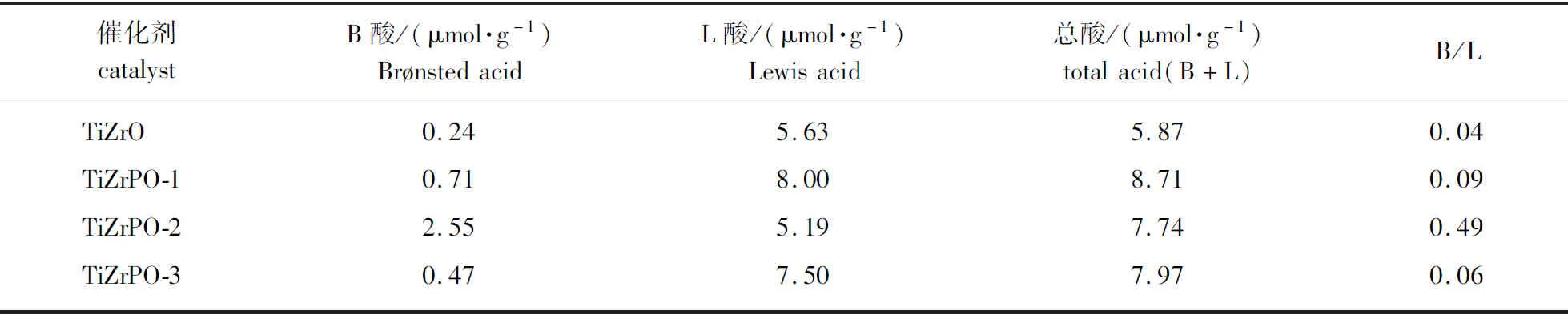
表2 170 ℃下TiZrPO催化剂中B酸与L酸的酸量分布及总酸量Table 2 Distribution and amount of Brønsted acid and Lewis acid in TiZrPO at 170 ℃
Tanabe等[18]认为在复合金属氧化物结构中,不同金属价电荷与配位数间差异会造成金属自身电荷失衡,从而使得其酸性相比单一金属氧化物有所提升。基于Tanabe提出理论可计算得知TiO2中Ti被Zr取代后,将主要增加B酸酸量,而ZrO2中Zr被Ti取代后主要提高L酸酸量[19]。Seiyama[20]认为复合金属氧化物酸性增强的原因来自于不同金属价电荷与配位数间差异导致的O电荷失衡,根据该理论Ti与Zr混合后将主要提升B酸酸量。表2中TiZrPO-2的B酸酸量最高,但L酸酸量相比TiZrO未发生明显变化,与该理论相符合。Tajima等[21]也发现对于TiO2-ZrO2复合型催化剂,当2种金属物质的量之比接近时L酸酸量相比其他比例有所降低。此外,TiZrPO-1具有最高的总酸量,TiZrPO-2和TiZrPO-3的总酸量相近。TiZrPO-2具有最高的B酸酸量占比,其余3种催化剂的B酸与L酸酸量之比相近且数值较小。

a.TiZrO; b.TiZrPO-1; c.TiZrPO-2; d.TiZrPO-3图3 不同催化剂的NH3-TPD曲线Fig.3 NH3-TPD profiles of different catalysts
2.1.4NH3-TPD分析 图3对比了各个催化剂的NH3-TPD曲线。各催化剂的弱酸与强酸位点对应的脱附峰较为明显,分别处于164和380 ℃附近。其中TiZrO的总酸量最低,且弱酸酸性位点比例较高;TiZrPO-2与TiZrPO-3的酸强度相近,TiZrPO-2的弱酸位点较多;TiZrPO-1的总酸量最高,且强酸位点较多。根据Pauling电负性理论[22],P、Ti和Zr的电负性值分别为2.19、1.54和1.33,由此可判断P的加入对于催化剂整体酸强度的提升效果较好,而Ti含量的提高相比于Zr对催化剂酸强度的提升效果更优,与图3中结果相符。总酸量结果与表2中的L酸+B酸总酸量半定量分析结果相一致,但对比发现吡啶红外定量分析得出的L酸、B酸酸量与NH3-TPD测试得出的强酸、弱酸含量无明显关联。
2.2 果糖转化结果分析
2.2.1催化剂的影响 果糖作为生物质中重要的六碳糖组分,主要存在于蔗糖与菊糖之中,且是葡萄糖脱水转化过程中的关键中间产物之一[23]。首先对比了不同催化剂及无催化剂条件下果糖的转化率和HMF产率,结果见表3。由表3可知,不添加催化剂时,果糖仍然发生了部分转化,这是因为在纯水条件下少量果糖能够自发地进行脱水与水合反应生成甲酸,从而实现果糖的自催化脱水转化[24]。但是该条件下果糖转化率与HMF产率最低,分别为62.0%和26.6%。加入TiZrO催化剂后,果糖转化率与HMF产率分别上升至88.1%和52.3%,证明TiZrO催化剂具有较好的催化性能。通过在催化剂中引入P元素,催化剂的酸量提高(表2),进一步促进了果糖的催化转化。TiZrPO-1、TiZrPO-2和TiZrPO-3对应的HMF产率分别为69.4%、75.7%和65.7%,相应的果糖转化率均达到92%以上。
2.2.2果糖添加量的影响 考虑到实际应用可能对反应进行放大以提升经济性,在1.4节的反应条件下,选取了不同的果糖添加量进行研究,对应的果糖转化率和HMF产率亦见表3。由表3可以发现,当果糖添加量增加时,果糖转化率始终维持在94%以上,HMF产率有略微下降。当添加量为0.36 g时,果糖质量分数约为7.9%,果糖与催化剂质量比值为12,已经高于大多数同类研究[6,10]。因此,本研究所开发的催化剂适用于转化高浓度果糖,整个反应体系具有扩大化应用前景。
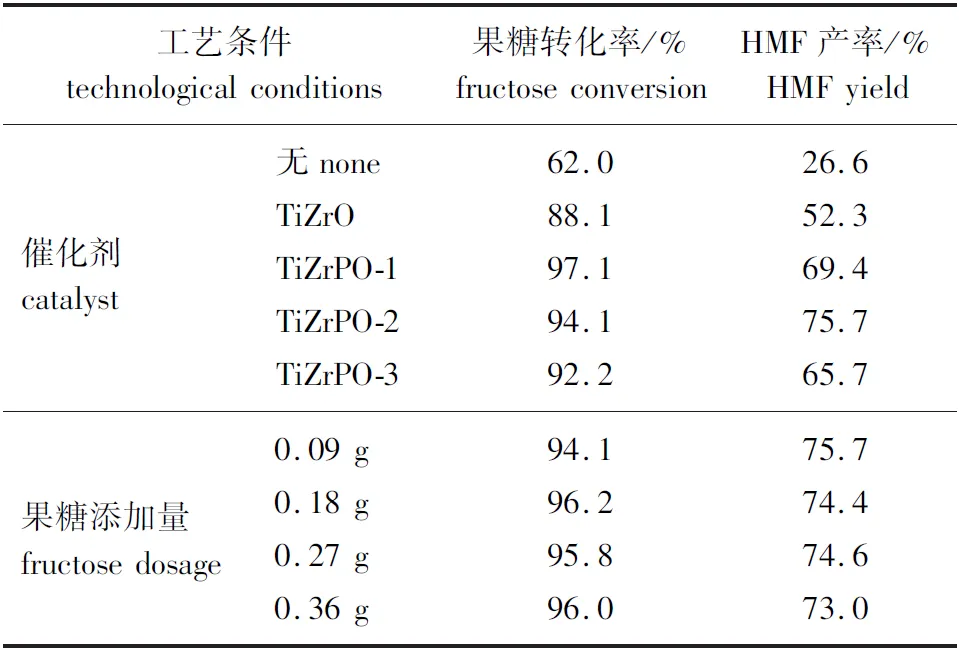
表3 不同工艺条件对果糖转化制取HMF的影响Table 3 Influence of different technological conditions on the conversion of fructose to HMF
2.2.3反应时间的影响 在1.4节的反应条件下,进一步选择催化性能较优的3种含磷催化剂,研究了果糖转化率随时间变化情况,结果见图4(a)。由图可知,各催化剂催化下的果糖转化率都随反应时间延长而上升,反应进行10 min时TiZrPO-1、TiZrPO-2和TiZrPO-3对应的转化率分别为83.7%、72.8%和66.3%;反应时间为40 min时果糖几乎完全转化,转化率均达到98%以上。TiZrPO-1催化下的果糖转化率最高,而另外2种催化剂对应的果糖转化率相近,这与表2中各催化剂的总酸量大小顺序相符合。因为B酸和L酸都可促进果糖的转化,其中B酸主要促进果糖的脱水转化反应,而L酸可能会促进果糖发生其他副反应[25]。因此为了提高果糖转化率,可以提高催化剂的总酸量。同时还考察了不同催化剂条件下HMF产率随时间的变化情况,结果见图4(b)。可以看出,TiZrPO-1、TiZrPO-2和TiZrPO-3对应的HMF产率变化趋势类似,且都随反应时间延长逐渐上升,分别为71.8%、76.5%和66.6%。由此可以得到各催化剂对果糖制备HMF反应的催化性能由高到低顺序为:TiZrPO-2>TiZrPO-1>TiZrPO-3。该顺序与表2中催化剂B酸与L酸酸量之比大小顺序相一致,说明较高的B酸比例有助于提高HMF产率。Ordomsky等[26]使用多种固体酸催化剂催化果糖转化制取HMF时也发现B酸在催化剂中占比高时能够获得更好的HMF选择性,认为L酸导致HMF选择性降低的原因在于其促进了反应初期果糖缩聚副反应的发生,并生成了胡敏素副产物。所以为了提高HMF的产率,需要对催化剂结构进行优化以提高其B酸比例。

图4 果糖转化率(a)和HMF产率(b)随时间变化情况
2.3 葡萄糖转化结果分析
葡萄糖直接构成了生物质中的纤维素组分,同时也是半纤维素的主要构成单元之一[27-28]。在前述果糖转化结果的基础上,尝试将本研究所提出的催化反应体系进一步推广至葡萄糖。在1.4节的反应条件下,3种含磷催化剂对葡萄糖转化制取HMF的影响如图5所示。在相同条件下,葡萄糖比果糖更难转化,这主要是因为水溶液中具有高反应活性的链式葡萄糖的含量比链式果糖含量更低[29-30]。所以尝试将反应时间延长至180 min,以期望获得更好的葡萄糖转化率与HMF产率。随着反应时间延长,葡萄糖的转化率持续增加,到反应进行180 min时3种催化剂TiZrPO-1、TiZrPO-2和TiZrPO-3对应的葡萄糖转化率分别为78.0%、72.2%和74.1%。与图4(a)中果糖转化的规律类似,葡萄糖的转化率也与催化剂所含有的总酸量相关联。其中TiZrPO-1和TiZrPO-3的总酸量较高,对应的葡萄糖转化率也较高;TiZrPO-2的总酸量最低,所以其对应的葡萄糖转化率最低。与果糖稍有不同的是,果糖转化时起主要作用的是B酸,而葡萄糖转化制取HMF过程中B酸和L酸均可起促进作用。一方面葡萄糖可以在B酸催化下直接脱水生成HMF,另一方面葡萄糖也可以在L酸催化下异构化为果糖[25,31]。结合表2可知TiZrPO-2与TiZrPO-3的总酸量相近,但是TiZrPO-3的L酸量更高且对应的葡萄糖转化率更高,因此L酸相比B酸对葡萄糖转化具有更好的促进作用。而对于果糖转化率,TiZrPO-2与TiZrPO-3的催化性能相近(图4)。图5(b)显示了HMF产率随时间的变化情况,其中TiZrPO-1、TiZrPO-2和TiZrPO-3催化下所获得的最大HMF产率分别为33.1%、38.1%和25.5%。与果糖转化生成HMF的规律类似,B酸与L酸比例与HMF产率直接相关。其中TiZrPO-2的B酸比例最高,所以对应的HMF产率也最高。与图4(b)对比可以发现葡萄糖的HMF产率低于果糖的HMF产率,这主要是由于与果糖相比,特别是L酸催化下的葡萄糖异构化-脱水路径较为复杂,需要经历开环、烯醇化、1,2-氢转移等一系列反应过程才可最终生成HMF,导致葡萄糖反应速率较慢[32]。Fan等[30]采用多种固体杂多酸盐催化剂催化果糖和葡萄糖转化制取HMF,发现相同反应条件下葡萄糖的转化率与HMF产率较果糖更低。Zhang等[33]使用了与本研究相类似的催化剂SO42-/ZrO2-TiO2,在170 ℃条件下反应2 h后得到了96.5%的葡萄糖转化率与26.0%的HMF产率。
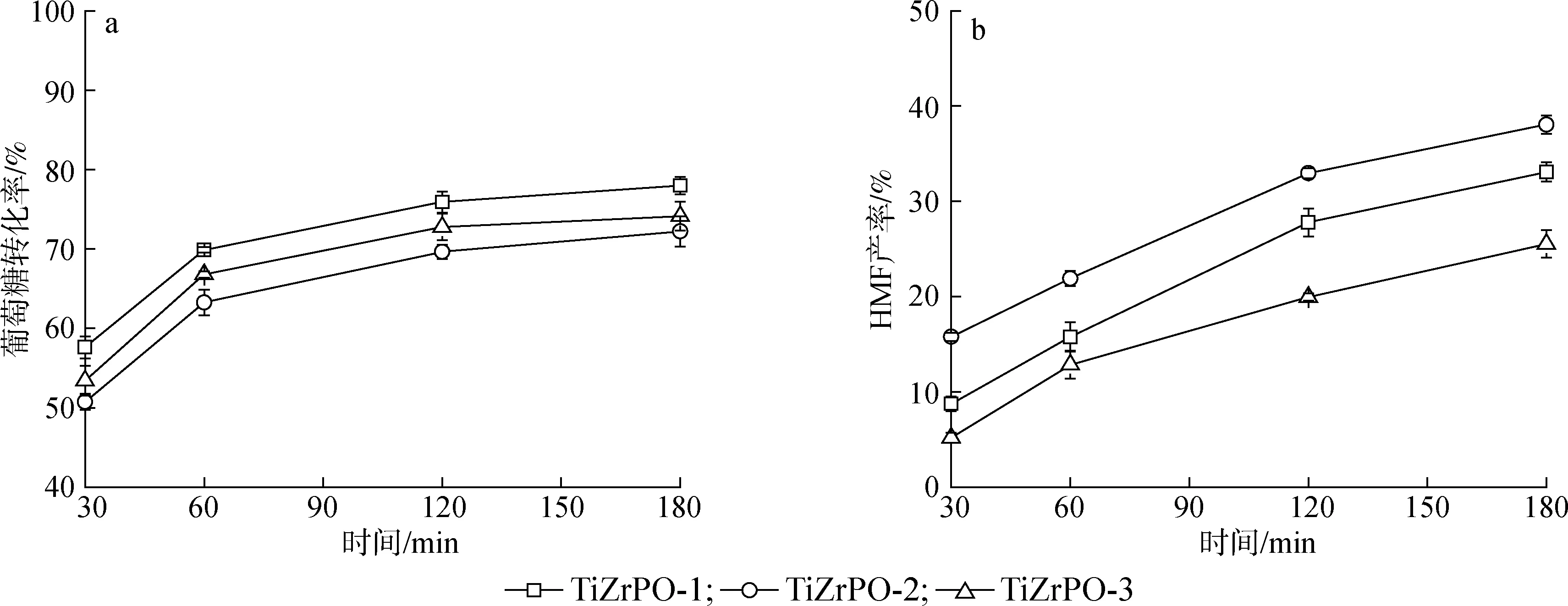
图5 葡萄糖转化率(a)和HMF产率(b)随时间变化情况
2.4 催化剂重复使用性能
考虑到反应过程的经济性,在0.09 g反应物、1 mL水、4 mL THF、0.03 g TiZrPO-2、0.2 g NaCl和170 ℃的反应条件下,测试了催化剂的循环使用性能。反应结束后过滤得到剩余固体,使用丙酮洗涤后在110 ℃条件下干燥2 h,然后用于下批次果糖或葡萄糖脱水制备HMF反应,循环使用4次的结果见表4。催化剂多次使用后,葡萄糖的转化率和HMF产率都有所降低,HMF产率由最初的38.1%降低至30.4%。这可能是由于循环使用后催化剂表面吸附并积聚了无法被洗涤的反应副产物,导致催化剂酸性位点被覆盖,从而使得催化活性降低[34]。相比之下,果糖作为反应物时HMF产率降低幅度较小(76.5%到72.6%),这主要是因为果糖所需反应时间较短,催化剂表面的副产物吸附量相对较少,失活不明显。有研究者提出使用重新焙烧的方法对催化剂进行再生,该方法相比于有机溶剂洗涤再生方法,催化性能降幅更小,但使用焙烧再生方法需要综合考虑整个反应工艺的能耗与复杂性[34-36]。

表4 催化剂的循环使用性能Table 4 Recyclability of catalyst
2.5 葡萄糖脱水转化机理分析
为了深入研究TiZrPO催化剂中L酸、B酸含量对葡萄糖脱水反应的影响机理,在0.09 g葡萄糖、 1 mL 水、 4 mL THF、 0.03 g催化剂、 0.2 g NaCl和170 ℃的反应条件下,使用HPLC定量测定了葡萄糖、果糖和左旋葡聚糖,并计算果糖产率与左旋葡聚糖产率,如图6所示。其中果糖主要来自于L酸催化下的葡萄糖异构化反应,而左旋葡聚糖来自于B酸催化下的葡萄糖分子内脱水反应,并可以进一步脱水生成HMF[23,37]。果糖产率由大到小对应的催化剂顺序为TiZrPO-3>TiZrPO-1>TiZrPO-2,与表2中各催化剂B酸与L酸酸量之比由小到大的顺序相一致,表明催化剂中的L酸位点对果糖的生成具有促进作用。此外,果糖产率顺序与图5(b)中HMF产率顺序相反,可能的原因是L酸导致果糖发生了分子间缩合副反应,导致HMF产率较低[26]。可能的原因是L酸导致果糖发生了分子间缩合副反应[26]。对于左旋葡聚糖的生成,由图6(b)可以发现TiZrPO-2对应的左旋葡聚糖产率最高,TiZrPO-1和TiZrPO-3催化下的左旋葡聚糖产率相近。结合催化剂表征结果可知,TiZrPO-2的B酸酸量最高,而TiZrPO-1和TiZrPO-3的B酸酸量较低,这使得在TiZrPO-2催化下葡萄糖更容易发生分子内脱水而生成左旋葡聚糖。
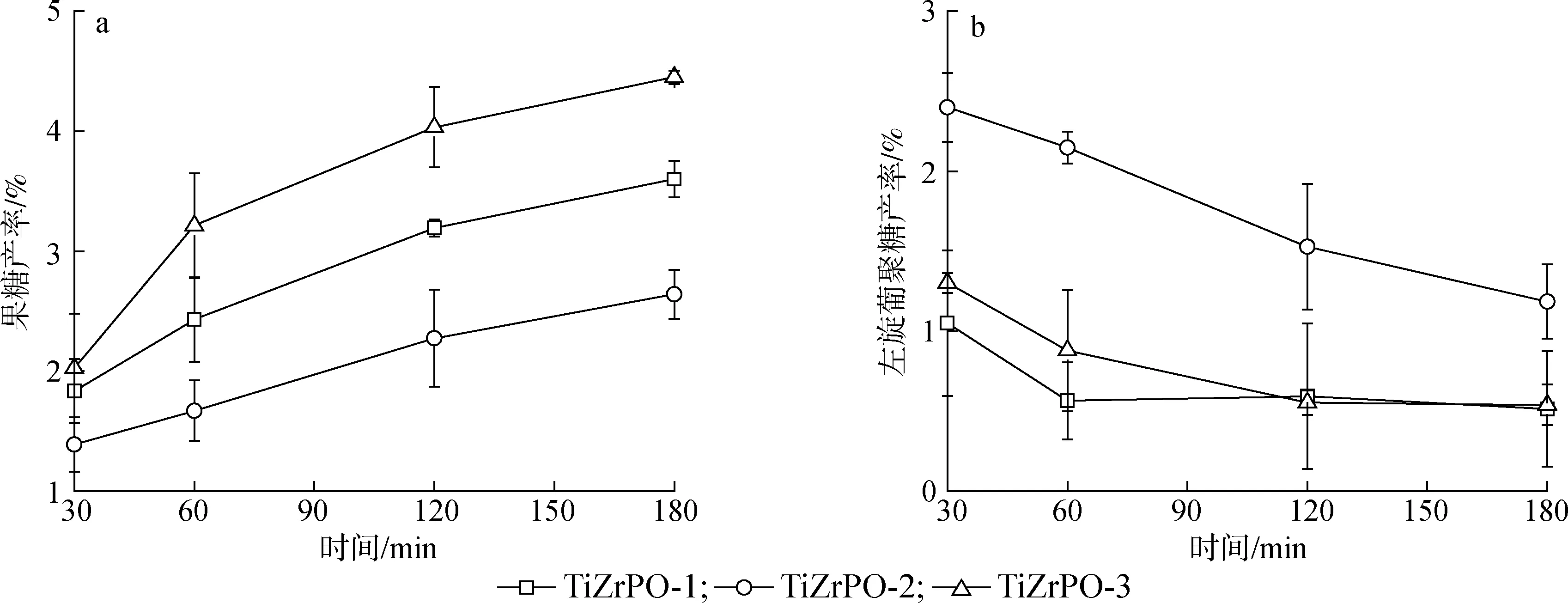
图6 果糖产率(a)和左旋葡聚糖产率(b)随时间变化情况
综上所述,果糖相比于葡萄糖反应活性更高,所以L酸的引入有助于葡萄糖的转化与HMF的生成,但是L酸过多时会导致副反应的发生,使得HMF产率降低,因此需要通过调整催化剂中的Ti与Zr比例来优化催化剂的L酸与B酸分布,以获得最佳的葡萄糖转化率与HMF产率。此外,THF对HMF相关的副反应能够起到抑制作用,有助于HMF产率的提升。
3 结 论
3.1构建了同时具有L酸与B酸酸性位点的复合金属氧化物催化剂(TiZrO),并引入P元素以进一步提高催化剂的B酸酸量,得到催化剂TiZrPO;通过XRF、STEM、FT-IR和NH3-TPD分析方法对不同Ti、Zr元素含量的催化剂进行了结构表征。结果表明:Ti、Zr、P元素均匀地分布在催化剂中,通过改变金属元素比例能够调整催化剂的L酸、B酸分布,其中当Ti、Zr元素物质的量之比为1 ∶1时,催化剂TiZrPO-2中的B酸酸量最高为2.55 μmol/g,B酸与L酸酸量比值达到最高为0.49。
3.2将制备的TiZrPO催化剂用于六碳糖催化转化制取HMF。果糖转化结果显示:催化剂总酸量的提高能够促进果糖转化,同时高B酸比例的催化剂能够实现较高的HMF产率。葡萄糖的转化结果表明:在L酸作用下部分葡萄糖被异构化为果糖,而在B酸作用下部分葡萄糖经脱水转化生成了左旋葡聚糖。TiZrPO-2的催化性能最优,在其催化下获得了98.5%与72.2% 的果糖和葡萄糖转化率,对应的HMF产率分别为76.5%和38.1%。在保证催化活性的前提下,TiZrPO-2表现出较好的重复使用性能,当循环使用4次时,果糖和葡萄糖转化率仍达92.7%和65.8%,对应的HMF产率分别为72.6%和30.4%。

