电针对复杂性区域疼痛综合征I型大鼠模型局部组织氧化应激反应的干预作用
李晓洁,尹诚语,郑小莉,聂慧敏,曾丹怡,王洁,陈瑞香,刘伯宇,台燕,邵晓梅,刘伯一∗
(1.浙江中医药大学第三临床医学院,浙江省针灸神经病学研究重点实验室,杭州 310053;2.浙江中医药大学基础医学院,杭州 310053;3.浙江中医药大学中医药科学研究院,杭州 310053)
复杂性区域疼痛综合征(complex regional pain syndrome,CRPS)是一种好发于身体局部区域,尤其是四肢,以疼痛为主要特征,并伴有感觉、运动、自主神经、血管、皮肤等异常改变的临床疼痛综合征[1]。CRPS可分为I型和II型:CRPS-I型没有明确的神经损伤,CRPS-II型则有明确的神经损伤[2]。手术、骨折、肢体创伤、缺血或神经损伤等常可导致CRPS-I发生。据流行病学统计,在某些骨折或脑卒中患者中,CRPS-I的发生率可达48.8%[3]。CRPS-I的疼痛症状是最影响患者的临床症状,往往导致患者身心遭受巨大折磨,严重影响患者的生活质量[4-5]。目前临床上常用于治疗CRPS-I疼痛的药物为非甾体类抗炎药、阿片类药物及抗抑郁药等[6-7]。然而这些药物的治疗效果局限,且长期服用会产生很多不良反应[8]。
目前人们对引发CRPS-I的机制尚不清楚,因此为了阐明其具体机制,Coderre等[9]于大鼠下肢近踝关节处套入O型橡胶圈进行加压3 h,形成缺血再灌注,从而引发慢性缺血痛模型(chronic post ischemia pain,CPIP)。CPIP模型成功模拟出类似于患者CRPS-I的两个阶段表现:即早期出现肢体的充血和水肿,随后出现慢性神经病理样疼痛[10]。目前此模型已经成为研究CRPS-I最为常用的动物模型之一。近期有研究发现CPIP模型局部脚掌炎症组织出现了氧化应激产物水平的升高,而利用抗氧化剂干预后则可显著缓解CPIP模型动物表现的疼痛症状[11-13]。上述研究提示,局部组织氧化应激反应在介导CPIP模型动物疼痛机制中具有重要作用。
针刺镇痛是我国传统中医疗法,具有悠久历史。目前针刺在临床上已经用于多种急慢性痛的治疗[14-15]。针刺镇痛具有良好疗效,且无毒副作用[16-17]。近期有证据显示,针刺在临床上对CRPS-I患者的疼痛症状具有良好的治疗作用[18-20]。然而目前针刺治疗CRPS-I疼痛症状的相关机制尚不明确。有研究显示针刺可有效抑制中枢脑区神经元缺血后所伴发的氧化应激反应水平的升高[21]。上述研究提示,针刺治疗CRPS-I疼痛的机制很有可能与其抑制局部组织发生的氧化应激反应有关。因此,本研究准备建立CPIP大鼠模型模拟CRPS-I,首先观察电针对CPIP大鼠模型疼痛症状的干预作用,并进一步研究电针对该模型大鼠局部脚掌组织中氧化应激反应的调控作用,从而探索电针治疗CRPS-I疼痛症状的内在机制,为电针在临床上治疗CRPS-I提供新的理论支支持。
1 材料与方法
1.1 材料
1.1.1 实验动物
6~8周龄清洁级SD雄性大鼠48只,体重220~250 g,购自中国科学院上海实验动物中心【SCXK(沪)2019-0016】,分笼饲养于浙江中医药大学实验动物中心【SYXK(浙)2019-0008】。饲养期间环境温度为20~22℃,12 h光暗循环,自由饮水,给予啮齿动物标准颗粒饲料。本实验所有实验程序均按照《国家卫生研究院实验动物护理和使用指南》(国家卫生研究院出版物第8023号,1978年修订)进行,并经浙江中医药大学动物伦理委员会批准(审批号:ZSLL-2017-183)。
1.1.2 实验试剂
小鼠单克隆抗DNA/RNA损伤抗体(美国,Abcam,生产货号:ab62623);驴抗小鼠荧光二抗(美国,Abcam,生产货号:ab150111,Alexa Fluor-647);戊巴比妥钠(北京岚秦化工科技有限公司,批号:201857-33-0);微量还原型谷胱甘肽测定试剂盒(南京建成生物工程研究所,货号:A006-2-1);SOD检测试剂盒(WST-1法,南京建成生物工程研究所,货号:A001-3-2);MDA测定试剂盒(TBA法,南京建成生物工程研究所,货号:A003-1-2);过氧化氢检测试剂盒(碧云天,货号:S0038)。其余试剂均为国产分析级纯。
1.1.3 实验仪器
纤毛机械刺激针(vonFrey触觉纤维丝,美国Stoelting公司),韩式穴位神经刺激仪(HANS-200 A,联创科技南京济生医疗科技有限公司),全能台式高速冷冻离心机(Sorvall Biofuge Stratos,美国Thermo Scientific公司),Thermo冰冻切片机(HM550,美国Thermo Scientific公司),激光共聚焦显微镜(型号:NiKON Elements AR,日本Nikon公司)。M4多功能酶标仪(SMP500-15956-JUHX,美国SoftMax公司),华佗牌一次性针灸针(0.18 mm×13 mm,苏州医疗用品厂有限公司)。
1.2 方法
1.2.1 分组
SD大鼠48只,随机数字表法均分为4组,每组12只,即假模型组,模型组,电针组,假电针组。
1.2.2 造模与电针干预在大鼠体重达310~320 g后进行模型制备。参照文献建立CPIP模型[9-10],3%戊巴比妥钠(0.15 mL/100 g)腹腔注射麻醉,75%乙醇对造模部位进行消毒。其后将内径为3.2 mm的O型橡胶圈套扎于大鼠右后足近踝关节处,于3 h后剪断O型圈。电针组和假电针组做相同处理。假模型组于相同部位套扎提前剪断的O型圈,其余处理均同其他组。
电针组:于造模后1 d进行电针干预,穴位参照全国中医药行业高等教育“十二五”规划教材《实验针灸学》(第9版)选择双侧“足三里”和“昆仑”穴,采用0.18 mm×13 mm一次性毫针,进针后连接“HANS-200 A韩氏穴位暨神经刺激仪”,治疗参数:治疗频率为2/100 Hz,刺激电流为0.5~1.5 mA(初始强度为0.5 mA,每隔10 min增加0.5 mA)共30 min,每天1次。
假电针组:进针时仅刺破皮层,不进入肌层,进针后连接“HANS-200 A韩氏穴位暨神经刺激仪”,但不开启即不通电的状态,治疗时间和针刺穴位与电针组相同。
1.2.3 行为学检测
采用机械缩爪阈值(paw withdraw threshold,PWT)检测大鼠造模前后以及电针干预后患侧足跖机械痛阈。将大鼠置于铁丝网上,其足部可暴露于铁丝网眼中,盖以透明的有机玻璃罩,适应环境安静30 min后(即停止梳理毛发和探索性活动),按照文献创建的Up and Down方法测定机械痛阈[22]。首先从4.0 g开始,将纤毛垂直刺向大鼠左后爪足底皮肤,稍用力,直至其弯曲成“S”形,注意避开足垫,若大鼠有缩足反射,则换小一号力量刺激丝,反之,则换大一号力量刺激丝,每次刺激持续时间最长5 s,测试间隔时间大于1 min。记录大鼠对不同力量刺激丝的一系列反应。若大鼠出现快速的缩足反射或舔足反应,则记为阳性反应,以“X”表示;若无反应,则视为阴性反应,以“O”表示,可得到一串以“O”或“X”组合的序列,以出现“X”的前一次“O”作为起点,选择包括该起点的6次连续刺激反应,如“OXOXOO”,作为推算50%机械缩足阈的关键序列,推算公式50%机械缩足阈(g)=(10[Xf+κδ])/10000,其中Xf为序列中最后一根vonFrey刺激丝的对数值;κ为根据测量所得“X”、“O”序列查表后得到的值,δ为各个刺激丝力度取对数后差值的平均值,在此约等于0.231。由公式推算50%机械缩足阈的值。
1.2.4 免疫荧光检测
每组选取5只大鼠麻醉后,开胸暴露心脏,经升主动脉快速灌注4℃生理盐水,其后迅速推注4%多聚甲醛约150 mL,再予4%多聚甲醛缓慢滴注15 min左右,待大鼠肢体僵硬,快速将大鼠右侧足底皮肤组织分离,放入含有4%多聚甲醛的EP管内,固定3 h,依次置于15%(24 h,沉底)、30%(48 h,沉底)蔗糖溶液中脱水,液氮速冻,-80℃保存。
免疫荧光法检测8-OHG(DNA/RNA氧化应激损伤标记物):取出-80℃保存备用的大鼠足底皮肤组织,行OCT包埋,冰冻切片(10μm),进行贴片。采用抗8-OHG抗体标记局部组织中发生氧化应激反应损伤的细胞。步骤:5%正常驴血清封闭37℃封闭1 h,勿洗,加入单克隆小鼠抗8-OHG抗体(含5%正常驴血清TBST稀释),4℃孵育过夜,清洗6次×10 min,加入驴抗小鼠荧光二抗(ab150111)37℃孵育1 h,避光,清洗6次×10 min,风干,采用抗荧光淬灭封片液封片。激光共聚焦显微镜在647 nm激光下进行拍摄。随后使用Image Pro Plus 5.0软件分析。
1.2.5 氧化应激相关分子检测
每组选取5只大鼠麻醉后,开胸暴露心脏,经升主动脉快速灌注4℃生理盐水,采集右后爪组织样品用于生化分析,按照试剂商制定的操作标准进行测定。准确称取组织重量,按重量∶体积=1∶9的比例,加入生理盐水制备组织匀浆,2500 r/min,离心10 min,取上清液待测。
还原型谷胱甘肽(GSH-Px)测定:按步骤加入检测试剂,混匀,静置5 min,通过多功能酶标仪420 nm波长处读数,报告的结果是每豪克蛋白质的GSH含量,单位为μmol/mg蛋白质。
超氧化物歧化酶(SOD)测定:根据试剂盒说明书,依次加入工作液与待测样本,置37℃恒温箱孵育20 min,采用多功能酶标仪在480 nm处读数,报告的结果是每毫克蛋白质SOD的活力,单位为U/mg蛋白质。
过氧化氢(H2O2)测定:根据试剂盒说明书,将工作液与待测样本充分混匀,通过多功能酶标仪在405 nm处读数测定,报告的结果是每毫克蛋白质的H2O2含量,单位为μmol/mg蛋白质。
丙二醛(MDA)测定:按说明书要求,首先将工作液与待测样本混匀,100℃加热15 min后,水浴冷却至室温,在室温下1000 r/min离心10 min,移取上清液加入96孔板中,采用多功能酶标仪在562 nm处读数,报告的结果是每毫克蛋白质MDA的含量,单位为μmol/mg蛋白质。用牛血清白蛋白作为标准,使所有生化测量标准化。
1.3 统计学分析
实验数据采用平均值±标准误(±s¯x)来表示,采用GraphPad prism 7进行统计分析。两组间比较采用独立样本Student’st检验,多组间比较采用单因素或双因素重复测量方差分析,组间比较,采用Tukey法检验。均以P<0.05视作差异具有统计学意义。
2 结果
2.1 CPIP模型大鼠患侧脚掌肿胀状态及机械痛变化情况观察
我们分别建立假模型组(Sham组)和CPIP模型组(CPIP组)。图1A显示大鼠在CPIP造模过程中,不同时间点患侧脚掌肿胀程度变化情况(如图1A箭头所示)。与Sham组相比,CPIP组大鼠侧肢体逐渐显示出进行性加重的肿胀,充血,甚至发绀。与Sham组相比,模后1 d脚掌肿胀程度最为显著,差异具有显著性(P<0.05)。肿胀持续1 d,在模后第2天出现逐渐消退,并恢复正常(图1B)。上述现象与以往文献报道和我们近期研究结果一致[9-10,23]。接下来继续观察CPIP组大鼠患侧脚掌机械痛变化情况。如图2A所示,两组大鼠机械痛在造模前差异不具有显著性。造模后,与Sham组相比,CPIP组大鼠50%机械缩爪阈值(50%PWTs)出现明显降低,差异具有显著性(P<0.01),且一直持续到观察的第10天。上述现象与以往文献报道一致[9-10,23],提示CPIP模型建立成功(图1,图2)。
2.2 电针对CPIP模型组大鼠机械痛过敏的治疗作用
我们分别建立了假模型组(Sham组)、CPIP模型组(CPIP组)、CPIP模型+电针组(CPIP+EA组)以及CPIP模型+假电针组(CPIP+Sham EA组)。图3A为造模时间、机械痛测定时间、电针治疗时间以及组织取材时间点的示意图。各组大鼠患侧机械痛于造模前差异不具有显著性。如图3B所示,造模后与Sham组相比,CPIP组大鼠50%PWTs出现降低,且持续到模后第10天,差异具有显著性(P<0.01)。经电针治疗后,CPIP+EA组大鼠50%PWTs相比CPIP+Sham EA组出现提升,且在观察期内,机械痛过敏现象出现了累计的缓解效应,且差异具有显著性(P<0.01)。结果提示,电针可有效缓解CPIP组大鼠机械痛过敏(图3)。
2.3 电针对CPIP模型大鼠患侧足底氧化应激反应干预作用
为了进一步探讨电针对CPIP大鼠患侧足底组织中氧化应激反应的影响,我们于造模后第10天收集各组大鼠患侧足底组织进行氧化应激分子检测,如表1所示,与Sham组相比,CPIP组大鼠患侧足底组织中超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH-Px)含量显著下降(P<0.01)。而氧化应激产物丙二醛(MDA)和过氧化氢(H2O2)含量出现明显上调(P<0.05或P<0.01)。这一结果提示,CPIP模型组大鼠患侧足底组织有明显氧化应激反应的发生。经电针治疗后,如表1所示,与CPIP+ShamEA组相比,CPIP+EA组大鼠患侧足底组织恢复了SOD和GSH-Px的耗竭,并恢复了局部组织中内源性抗氧化能力(P<0.01)。此外,经电针治疗可降低CPIP模型大鼠足底组织内氧化应激产物MDA和H2O2的生成(P<0.05或P<0.01)。上述结果提示,电针可有效降低CPIP模型组大鼠患侧足底组织中氧化应激反应水平(表1)。

图1 大鼠造模前后患侧足部状态变化图Note.A indicated the representative graphs of ipsilateral hind paw thickness before and after CPIP model establishment in rats.B indicated the changes of ipsilateral hind paw thickness at different time points before and after CPIP model establishment in rats.Compared with Sham group,∗P<0.05,n=5.Figure 1 Changes of ipsilateral hind paw thickness before and after CPIP model establishment
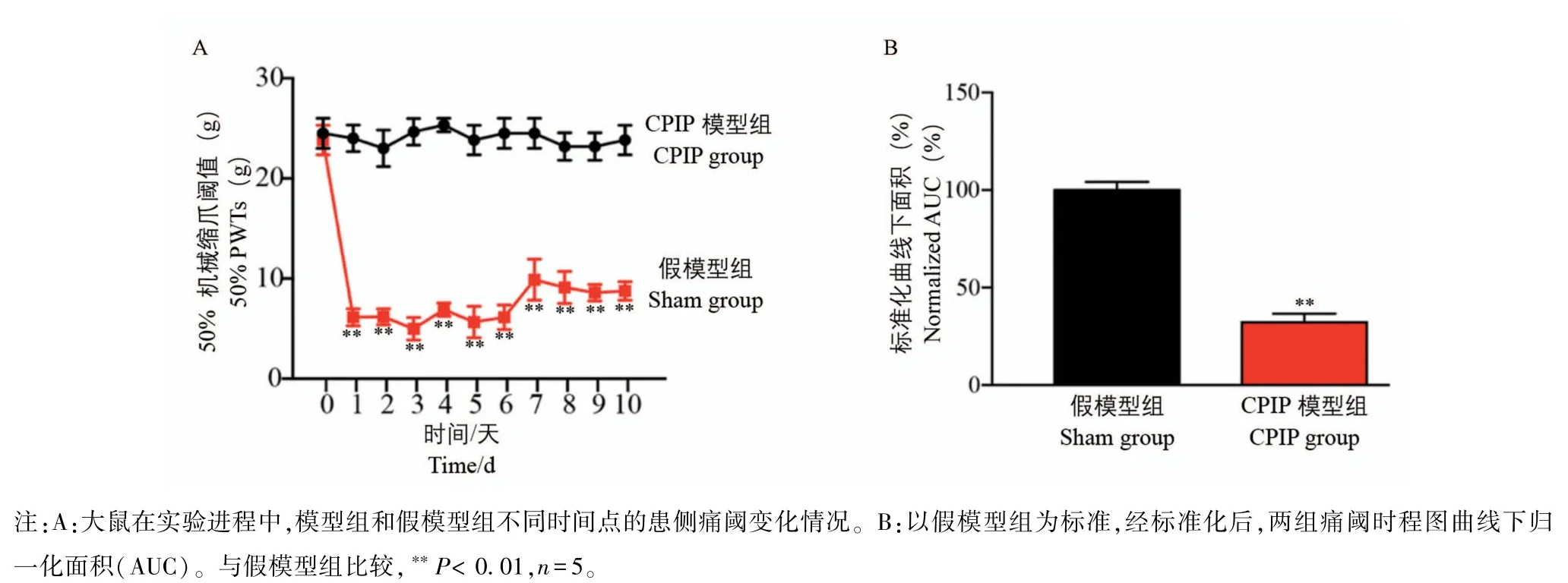
图2 CPIP模型组和假模型组患侧痛阈变化图Note.A indicated the ipsilateral pain threshold changes of the CPIP group and the Sham group at different time points during the experimental process.B indicated the normalized area under the pain threshold curve(AUC)of panel(A)and both groups were normalized with Sham group.Compared with Sham group,∗∗P<0.01,n=5.Figure 2 Ipsilateral pain threshold changes in CPIP group and Sham group
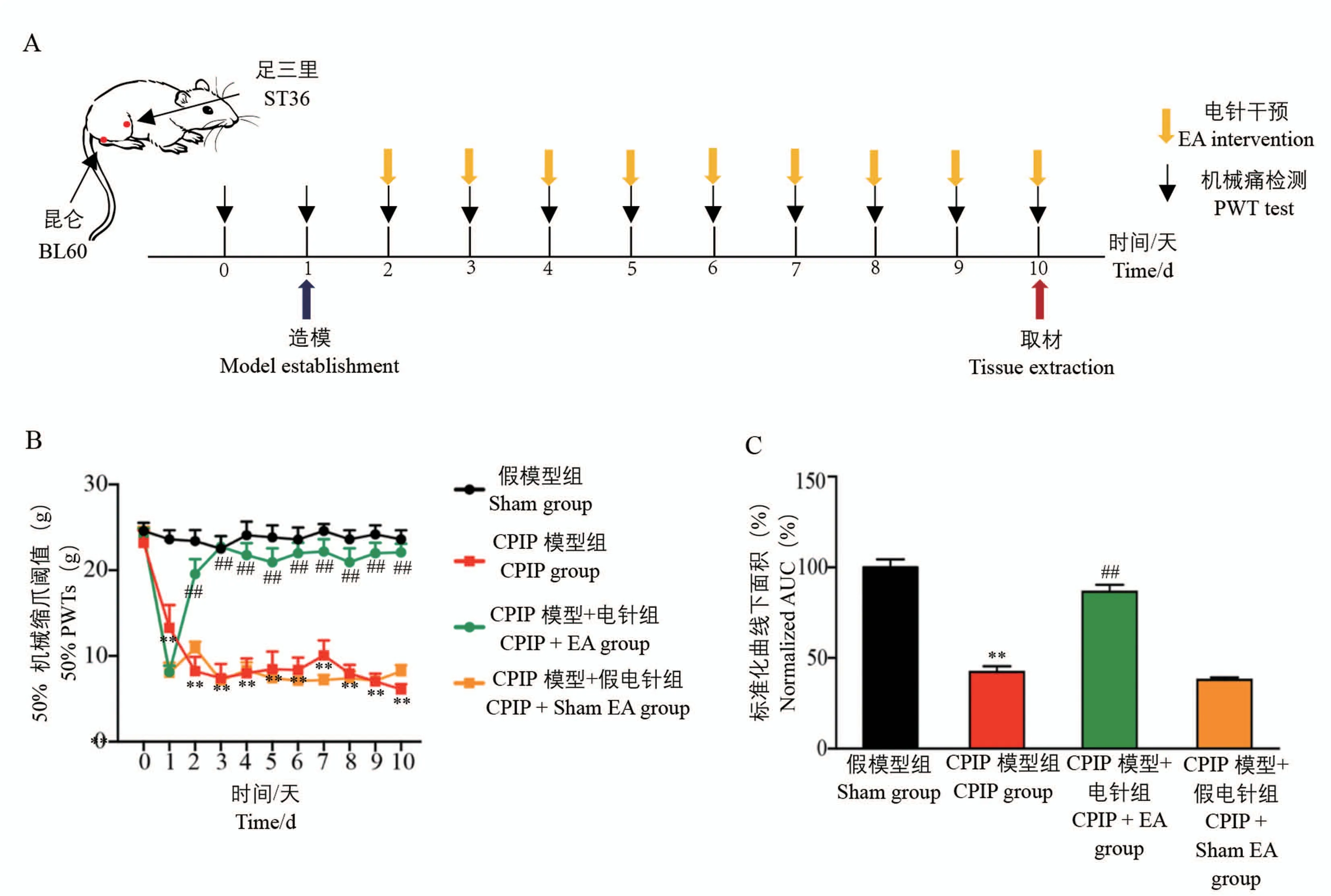
图3 各组大鼠患侧机械痛变化情况Note.A indicated the experimental scheme of EA intervention on CPIP rats model;B indicated the ipsilateral pain threshold changes of Sham group,CPIP group,CPIP+EA group,CPIP+Sham EA group before and after EA intervention.C indicated the normalized area under the ipsilateral pain threshold curve(AUC)of panel(B)and each group was normalized with Sham group.Compared with Sham group,∗∗P<0.01.Compared with CPIP+Sham EA group,##P<0.01,n=5.Figure 3 Changes of ipsilateral mechanical pain in rats of each group
2.4 电针对CPIP模型组大鼠患侧足底组织中细胞氧化应激损伤标记物8-羟基-鸟嘌呤(8-OHG)表达的干预作用
氧化应激损伤与炎症和疼痛反应密切相关,而8-OHG作为氧化应激损伤的标记物[21],因此我们进一步观察了大鼠患侧足底组织中8-OHG的表达。如图4A-B免疫荧光结果显示,与Sham组相比,CPIP组大鼠患侧足底组织中8-OHG免疫荧光强度明显增加(P<0.01),提示CPIP模型大鼠患侧足底组织伴有显著细胞氧化应激损伤发生。而经电针治疗后,与CPIP+Sham EA组相比,CPIP+EA组大鼠患侧足底组织中8-OHG表达出现显著下降(P<0.01)。上述结果提示,电针可以有效降低CPIP模型组大鼠患侧足底组织出现的细胞氧化应激损伤(图4)。
3 讨论
CRPS-I是一种好发于身体局部区域,尤其是四肢,以疼痛为主要特征,并伴有感觉、运动、自主神经、血管、皮肤和骨的异常改变的临床疼痛综合征。目前临床常用药物(包括非甾体抗炎药、阿片类药物等)治疗CRPS-I疼痛的效果有限,且长期服用往往导致严重不良反应发生,如胃肠道不适,肝肾功能损害,耐药性等[24]。因此寻找对CRPS-I有效且副作用小的疗法亟待解决。
众所周知,针刺作为我国一种传统中医疗法,具有悠久历史。目前众多基础和临床研究数据均证实[25-26],针刺可以作为一种治疗慢性痛的绿色有效手段,并且无毒副作用。因此针刺已经被世界上多个国家应用于慢性痛的临床治疗之中。近期有研究发现,针刺可以有效改善CRPS-I患者疼痛症状和肢体功能状态[27-28],提示针刺可以作为临床上治疗CRPS-I的有效疗法。
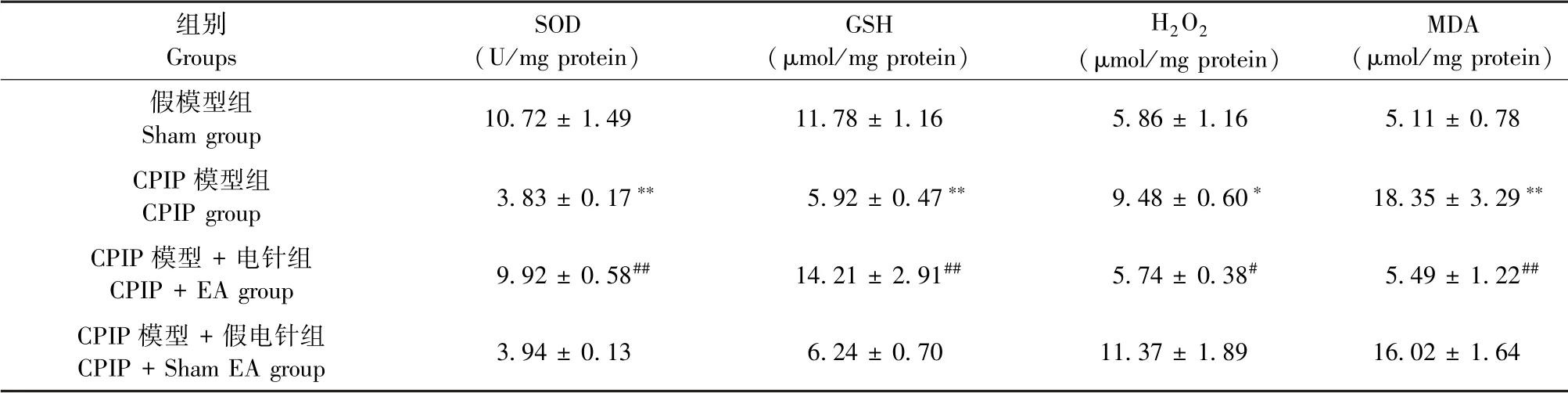
表1 各组大鼠患侧足底组织中氧化应激相关分子水平的变化(n=5)Table 1 Changes of oxidative stress related molecules in ipsilateral plantar tissues of rats in each group(n=5)

图4 各组大鼠患侧局部组织中氧化损伤标记物8-OHG表达水平Note.A indicated the representative immunostaining images of the ipsilateral hind paw tissue of Sham group,CPIP group,CPIP+EA group,CPIP+Sham EA group,and red fluorescence indicated the positive expression of 8-OHG.B indicated the mean fluorescence intensity of 8-OHGpositive expression of the ipsilateral hind paw tissue in each group.Compared with Sham group,∗∗P<0.01.Compared with CPIP+Sham EA group,##P<0.01,n=5.Figure 4 Expression level of oxidative damage marker 8-OHG in ipsilateral hind paw tissues of rats in each group
在本实验中,我们对针刺治疗CRPS-I的可能机制进行了探讨。我们首先成功建立了目前国际上比较公认可以模拟CRPS-I的动物模型,即CPIP大鼠模型。本课题组在前期研究中已经成功制备了该大鼠模型,因此为本实验模型的成功建立提供了可靠的技术支持和保障[9,23]。在本研究中,我们发现该CPIP模型大鼠患侧肢体表现出明显且持续的机械痛过敏症状。这一现象与以往报道及我们近期的研究结果相一致,因此提示模型的成功制备[24]。近期有研究发现CPIP模型动物局部脚掌组织有氧化应激产物水平的升高,而利用抗氧化剂阻断氧化应激反应,则可显著缓解CPIP模型动物表现的疼痛症状[13]。而氧化应激产物可通过进一步激活外周感觉神经元末梢所表达的痛敏感TRPA1离子通道,引发动作电位产生,从而产生疼痛信号[29-30]。我们的研究发现,CPIP模型大鼠足底组织中氧化应激反应水平显著升高,具体表现为抗氧化应激物质SOD和GSH水平下降以及氧化应激及脂质过氧化产物MDA和H2O2含量上升,并且细胞氧化应激损伤标记物8-OHG水平也出现显著上调。这一系列结果进一步肯定了CPIP模型大鼠患侧局部组织中确实有明显氧化应激反应发生。因此局部组织氧化应激反应在介导CPIP模型动物疼痛机制中参与重要作用。
在本研究中,我们发现电针可有效缓解CPIP模型大鼠机械痛过敏症状,这一发现与我们团队近期报道结果相一致[31]。我们进一步发现电针可有效提高CPIP模型大鼠患侧组织中抗氧化应激物质SOD和GSH水平,并下调氧化应激产物MDA和H2O2含量。而且电针还可以进一步降低局部组织中细胞氧化应激损伤标记物8-OHG表达水平。这一结果提示,电针可有效降低CPIP模型大鼠患侧组织中的氧化应激水平的升高。考虑到氧化应激反应及其产物在CPIP模型动物疼痛机制中参与了重要作用,因此我们推断,电针改善CRPS-I大鼠模型痛觉过敏症状的机制,很可能是通过抑制患侧局部炎症组织中氧化应激反应水平来实现。
在我们的研究中,采用进针时仅刺破皮层,不进入肌层,进针后连接电针仪,但不通电的方式作为假电针组的设置。这种假电针的设置方式可以验证电刺激所引发的镇痛效果,也是我们研究团队及其他一些同行所广泛使用的一种假电针对照方式[32-35]。但是这种假电针组的设置并不能有效验证由穴位特异性所发挥的效应,因此具有一定的局限性。目前,除了我们在本研究当中所采用的这种假电针组的设置方式之外,还有一些研究采用在非经非穴区域进行电针刺激,以作为假电针组的设置[36]。因此,在接下来的研究中,我们也将考虑采用这种假电针的设置方式来进一步验证穴位特异性在电针调控氧化应激以及镇痛效应中所发挥的作用。
综上所述,电针对CRPS-I大鼠模型痛觉过敏症状的治疗作用,很有可能与其对患侧局部组织氧化应激反应的调控有关。但电针干预CRPS-I氧化应激反应水平的具体机制还有待进一步阐明。这些研究将为针刺治疗CRPS-I痛症提供重要理论依据,并有助于进一步推动针刺作为一种“绿色疗法”应用于CRPS-I痛症的临床治疗。

