基于病理形态学系统综述探讨猪冠状动脉球囊损伤病变与动脉粥样硬化的差异
王达洋徐筱青赵明镜王显∗
(1.北京中医药大学东直门医院,北京 100700;2.中医内科学教育部重点实验室,北京 100700;3.北京中医药大学心血管病研究所,北京 100700)
目前,心血管疾病仍然是人类健康的头号杀手[1-2],而动脉粥样硬化(atherosclerosis,AS)是急性心肌梗死、卒中等多种高危心血管疾病的病理生理基础。构建AS动物模型(尤其是大动物模型)对于AS相关的研究具有重要的意义,而在这一方面已有诸多的探索[3-5]。
在已知的造模方法中,球囊损伤法在AS动物模型的构建中常用。小型猪由于其心脏大小、冠状动脉的结构和生理特征与人非常相似,因而通过球囊损伤小型猪冠状动脉制备AS模型是认可度很高的方法。球囊损伤法是一种血管内介入手术。其思路是通过球囊对目标位置血管内膜进行机械损伤,以模拟AS形成中“内皮损伤”的过程[6]。手术操作方法为:动物麻醉后,经颈动脉或股动脉穿刺并置入鞘管,将球囊经导丝置于目标血管处,以球囊/血管直径约1.3∶1的比例过度扩张,或往复拖拽数次[7-8],以达到损伤血管内皮细胞的目的。这一方法常和高脂饲喂联合使用,从机制上模拟人类AS的形成。早在20世纪70年代,这一方法初次被采用[9];在之后的数十年内,国内外已有多项研究采用这一方法[8,10-11];至今许多学者将其作为公认的造模方法。
球囊损伤法能够获得广泛的应用,更得益与其构建管腔狭窄的效率。在术后的数周至数月内,损伤部位即可出现高度的管腔狭窄[7,10];另一方面又可缩短昂贵的高脂饲喂所需的时间,从而极大节省了成本。此外,球囊损伤还可以“预定”斑块形成的位置,从而引起特定的器官慢性缺血,这是单纯高脂饲喂所不具备的优势。
然而球囊损伤法的上述优势使得其劣势逐渐被忽略。除手术、麻醉易造成动物死亡外,其主要的问题在于球囊损伤所构建“AS斑块”与真正的人AS斑块存在组成成分上的差异,而结构成分差异所反映出的机制上的差异则可能对基于这些模型的研究造成影响。这些差异难以通过冠脉造影发现,但通过病理学方法进行组织形态分析则可以对二者进行区分。
因此本研究拟通过对球囊拉伤法构建小型猪AS模型的文献进行检索,提取文中AS病变的病理图像信息进行分析,对比其与人自发形成AS斑块的差异,并探讨其形成机制及对科学研究的影响。
1 材料与方法
1.1 材料
研究对象为单独或联合使用球囊损伤法构建小型猪或普通家猪AS模型相关的实验研究,并对病理图像进行再评价。
1.2 方法
1.2.1 检索方法
以中国知网、万方、维普三大中文数据库及PubMed、Web of Science数据库作为资料来源。对“球囊损伤”、“动脉粥样硬化”、“模型”、“miniature swine”、“Balloon Injury”、“Atherosclerosis”等关键词进行检索,检索期限为建库至2020年4月14日。
1.2.2 文献筛选及标准
由2位研究者独立筛选文献并交叉核对,如有分歧则咨询第三方专家协助判断,如无法获得全文的与作者联系予以补充。
对于检索到的文献按照如下标准进行逐步筛选:(1)通过标题及摘要,排除所有重复文献及与构建AS模型无关的文献;(2)排除重复文献,获取全文并通读;(3)排除器官离体实验及细胞实验文献;(4)排除研究动物不为家猪或小型猪文献;(5)排除造模方法不为球囊损伤的文献;(6)排除未提供冠状动脉病理图像为的文献;(7)排除无法提供清晰彩色病理图像的文献;(8)排除未提供仅采用球囊损伤一种手术法的病变图像的研究;(9)排除同时合并其他除诱导高脂血症以外的干预方式的研究;(10)排除使用相同图像的文献。
1.2.3 资料提取
对最终筛选的文献进行资料提取,包括:(1)文献提供的病理图像(不包括联合其他手术法的图像,如支架、线圈、加热球囊、壁内注射等),并根据所提供的图像的特征进行重新描述;(2)手术与取材的时间间隔;(3)研究使用的动物品系;(4)研究采用的其他造模辅助方法。
1.2.4 病理学诊断标准
判断胶原纤维、蛋白聚糖和SMC参考以下诊断标准[12]:在Masson Trichrome染色(简称Masson染色)下胶原纤维蓝染,SMC红染;在Movat Pentachrome(Movat五色套染)染色下胶原纤维黄染,蛋白聚糖蓝-绿染,SMC红染;在Azan染色下,胶原纤维蓝色,肌纤维橘红-红染;Elastin Van Gieson(EVG)染色下胶原纤维红染;肌纤维呈黄染。对每张病理图片中AS斑块构成成分进行判断,分为“+”:肯定存在;“-”:肯定不存在;“+-”可能存在(病理特征不典型但不能排除);“○”:根据提供的切片及染色方法无法进行判断。
1.2.5 偏倚风险评价
使用SYRCLE动物实验偏倚风险评估工具[13]对纳入的文献进行偏倚风险的评价。
1.3 统计学分析
采用基于病理图像的文献系统评价方法。由于这一方法不能反映各项研究的权重,因此不进行数据合并Meta分析,仅对文献进行描述统计。
2 结果
2.1 文献筛选流程及结果
2.1.1 文献筛选结果
从五大数据库中共检索到文献878篇;去除重复文献139篇,剩余739篇;根据题目及摘要,去除与冠状动脉球囊成形术无关的文献489篇,剩余250篇;去除无法提供清晰彩色病理图像的文献180篇,剩余70篇;去除合并使用其他手术法(如壁内注射)或干预(如病毒转染)且未提供仅采用球囊损伤一种手术法和(或)仅采用高脂饲喂一种干预方法的病变彩色病理图像的文献32篇,剩余38篇。
2.1.2 纳入文献信息总览
在纳入的38篇文献中,中文3篇,英文35篇;取材时间为手术后2~52周,大部分文献为术后4周;10篇文献同时联用高脂饲喂法进行AS的造模,其余文献均采用单一的球囊损伤;仅有5篇文献采用单一的H&E染色,其余文献合并使用Masson、EVG、Movat五色套染、α-SMA免疫组化、天狼星红染色等方法中的一种或多种进行组织学染色。
2.2 各研究中病理图像组织形态学结果
2.2.1 球囊损伤病变与人类AS组织形态的相似性
在纳入的所有研究中,大多数研究提供的图像与人类AS病变在形态学上具有明显的差异。具体表现为:可见管腔狭窄,主要以新生内膜为主;内侧弹力版断裂,纤维帽及脂质核心不可见;新生内膜主要构成为平滑肌细胞(smooth muscle cell,SMC)及蛋白聚糖。仅有1项研究提供的图像类似于人类AS病变,达到AHA IV期;但与人类典型的晚期AS病变形态“成熟纤维帽覆盖有脂质核心”的特征相比仍有较大差异。
在纳入的所有38项研究提供的病理图像中,病变的形态学基本一致,即:管腔存在中至重度狭窄,狭窄主要由新生内膜引起;新生内膜处内侧弹力板可见断裂;纤维帽、坏死核心及细胞外脂质不可见。病理特征统计信息(表1)。
2.2.2 新生内膜的构成分析

表1 纳入研究的图像病理特征统计Table 1 Description of morphological features of images included
由于在H&E染色下新生内膜的成分难以区分,因此通过观察使用EVG、Masson、Movat五色套染的病理切片(34项研究),分析新生内膜的构成,结果提示新生内膜中平滑肌细胞、胶原纤维及蛋白聚糖均匀混合,胶原成分多于或少于中膜(使用中膜作为参照);蛋白聚糖成分显著多于胶原成分(表2)。

表2 新生内膜构成成分的分析Table 2 Analysis of structure of neointimal hyperplasia
2.2.3 新生内膜中胶原成分的分析
在纳入的研究中有4项研究采用了天狼星红染色,1项(Iso 2006)未进行偏振光检验,2项研究的病理图像显示新生内膜中胶原成分以III型胶原为主,1项显示以I型胶原为主。
2.2.4 高脂饲喂对球囊损伤后的病理形态特征的影响
在纳入的研究中共有10项研究采用联合高脂饲喂法构建AS模型,这些研究大多进行手术至取材的时间间隔较长。在这些研究中,除未提供完整血管横截面的2项研究外,其余均存在管腔狭窄,5项研究狭窄大于等于75%;有5项存在(或可能存在)胞外脂质沉积,2项存在(或可能存在)坏死核心,2项存在(或可能存在)纤维帽;1项类似于典型的AS病变(见表3)。
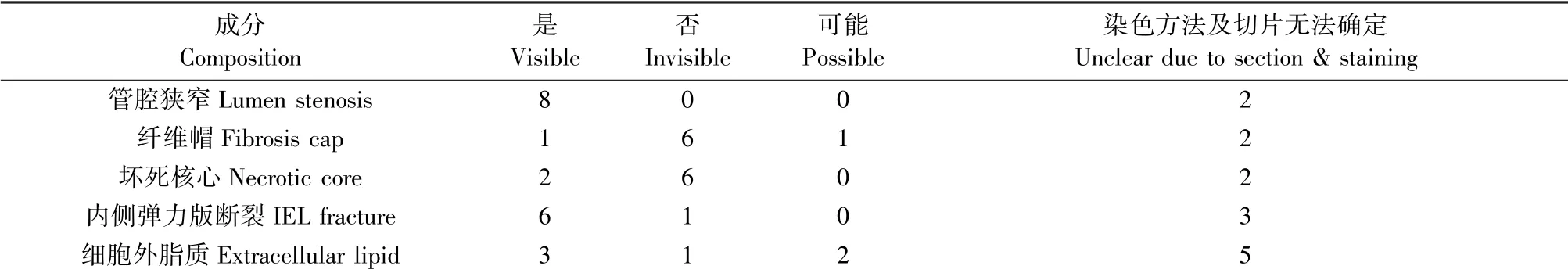
表3 高脂饲喂+球囊拉伤病理学特征统计Table 3 Description of morphological features of lesions induced by high-cholesterol diet&balloon injury
2.3 偏倚风险
所有研究均提及动物的随机分组,但未阐明具体方法,因此选择性偏倚为“不确定”;研究均未提及对研究者施盲,故实施偏倚为“不确定”;所有研究均对所有动物进行测量评估,但由于论文篇幅论文无法提供所有病理切片的图像,故测量偏倚为“不确定”;所有研究均未选择性报告结果,故不存在报告偏倚;33项研究采用单纯球囊损伤(或联合高脂饲喂)作为对照组,36项研究的研究目的非探索新生内膜的病理形态,因此发表偏倚风险较低。
3 讨论
3.1 球囊损伤病变与人类AS形态的差异
本研究认发现,由球囊损伤引起的冠状动脉病变具有以下形态学特征:血管内膜显著增生;增生内膜的主要成分为平滑肌细胞和蛋白聚糖,而胶原成分相对减少;内侧弹力板断裂常见;除非使用家族性高脂血症动物或长期高脂饲喂,否则难以见到脂质核心及纤维帽。
这一结果显著区别于临床中典型的AS。根据AS分类的AHA分期及分类标准,其结缔组织成分似III型病变,但其管腔狭窄达到V型病变程度;富含脂质的Va型病变是冠状动脉中最典型的病变,而这类病变很少见到脂质核心的形成;含脂质较少的Vc型病变主要由胶原纤维构成,又主要见于下肢动脉[14-15],而这一病变胶原成分相对较少。因此这类病变难以划分为AHA标准中的任何一类。
3.2 球囊损伤病变与AS机制的差异
球囊损伤病变并不符合典型的AS病变任一时期的特征,可能反映了这一病变在形成机制上与AS的差异。在所有纳入的病理图像中,97%切片均可见内侧弹力板(internal elastic lamina,IEL)断裂,由此猜想球囊损伤导致内膜增厚的主因是球囊拉伤引起的血管应力改变,导致中膜平滑肌细胞的表型转变,由收缩表型转变为增殖表型,由中膜迁移至内膜,大量增殖并分泌细胞外基质(其主要成分为蛋白聚糖);而冠状动脉作为弹力肌型动脉,其IEL相对薄弱,在球囊的过度扩张及拖拽下极易断裂,断裂的IEL又有助于活化的SMC迁移到内膜区;大量活化的SMC在内膜区域快速增殖,分泌细胞外基质,因此形成了以SMC及蛋白聚糖为主要成分的内膜增生,导致管腔高度狭窄。
球囊损伤病变缺乏脂质核心的原因在于:脂质核心主要由泡沫细胞崩解形成,而短期(数周)的高脂饲喂,在代谢正常的动物体内无法引起足够的脂质在管壁沉积,而长期(长达1至3年[16-17])高脂饲喂或使用患有脂类代谢异常遗传病的动物[7,11,18],则可以产生具有坏死核心的典型AS(AHA IV型)病变。
球囊损伤病变纤维帽少见的原因为:AS纤维帽的形成机制是被激活的SMC及成纤维细胞大量分泌胶原,随着炎症反应由斑块表面逐渐向深部发展,SMC崩解坏死而胶原纤维则沉积在斑块表面(即管腔一侧),但这一过程十分漫长;同时当沉积的胶原纤维出现侵蚀时可在侵蚀部位形成血栓,被机化后的血栓[14]及外源成纤维细胞[19]也参与了纤维帽的构成。而球囊损伤后短期内难以具备上述形成纤维帽形成的条件。但在一些长期的研究中可以见到胶原纤维向斑块表面沉积的趋势。
3.3 对科学研究的影响
构建AS动物模型的目的主要为机制研究、药理学研究、药效评价及介入器械评价。球囊损伤法构建的病变存在机制和形态学上的差异,对于上述研究可能会存在影响。比如,由于球囊损伤病变不存在细胞外脂质及坏死核心,而氧化低密度脂蛋白是AS形成中重要的致炎因素[20],球囊损伤病变的炎症水平可能远低于晚期AS,因此该模型可能不适用于AS形成的脂质机制研究。另一方面,由于球囊损伤模型的新生内膜主要由蛋白聚糖和SMC为主,与典型的冠状动脉粥样硬化斑块相比具有较高的韧度,在支架部署时更易发生贴壁不良,因此理论上具有更高程度的支架内再狭窄及支架血栓的发生率[21],从而可能对介入器械的评价造成一定的影响。因此将球囊损伤病变作为“AS”病变而进行研究,可能会对研究结果造成不可预测的偏差。
4 结论
球囊损伤导致的内膜增生形态学上的具体表现为:血管内膜显著增生;增生内膜的主要成分为平滑肌细胞和蛋白聚糖,而胶原成分相对减少;内侧弹力板断裂常见。这一特征与AS的“纤维帽覆盖脂质核心”的特征具有显著差异。两种病变形态上的差异反映出机制上的差异,以该模型作为AS模型应用于脂质机制研究及临床前评价应慎重。

