冠心病气虚血瘀证病证结合大鼠模型的建立研究
王瑾茜蔺晓源刘侃胡国恒∗
(1.湖南中医药大学第一附属医院,长沙 410007;2.湖南中医药大学,长沙 410208)
冠心病(coronary artery heart disease,CHD)是指因冠状动脉阻塞等原因导致心脏的血液灌注减少,从而引起心肌缺血缺氧、能量代谢失常的心血管疾病[1-2]。世界卫生组织(WHO)最新报道,因心血管疾病引发的死亡率占全球死亡的人数30%[3],严重影响了人类的健康。CHD在中医学归属“胸痹”“心痛”“真心痛”范畴,其中气虚血瘀证为胸痹最常见证型[4]。自2014年刘建勋等[5-6]提出“病证结合动物模型拟临床研究”概念后,CHD气虚血瘀证动物模型的研究已获得一定的进展。本研究中,主要对比现有的CHD气虚血瘀证病理模型、病因模型以及病理病因复合模型,通过分析各模型舌色RGB值、舌尖丝状乳头各层高度和固有层微血管数量,并且分析前列环素(prostacyclin,PGI2)、血栓素A2(thromboxaneA2,TXA2)在丝状乳头固有层表达情况,以期为CHD气虚血瘀证病证结合模型研究提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
16周龄SPF级健康雄性SD大鼠32只,体重(280±20)g,购于湖南斯莱克景达实验动物有限公司【SCXK(湘)2016-0003】。饲养于湖南中医药大学第一附属医院SPF级动物房【SYXK(湘)2015-0003】。实验动物饲养条件为:18~21℃,湿度保持40%~70%,环境空气控制为每分钟10次换气;保持每天12 h光照和12 h黑暗环境。本文涉及的实验动物,均经湖南中医药大学医学伦理委员会监管和批准实施(审批号:IACUC 2018659C)。
1.1.2 试剂与仪器
Tris(金克隆,T1503),辣根酶(博尔西,P105524),DAB显色液(Sigma,ab18799),PGI2免疫组化测定试剂盒(赛默飞,E21390),TXA2免疫组化测定试剂盒(赛默飞,B10710),Harris苏木素(中杉金桥,ZLI-9610),伊红(中杉金桥,ZLI-9660)。
Casmatch标准色卡(X-Rite,美国),NikonZ50(尼康,日本),光学显微镜(尼康,Nikon Eclipse E100,日本),TP-2200B型电子天平(湘仪,长沙),光学显微镜(Leica,德国),RM2125RTS型手动轮转式切片机(Leica,德国),BOND-MAX型全自动免疫组化染色机(Leica,德国)。
1.2 方法
1.2.1 动物分组及实验干预
大鼠适应性喂养1周后开始正式实验,根据体质量按完全随机数字表法随机分为4组:空白组(K组)、病理组(L组)、病因组(Y组)和复合因素组(F组),每组8只。除K组大鼠正常饲养外,各模型组大鼠造模方式如下:
(1)Y组[7]以中医“劳则气耗”、“饥则气损”为病因,于正式实验第1天进行力竭游泳造模,每次以大鼠沉入水中10 s,以头不能露出水平面为准。频率为每天1次,游泳后捞出实验大鼠,不予保温措施及擦拭水迹,关闭门窗任其暴露于空气中自然晾干。力竭游泳造模同时开始控制摄食量,大鼠每日摄入正常食量的1/2的饲料,连续21 d。
(2)L组[8]于正式实验第1~21天正常饲养,正式实验第22天制备病理模型:左前胸去毛,顺肋间隙方向于胸骨左旁第3~4肋间切开皮肤长约1 cm,切开心包,在左心耳前下方用1根零号医用缝合线结扎血管缝针,记录标准II导联心电图。以心电图ST段弓背向上太高的改变及左室前壁向外膨胀发绀、搏动减弱为结扎成功标志。术后腹腔注射青霉素每只8万U×3 d以抗感染。
(3)F组[9-11]于正式实验第1天时进行力竭游泳造模,造模方式同Y组,第22天开始复合病理模型,造模方式同L组。
造模结束后,各组大鼠恢复正常饮食、作息,期间不采用任何造模手段,以第25天上午8:00为统一观察、取材时间点。
1.2.2 舌色RGB值
于第25天上午8:00将各组麻醉后,置于手术台。用手术镊轻拉暴露整个舌面,照明条件参照国际照明委员会推荐照明标准,拍照距离设定为1500~2000勒克斯,拍摄模式设定为手动挡,自动对焦,光圈F8,关闭闪光灯,Casmatch标准色卡与舌面平行[12-13]。舌象色度分析采用Photoshop 6.0软件,参照Casmatch标准色卡说明书,设定色阶,黑色为L:22、a:0、b:0,灰色为L:58、a:0、b:0,白色为L:93、a:0、b:0。分析具体图片时,将黑、白、灰色阶值设置为图片标准色卡中的黑、白、灰色阶值。选择套圈工具,划定舌体范围(从舌尖到舌体中部),利用Photoshop 6.0软件中“直方图”工具,计算该区域的R(红色)、G(绿色)、B(蓝色)分量值,以表1作为辨别舌质依据[14]。
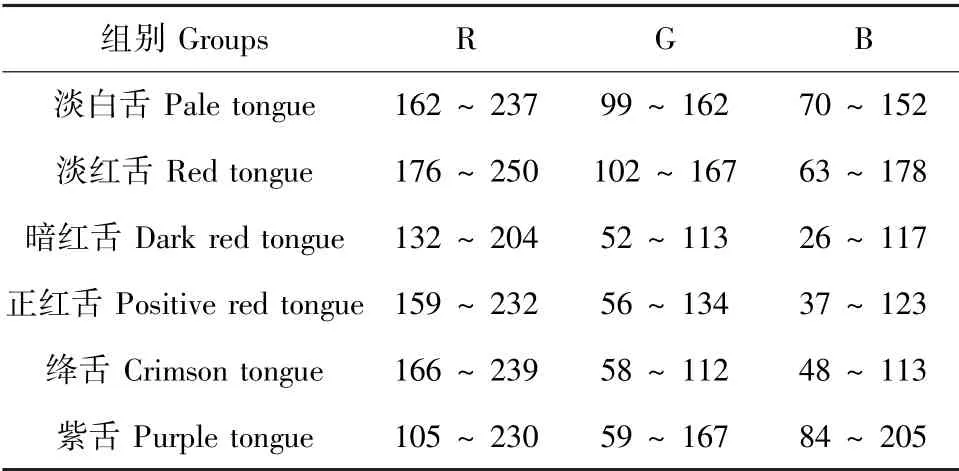
表1 RGB值数据分布范围表Table 1 RGB value data distribution range
1.2.3 HE染色观察舌尖丝状乳头各层高度与固有层毛细血管数量
拍照后立即取舌尖组织,直径约0.3 cm左右,投入预先配好的4%多聚甲醛中固定,以不同浓度的乙醇脱水,浸蜡,包埋,切成5μm厚薄片脱蜡,转染,苏木精,伊红染液染色5 min。在荧光显微镜高倍(×以树胶)视野下拍摄,并测算其角化层、固有层、上皮层高度,并统计固有层的毛细血管数量。具体实验操作参考文献[15]。
1.2.4 免疫组化观察舌尖组织TXA2、PGI2表达水平
石蜡切片脱蜡至水后,3%H2O2室温下孵育10 min,封闭非特异性抗原,滴加新配制的一抗TXA2、PGI2(1∶200稀释),4℃孵育过夜,洗涤后滴加辣根酶工作液,37℃恒温箱孵育30 min,洗涤后DAB显色3 min;复染,脱水,透明,封片。具体实验操作参考文献[15]。
1.3 统计学分析
采用统计学软件SPSS 22.0分析实验数据,根据不同的数据特点采用不同的检验法:计数资料采用χ2检验;计量资料以平均值±标准差(±s)表示,两组比较,如果满足正态及方差齐性,采用成组t检验,不满足者采用秩和检验,P<0.05为差异具有统计学意义。
2 结果
2.1 舌色RGB值
K组舌质辨别归属“淡红舌”,与K组大鼠比较,L组大鼠舌面R值下降且差异具有统计学意义(P<0.05),G值下降、B值上升但均不具有统计学意义,舌质辨别归属“暗红舌”;Y组大鼠舌面G、B值上升但均不具有统计学意义,R值下降且差异具有统计学意义(P<0.01),舌质辨别归属“淡白舌”;F组大鼠舌面R、G、B值下降且差异均有统计学意义(P<0.01,P<0.05),舌质辨别归属“紫舌”。与L组大鼠比较,Y组大鼠舌面R值下降,但差异未见统计学意义;F组大鼠舌面R、G、B值均下降,且差异具有统计学意义(P<0.01,P<0.05)(见图1)。
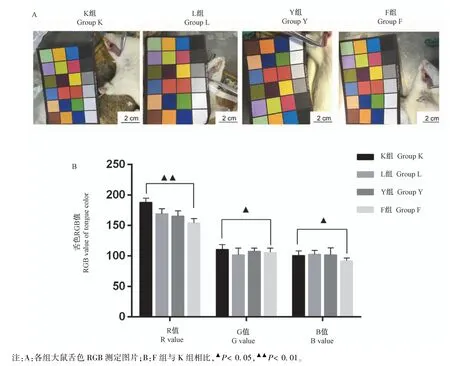
图1 各组大鼠舌色RGB值测定Note.A,Picture of RGB determination of tongue color of rats in each group.B,Compared with Group K,▲P<0.05,▲▲P<0.01.Figure 1 Determination of RGB value of tongue color in each group of rats
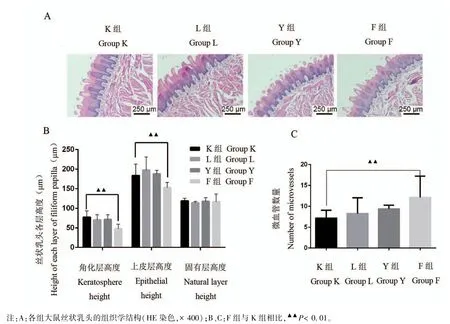
图2 各组大鼠丝状乳头形态与各层高度、毛细血管数量Note.A,Histological structure of filiform papilla in each group(HE staining,×400).B/C,Compared with Group K,▲▲P<0.01.Figure 2 Shape and height of each layer of rat’s filamentous papilla and the number of capillaries in each group
2.2 舌面丝状乳头各层高度、固有层毛细血管数量比较
与K组大鼠比较,L组大鼠舌面丝状乳头的角化层、固有层、上皮层高度降低,微血管数量增高,但差异均无统计学意义;Y组大鼠舌面角化层高度降低且有统计学意义(P<0.05),上皮层高度降低,固有层高度升高、微血管数量增高但均不具备统计学意义;F组大鼠舌面角化层、上皮层高度均降低、固有层微血管数量增高(P<0.01),固有层高度下降但不具备统计学意义。与L组大鼠比较,Y组大鼠舌面丝状乳头的角化层、上皮层高度降低,固有层高度增高、微血管数量降低但差异均无统计学意义;F组与L组比较,舌面丝状乳头的角化层、上皮层高度降低、固有层微血管数量增加(P<0.01),固有层高度差异不具备统计学意义(见图2)。
2.3 免疫组化观察舌尖组织TXA 2、PGI2表达水平
与K组比较,L组、Y组、F组PGI2水平均下降、TXA2水平均上升,其中仅L组、F组TXA2水平与K组比较差异具有统计学意义(P<0.01,P<0.05);L组、F组T/P值均升高且与K组比较差异具有统计学意义(P<0.01,P<0.05)。与L组比较,Y组PGI2、TXA2和T/P值较低,但差异均无统计学意义;F组与L组比较PGI2水平较低但差异不具有统计学意义(P>0.05),TXA2、T/P比值较高且差异具有统计学意义(P<0.05)(见图3)。
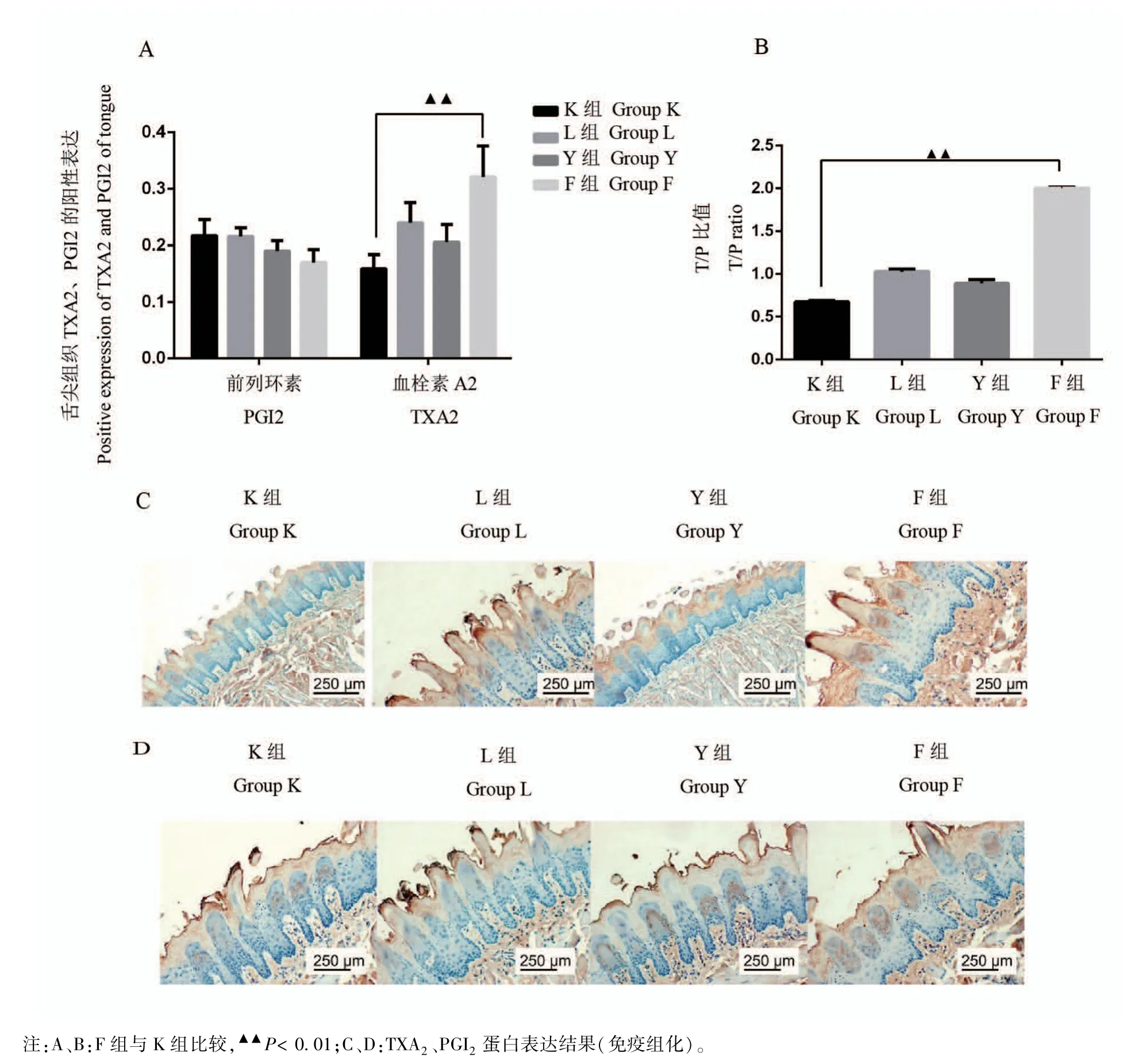
图3 各组大鼠舌尖组织TXA2、PGI2蛋白表达(A)、T/P比值(B)和TXA2、PGI2表达光镜图(C、D)Note.A/B,Group F compared with Group K,▲▲P<0.01.C/D,Protein expression results of TXA/PGI2(HE staining).Figure 3 Expression of TXA2 and PGI2 proteins in the tongue tip tissues of rats in each group(A),T/P ratio(B)and the light microscopy images of TXA2and PGI2expressions(C,D)
3 讨论
CHD在我国发病率呈逐年上升的趋势,目前主要药物治疗为口服阿司匹林和硝酸酯类药物以抗血小板聚集,但长期服用导致消化道出血症状及过敏反应等副作用[16]。CHD气虚血瘀证一直是中医领域研究的热点,中医学认为气虚血瘀是CHD的主要病机,气虚则无力推动血液运行,血液凝滞成瘀,阻于心脉,则心前区憋闷疼痛[17]。并认为舌与心关系密切,心开窍于舌,心功能正常则舌体红润柔软,形色正常[18]。通过观察对比3种常见CHD气虚血瘀证病证结合大鼠单纯病理、病因及复合因素造模方式下舌色RGB值、舌尖丝状乳头病理形态学变化以及TXA2、PGI2水平表达,探讨各模型舌象的特点,为CHD气虚血瘀证动物模型研究提供实验依据。
RGB值是一种国际公认的比色标准,在统一的照明标准、拍照距离、相机参数下,运用Photoshop 6.0软件计算出红色(R)、绿色(G)、蓝色(B)值可以更加客观化、数字化比较各组模型的舌体颜色变化。翁维良教授运用“中医舌诊专家系统”将各类舌质舌苔记录出不同的RGB值,还证明了RGB值不仅与舌苔颜色有关,还与舌苔厚薄等变化明显相关[19]。本研究发现与K组大鼠比较,L组大鼠舌面R值下降且差异具有统计学意义(P<0.05);Y组大鼠舌面R值下降且差异具有统计学意义(P<0.01);F组大鼠舌面R、G、B值下降且差异均有统计学意义(P<0.05)。本研究运用伍喜良课题组“舌质RGB数据分布范围表”发现,L组大鼠舌色归属于“暗红舌”、Y组大鼠舌色归属于“淡白舌”,而F组大鼠舌色归属于“紫舌”。参照2002年版《中药、天然药物治疗冠心病心绞痛的临床研究指导原则》笔者发现,L组符合“CHD血瘀证之暗红舌”、Y组符合“CHD气虚证之淡白舌”,而仅F组舌象与“CHD气虚血瘀证之舌淡紫”相吻合。RGB值反映L组模型更倾向于CHD血瘀证舌色,Y组模型更倾向于CHD气虚证舌色,病证结合模型相比其他两个模型组而言,更契合CHD气虚血瘀证舌色特征。
吴敏教授通过舌部热象图将舌划分为五个区域,分别对应中医藏象心(舌尖)、脾胃(舌中)、肝胆(舌左、右边)、肾(舌根)[20]。有研究报道丝状乳头遍布于舌体前2/3,是形成舌苔的一个重要的因素[21]。据此本研究推测CHD气虚血瘀舌象可能是由舌尖丝状乳头高度降低、微血管数量增高所致的外在观象。我们通过HE染色观察三种模型丝状乳头上皮层、角化层和固有层以及固有层的毛细血管数量。结果发现对比L组与K组,F组大鼠舌面丝状乳头的角化层、上皮层高度降低、固有层微血管数量增加(P<0.05),但各组丝状乳头固有层高度均无差异(P>0.05)。提示舌尖丝状乳头的病理改变与舌尖RGB数值改变存在一定关系,RGB数值相应的微观病理学改变主要体现在丝状乳头上皮层尤其是角化层高度以及固有层微血管数量的变化上,与固有层关系不大。且CHD气虚血瘀证舌象特征与舌面丝状乳头的角化层、上皮层高度降低、固有层微血管数量增加有关。
PGI2是花生四烯酸的一种衍生物,是血小板凝集作用的一种抑制剂。TXA2是由血小板微粒体合成并释放的一种具有强烈促进血管收缩和血小板聚集的生物活性物质[22]。正常情况下血液中TXA2和PGI2含量保持相对平衡的状态,可以防止聚集效应,使血管扩张,保持血管通畅。研究表明中医学中“气虚”与现代医学中PGI2合成减少、“血瘀”与TXA2增加有关[23-24]。在本实验中,我们对舌尖组织PGI2、TXA2水平进行免疫组化半定量分析发现,与K组比较,3种模型的舌尖丝状乳头固有层PGI2水平均下降、TXA2水平均上升,仅L组和F组TXA2水平变化明显(P<0.05,P<0.01),综合RGB值结果,推测血瘀证、气虚血瘀证形成与TXA2存在密切关联;L组、Y组、F组PGI2变化均不大,其原因考虑机体存在代偿性增加现象,由此得出T/P比例比单一指标更可靠;L组、F组T/P比值均升高(P<0.05,P<0.01),说明病证结合模型和疾病模型皆可导致机体血瘀证相关指标变化,而相较于单纯疾病模型,病证结合模型T/P比值变化更明显,说明气虚可在血瘀过程中引起血瘀严重化,进一步说明病理病因复合因素模型相较于单纯病理模型和病因模型而言更具气虚血瘀的特点。
综上所述,本研究通过对比病理、病因、病理病因复合3种常用的CHD气虚血瘀证动物模型造模方式舌象客观化研究。结果发现单纯病理模型和单纯病因造模方式无法达到CHD气虚血瘀证舌象特点,仅F组符合CHD气虚血瘀证“淡紫舌”的特点。此外,F组乳头层、角化层、上皮层高度均下降、微血管数量均增高,T/P比值均有明显改变,说明CHD气虚血瘀证舌色RGB值变化与丝状乳头上皮层、角化层高度降低,固有层毛细血管数量增加有关,其分子学机制可能与TXA2/PGI2失调有关,但TXA2/PGI2失调是否为CHD气虚血瘀的主导性分子生物学指标有待深入研究。

