鼻腔、鼻窦髓外浆细胞瘤DWI及CT能谱成像特点
段 斐 唐作华 齐 萌 洪汝建 郭林英 王 鹏 姚振威 冯晓源
浆细胞瘤是浆细胞疾病的罕见亚型,系浆细胞单克隆性异常增殖形成的恶性肿瘤,包括多发性骨髓瘤(multiple myeloma,MM)、孤立性骨浆细胞瘤(solitary plasmacytoma of bone,SPB)和髓外浆细胞瘤(extramedullary plasmacytoma,EMP)。髓外浆细胞瘤(extramedullary plasmacytoma,EMP)是指原发于骨髓造血组织以外的浆细胞肿瘤,约占浆细胞肿瘤的3%。约80%分布于头颈部富含淋巴组织的上呼吸道黏膜下,最常见的部位是鼻腔和鼻旁窦(80%)[1]。EMP的治疗方案有别于其他类别肿瘤,部分患者后期可转化为多发性骨髓瘤[2-3],因此,早期准确的术前诊断和鉴别诊断尤为重要[3]。鉴于该病发病罕见,术前误诊率高,笔者尚未发现有关鼻腔鼻窦EMP在能谱CT和弥散加权成像方面的统计学研究报道,本文回顾性分析7例鼻腔鼻窦EMP患者的临床及影像学资料,旨在探讨其ADC值和能谱CT成像在其诊断中的价值,提高对该病影像学特点的认识、减少误诊。
方 法
1.一般资料
回顾性分析2015-2019年7例经病理证实的鼻腔鼻窦EMP患者的临床和影像学资料,男4例, 女3例,年龄18~78岁,中位年龄55岁。排除标准:既往有穿刺活检、手术或放射/化学治疗病史,DWI图像伪影较重影响测量者。
2.检查方法
7例均 经MRI平扫及增强扫描,使用德国 Siemens 3.0T磁 共 振 仪(Magnetom Verio,Siemens Healthineers, Erlangen, Germany),12通道相控头线圈,常规扫描序列包括轴位TSE T1WI(TR/TE 450ms/9.1ms)、轴位TSE T2WI (TR/TE 4530ms/101ms)、冠 状 位 TSE T2WI(TR/TE 3590ms/92ms),及轴位和冠状位GRE抑脂T1WI 增强扫描。MR对比剂应用钆喷替酸葡甲胺(Gd-DTPA,浓度0.5mmol/ml,北陆药业,北京),静脉注射,剂量0.1mmol/kg。采用Siemens双源多排CT扫描仪(Somatom Definition Flash,Siemens Healthcare, Erlangen, Germany) 同时行静脉期能谱CT检查3例。扫描参数:A球管管电压80kVp,管电流461mA;B球 管 管 电 压140kVp,管电流178mA;螺距0.6,转速0.5, 探测器准直器为32×0.6mm,扫描野330mm×330mm,矩阵512×512。对比剂采用碘帕醇(320mg/ml),剂量为1ml/kg,生理盐水30ml,以4~5ml/s流率经肘静脉注入,延迟60秒进行静脉期扫描。
3. 图像分析
西门子3.0T磁共振(Verio, Siemens,Erlangen, Germany)后处理自带软件进行分析,参考常规T1WI、T2WI及DWI,去除病变的最上和最下层,于其余3个最大层面手动绘制圆形感兴趣区(region of interest, ROI),面积为20~30mm2,分别测量每个ROI内的ADC值后取平均值,测量时注意避开坏死、囊变、出血区及病变边缘。能谱CT增强所得数据传至Siemens多功能图像后处理工作站(syngo multimodality workplace,MMWP),通过 Monoenergrtic程序进行能谱分析,于横断位肿块实性成分最大层面勾画圆形感兴趣区(region of interest,ROI),约20~50mm2, 避开坏死及囊变区域,画出ROI后,系统自动绘制其能谱曲线。取60keV及180keV 2点连线画一条直线来计算能谱曲线斜率K,斜率K[4]= (60 keV CT值-180keV CT值)/100,评估衰减趋势,K为正值为“下降型”曲线,反之则为“上升型”。计算能谱曲线斜率:K= 60keV CT值-180 keV CT值/100,K为正值为下降型曲线,反之则为上升型曲线。
结 果
本组7例EMP的一般资料和MRI表现见表1。病变均呈单发实性肿物表现,病变主体位于鼻腔1例,上颌窦2例,额窦1例,鼻腔和筛窦2例,多个鼻腔鼻窦1例,不同程度侵犯周围结构(眼眶受累6例,颞下窝、面颧部及齿槽突受累2例,颅前窝受累2例,颅中窝及鼻咽腔受累各1例)。与脑实质相比,MRI表现为等信号(图1A),部分病灶T2WI见散在细条状略高信号(3/7,图1B),部分病灶周围/病灶内见多发流空血管穿行(6/7,图1B、1C);增强后病灶均呈明显强化(图1E、1F,图2B,图3B),均匀(1/8)或伴微小囊变灶(4/7,图1),部分病灶内可见强化更明显的分隔、对应T2WI稍高信号(3/7、图1B、1D、1E);肿瘤实性部分DWI弥散受限,ADC图呈低信号(图1D),ADC范围为(0.37~0.69)×103mm2/s,平 均 值为(0.55±0.09)×103mm2/s。颈部及咽旁淋巴结肿大1例(1/7),3例与周围软组织有较清晰边界,4例局部边界欠清。
EMP静脉期60~180 keV范围内的单能量CT值、碘浓度值及曲线斜率见表2及图3B~D。在60~180 keV范围内,随着单能keV值的升高,EMP对应的CT 值逐渐递减,且keV值越高,CT值降低的幅度越小,其能谱曲线在60~180 keV均呈下降型(图3D),能谱曲线斜率平均值为1.01±0.21,静脉期碘图所示碘浓度平均值为(2.7±0.55)mg/L(图3C)。
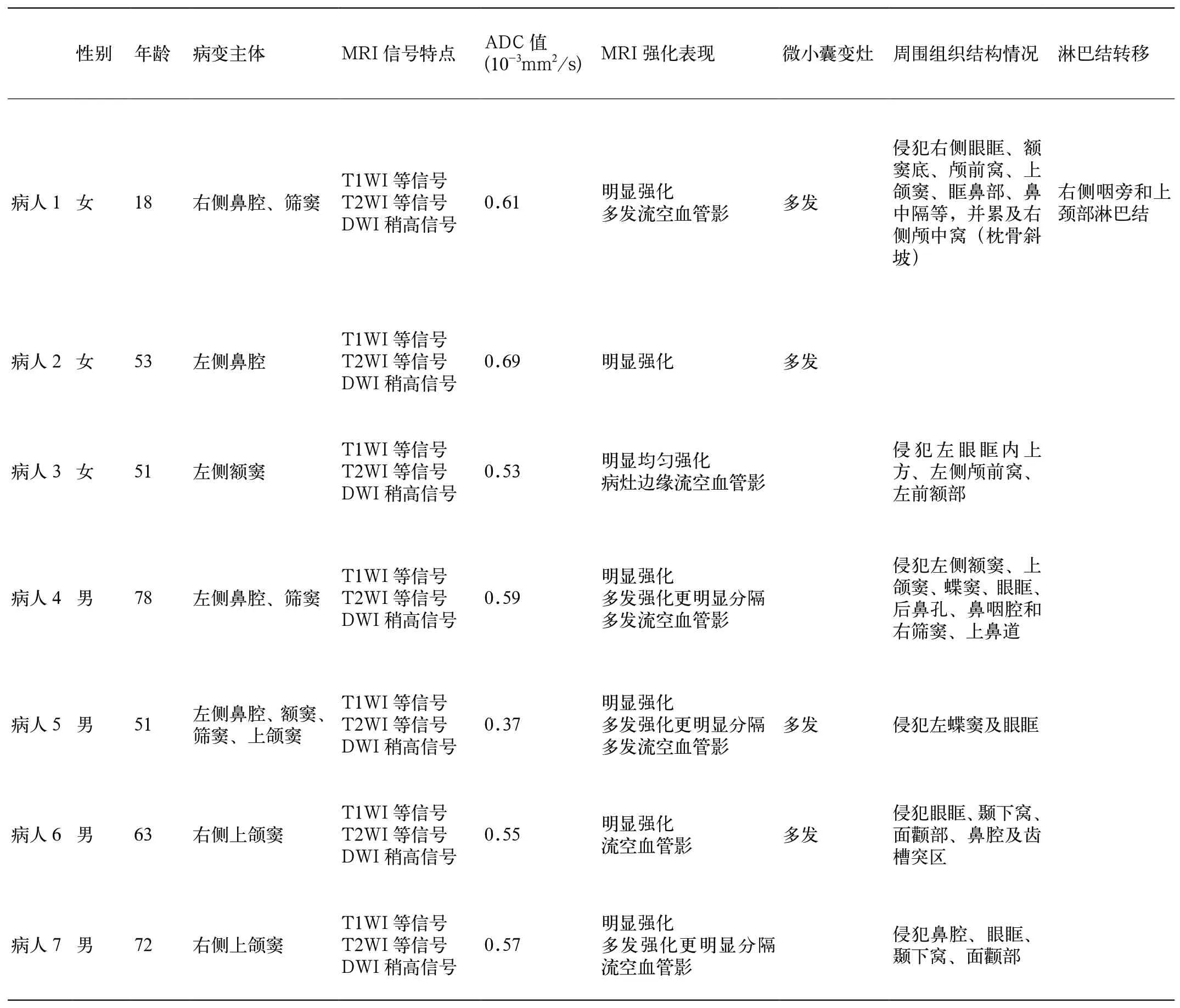
表1 EMP的一般资料和MRI表现

图1 男性,51岁。轴位T1WI、T2WI及冠状位T2WI (A~C),示左侧鼻腔、额窦、筛窦、上颌窦区弥漫软组织肿块,左侧蝶窦稍受累,肿块侵犯左侧眼眶内侧及眶底,边界尚清;T1WI呈等信号(A),T2WI等信号并伴多发稍高信号分隔(B,粗箭),病灶周边/内部可见流空血管穿行(B,C,细箭),信号相对均匀;轴位DWI(b=1000s/mm2)示病灶扩散受限呈高信号, ADC图呈低信号 (D),平均ADC值为0.37×10-3mm2/s;T1WI增强呈明显强化,内见多发强化更明显的线状分隔 (E,粗箭),对应T2WI稍高信号(B,粗箭)。图2 女性,18岁。轴位CT骨窗(A),右侧眼眶内侧壁、筛窦壁膨胀性溶骨性骨质破坏,骨质破坏区多发条形残存骨质,形成 “多房状”外观,而周围骨皮质受吸收变薄、断断续续,可见弧形压迹。轴位MRI T1WI增强示该肿块明显强化,病灶周边/内部多发低信号流空血管影(B,细箭)。图3 轴位CT骨窗(A),示上颌窦窦壁溶骨性骨质破坏,骨质破坏区多发条形残存骨质,形成 “多房状”外观,前壁骨质呈虫噬样外观 (A,细箭)。 静脉期单能量(B)70keV下CT值为105.8HU,碘浓度值为2.8mg/ml(C),静脉期病变能谱曲线呈下降型(D),能谱曲线的横坐标为X线单能量(keV),纵坐标为CT值(HU),白线为病变对应的能谱曲线,蓝线代表对比噪声比曲线。

表2 EMP在静脉期 60~180 keV 的平均 CT 值(HU)、静脉期碘浓度值及能谱曲线斜率(K)
CT横断面骨窗上3例均表现为膨胀性溶骨性骨质破坏,骨质破坏区多发条形残存骨质,形成“多房状”外观,而周围骨皮质受吸收变薄、断断续续,局部可见弧形压迹 (图2A,3A),其中1例局部呈虫噬样骨质破坏(图3A)。
讨 论
浆细胞瘤是发生于骨髓造血组织以外罕见的恶性软组织肿瘤。约80%的EMP发生于头颈部,近2/3发生于鼻窦区域,最常累及鼻腔(40.6%),其次是上颌窦(15.5%),再其次是筛窦、蝶窦、额窦。该病可发生于任何年龄段,但多见于40 岁以上男性,50~70岁好发,约10%~20%的患者出现颈部淋巴结转移[1],本组病例特点与文献报道基本一致。
MRI能较准确地显示病变的大小、性质和浸润范围,常用于EMP的诊断和分期。该病影像上多表现为与脑灰质相似的均匀中等信号或“大病灶,小坏死”,增强后中-明显程度强化,该组病例影像特点与文献报道基本一致。有文献报道,部分病灶内可见强化更明显的间隔,对应组织学上血管丰富的疏松间质结构,可能为本病较特征的影像表现[5],但本组仅3例表现出该征象。本组多数病灶周围/内部见多发流空血管(6/7),提示肿瘤血管丰富,与血管源性肿瘤有相似表现。由此可见,EMP的常规MRI表现有一定特征,但缺乏特异性,且其是否有助于定性诊断尚待研究。DWI可以反映不同病变水分子的扩散运动,通过测量ADC值得到定量参数,近年来已广泛运用于头颈部/鼻腔鼻窦实性肿瘤的诊断。Wang等[6]和Srinivasan等[7]分 别 推 荐1.22×10-3mm2/s和1.3×10-3mm2/s为预测头颈部良、恶性肿瘤的ADC阈值。Razek等[8]报道以ADC值为1.53×10-3mm2/s作为鉴别鼻腔鼻窦良恶性病变的阈值,其准确率高达93%。王永哲等[9]报道鼻腔鼻窦血管源性肿块的ADC值平均值为(1.68±0.49)×10-3mm2/s。Wang等[10]报道鼻腔鼻窦鳞癌和腺样囊腺癌平均ADC值分别为(1.09±0.29)×10-3mm2/s和(0.88±0.17)×10-3mm2/s。笔者所得EMP的ADC值均显著低于以上诊断阈值,提示ADC值对EMP的定性诊断和鉴别诊断有重要价值。
双源CT可将含碘物质从组织中分离出来,经图像后处理获得碘图及能谱曲线图,通过定量分析能更加准确地反映组织的强化程度、评价反映病变区域微血流灌注情况,目前尚未见期于EMP的相关报道。EMP和淋巴瘤治疗及预后不同,但常有较多的影像重叠,如两者均可表现为弥漫性生长,中等程度强化,无或少量坏死,可包绕血管生长,ADC值较低,此时,依靠常规MRI和ADC值难以对两者进行准确的鉴别。本组3例EMP的能谱曲线均为“下降型”,曲线斜率平均值为1.01±0.21,明显大于淋巴瘤(0.47±0.09)[4],可能由于此两种病变的病理特点不同,如EMP是由不同分化程度的肿瘤性浆细胞组成,排列紧密,呈结节状分布或弥漫性增生,肿瘤间质血管丰富,EMP组织灌注高,血管通透性高,而淋巴瘤为各种淋巴细胞、淋巴母细胞不同程度增生以及不同小细胞及大细胞浸润,细胞间排列致密,血窦不丰富,从而导致两者的碘浓度不同,对X线的衰减程度亦不一样,而碘对比剂又增强了两者质量吸收系数的差别,从而导致两者两条能量衰减曲线斜率不一致。由此可见,能谱CT可能为两者的鉴别诊断提供了新的思路,但由于本组病例较少,有待进一步研究它们的临床应用价值。本组3例病灶于CT横断面骨窗上均表现为膨胀性溶骨性骨质破坏,骨质破坏区多发条形残存较厚骨质,形成“多房状”外观,周围骨皮质吸收变薄、断断续续,局部可见弧形压迹,提示该病灶生长速度较慢及低侵袭性,这与EMP属低度恶性肿瘤的性质相符;1例骨质破坏区同时可见虫蚀样改变,提示病变较活动,对骨侵蚀较快;本组这2种不同的骨质破坏表现提示该肿瘤的生长方式可快可慢。鳞癌及ADC值较低的恶性黑色素瘤、横纹肌肉瘤也可表现为明显溶骨性骨质破坏,部分淋巴瘤可表现为周围骨质溶骨样、虫蚀样骨质破坏,但均极少出现“多房状”改变,此点可用于鉴别诊断。
本组病例研究存在一定局限性:①由于该病发病率极低,样本量较小,还需加大样本量观察;②由于术中肿瘤可能会成为碎块,DWI所选择的ROI未与病理标本一一对应。
综上所述,笔者认为鼻腔鼻窦EMP具有一定的影像学特征。病灶周围/内部多发流空血管影及强化更明显分隔,骨质破坏区多发较厚残存条形骨质,形成“多房状”外观;DWI弥散明显受限,ADC值较良性病变、上皮来源及血管源性恶性肿瘤、腺样囊腺癌值明显低,有助于鉴别诊断;能谱CT成像可能为EMP和淋巴瘤的诊断和鉴别诊断提供了新的思路,其临床应用价值仍需进一步研究。

