精氨酸对尼罗罗非鱼肝细胞多胺代谢途径相关基因表达的影响
■程炜轩 许国焕 张 丽* 李 薇 印遇龙
(1.广东省科学院微生物研究所,广东广州510070;2.广东省菌种保藏与应用重点实验室,广东广州510070;3.广东省微生物应用新技术公共实验室,广东广州510070;4.华南应用微生物国家重点实验室,广东广州510070;5.广东碧德生物科技有限公司,广东广州510663)
对于鱼类,精氨酸是必需氨基酸之一,在体内参与体内蛋白质的合成、尿素循环、肌酸(creatine)、多胺(polyamines)及一氧化氮(nitric oxide,NO)的合成。在鱼类生长、心血管、内分泌、免疫等方面起着重要作用,且能促使多个脂解基因表达量增加[1]。精氨酸对鱼类脂肪的调节途径目前报道的有两条途径,其中一条是一氧化氮途径[2],另外一条是在大西洋鲑中发现的多胺途径[3]。有研究指出,哺乳类动物同时具有这两条途径,而且这两条途径在动物某些细胞,如人内皮细胞分化中起着竞争性的相互抑制作用[4]。
动物体内的多胺按来源可分为内源性多胺和外源性多胺,外源性多胺来源于母乳和饲料,内源性多胺主要由动物体组织自身合成,能够与DNA 和RNA结合,从而影响转录和翻译,对于细胞生长和分化以及线粒体功能和完整性至关重要[3]。其体内合成主要通过鸟氨酸脱羧酶(ornithine decarboxylase, ODC)、亚精胺合成酶以及精氨酸合成酶三步酶促反应转变而成。另外,多胺可以影响肉碱棕榈酰转移酶-1 (CPT1)的活性,该酶是长链脂肪酸β氧化的限速酶[5],乙酰辅酶A羧化酶(Acetyl CoA carboxylase,ACC)催化生物体内由乙酰辅酶A 转变成丙二酰辅酶A 的化学反应。制约着脂肪酸合成第一阶段的速度。而脂肪酸合成酶(Fatty acid synthase, FAS)催化乙酰辅酶A 以及丙二酰辅酶A合成脂肪酸,是体内脂肪合成的关键酶[6]。
尼罗罗非鱼是我国重要的经济养殖鱼类,但是多胺途径对于脂肪的调节作用以及与一氧化氮途径的关系尚不明确。本研究用定量RT-PCR 方法检测不同浓度精氨酸培养基孵育尼罗罗非鱼肝细胞,并在孵育培养基中添加一氧化氮酶抑制剂及ODC 酶抑制剂,检测多胺途径相关基因ODC、SSAT、CPT1 以及ACC、FAS 两个在脂肪酸合成起关键作用基因的影响。以期揭示精氨酸对尼罗罗非鱼肝脏细胞多胺及脂肪酸代谢的影响以及多胺与一氧化氮途径在调控脂肪代谢过程中是否存在相互干扰。为精氨酸通过多胺途径调节脂肪代谢研究提供基础参考资料。
1 材料与方法
1.1 实验材料
实验鱼购于广东省罗非鱼良种场(广州市番禺区大稳村),购回的罗非鱼用普通商品饲料定时定量投喂,水温(30±1) ℃,pH 值7.0,溶解氧8.0 mg/l 以上,氨氮浓度小于0.2 mg/l,一天投喂3次,投喂量为饱食量80%,饲养2 周以上,取3 尾尼罗罗非鱼,体重为(150.98±2.13) g,进行肝脏细胞培养实验。
1.2 肝脏细胞分离与RNA提取
饲喂后6 h,用MS222 麻醉罗非鱼,使用胰蛋白酶消化法分别分离每尾鱼的肝脏细胞[7],混合后使用PBS 洗3 次后,将颗粒状细胞悬浮在L-15 培养基内,28 ℃,5% CO2孵育过夜后,置于24 孔板中准备实验。所有L-15 培养基均加入了10%胎牛血清(cat#14-801F),50 U/ml 青 霉 素/链 霉 素(cat#17-602E)和2% GlutamaxTM100×(cat#35056)。
在24 孔板内,将每孔细胞稀释至8×106个/cm2,28 ℃孵育24 h,细胞贴壁后,换新鲜培养基,实测精氨酸浓度为1.79 mM,另外配置高精氨酸含量培养基,在原培养基基础上加入L-精氨酸(A8094),使精氨酸终浓度为3.60 mM。精氨酸测定方法与之前的研究相同[8]。每组28 ℃孵育24 h后,进行以下处理,分出2组维持原培养基,记为LA 组与HA 组,分出2 组分别在LA 组及HA 的培养基基础上加入1 mM ODC 酶抑制剂二氟甲鸟氨酸(DFMO),记为DFMO-LA组与DFMO-HA 组,另外2 组分别在LA 组及HA 的培养基基础上加入100 μΜ一氧化氮酶活抑制剂(L-NMMA),记为L-NMMA-LA 组与L-NMMA-HA 组,每组6 孔,28 ℃孵育24 h后,细胞用胰蛋白酶消化,待细胞完全溶解后,于冷冻离心机中2 200 r/min 离心5 min。然后将沉淀溶解在RNA later 中,-80 ℃保存。使用RNeasy Plus Mini kit(Germany)试剂盒提取RNA。
1.3 cDNA第一链合成与荧光定量PCR
逆转录过程则使用TaqMan Gold RT-PCR Kit(USA)试剂盒,取500 ng RNA 按以下程序进行:25 ℃10 min,60 ℃48 min,95 ℃5 min,得到的cDNA-20 ℃保存,荧光定量PCR 则使用实时荧光定量仪Lightcycler 480(Switzerland),按以下程序测定:以β-Actin作为参照基因,使用相应引物(表1),按照以下程序:95 ℃5 min,然后95 ℃10 s,60 ℃20 s,72 ℃30 s一个循环,共45个循环。完成后数据的处理按以下方法进行。

表1 RT-PCR所用引物
1.4 数据统计与分析
采用ΔCt 法进行目标基因荧光定量分析;应用SPSS 11.5软件对获得的实验数据进行单因素方差分析(one-way ANOVA)和Duncan's 多重比较,所有数据以“平均值±SD”来表示,P<0.05时表示差异显著。
2 结果与分析
2.1 不同处理对尼罗罗非鱼肝脏细胞ODC基因表达量的影响(见图1)
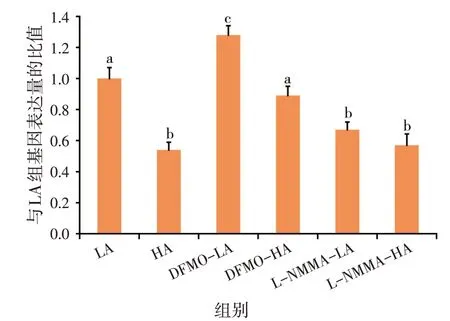
图1 各处理对尼罗罗非鱼肝细胞ODC基因表达量的影响
由图1 可知,与LA 组相比,DFMO-LA 组基因表达量显著升高(P<0.05),L-NMMA-LA组与HA基因表达量显著降低(P<0.05)。与HA 组相比,DFMO-HA 组基因表达量显著升高(P<0.05),而L-NMMA-HA 组无显著性差异(P>0.05)。
2.2 不同处理对尼罗罗非鱼肝脏细胞SSAT 基因表达量的影响(见图2)

图2 各处理对尼罗罗非鱼肝细胞SSAT基因表达量的影响
由图2 可知,与LA 组相比,DFMO-LA 组基因表达量显著降低(P<0.05),而L-NMMA-LA 组基因表达量显著升高(P<0.05),HA组基因表达量无显著性差异(P>0.05)。与HA 组相比,DFMO-HA 组基因表达量降低但无显著性差异(P>0.05),而L-NMMA-HA 组基因表达量显著升高(P<0.05)。
2.3 不同处理对尼罗罗非鱼肝脏细胞CPT-1基因表达量的影响(见图3)

图3 各处理对尼罗罗非鱼肝细胞CPT-1基因表达量的影响
由图3 可知,与LA 组相比,L-NMMA-LA 组基因表达量显著降低(P<0.05),而HA 组与DFMO-LA 组则无显著性差异(P>0.05)。与HA 组相比,L-NMMAHA组基因表达量显著降低(P<0.05),而DFMO-HA组则无显著性差异(P>0.05)。
2.4 不同处理对尼罗罗非鱼肝脏细胞ACC与FAS基因表达量的影响(见图4)
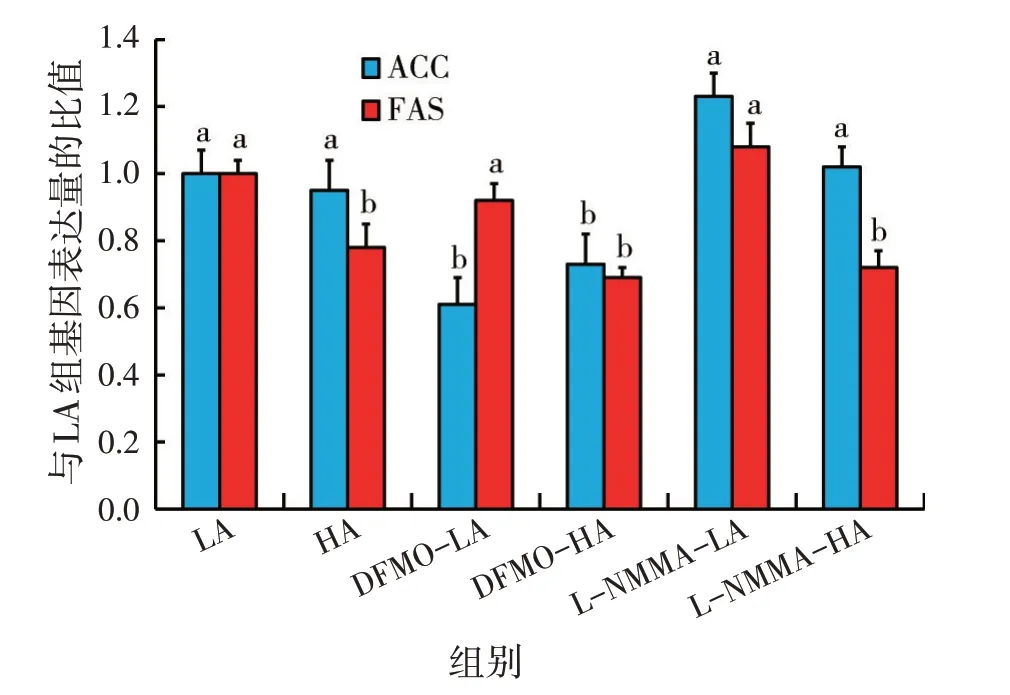
图4 各处理对尼罗罗非鱼肝细胞ACC与FAS基因表达量的影响
由图4 可知,与LA 组ACC 基因相比,DFMO-LA组ACC 基因表达量显著降低(P<0.05),而与L-NMMA-LA 组无显著性差异(P>0.05),与HA 组相比,DFMO-HA 组ACC 基因表达量显著降低(P<0.05);与LA组FAS 基因相比,DFMO-LA 与L-NMMA-LA 组FAS基因表达量无显著性差异(P>0.05) ,而HA组表达量显著降低(P<0.05);与HA 组相比,DFMO-HA 与L-NMMA-HA组FAS基因表达量无显著性差异(P>0.05)。
3 讨论
在长期实验中,由于动物对精氨酸逐渐适应,摄入高浓度精氨酸未能观察到精氨酸代谢相关基因表达量以及体重的显著性差异[9]。因此短期的细胞实验能更好揭示动物对精氨酸的反应机理。DFMO 是ODC 酶活的抑制剂。结果显示,DFMO 处理下,无论培养基中精氨酸浓度高低,ODC基因表达量都显著升高,可以预料这是因为DFMO 抑制ODC 酶活,然后由于腐胺的耗尽,细胞上调ODC 基因表达[10]。在3T3-L1细胞中,DFMO会下调SSAT基因,从而影响多胺的转化[11],而尼罗罗非鱼肝脏细胞SSAT 基因也同样下调,SSAT 的下调将提高乙酰辅酶A 的细胞浓度[12],而ACC 催化生物体内由乙酰辅酶A 转变成丙二酰辅酶A的化学反应,因此将导致细胞ACC基因的下调。
ODC 和一氧化氮酶(NOS)的活性均依赖于通用底物L-精氨酸,该底物可被NOS 直接加工成一氧化氮(NO)和L-瓜氨酸,或者在尿素循环中精氨酸酶作用于精氨酸以产生鸟氨酸,然后鸟氨酸进入多胺生物合成。有文献表明,NO能够抑制ODC活性,而多胺则可以抑制NOS活性[13]。这些结果都表明这两种代谢途径可能在调节某些生理功能的过程中相互干扰,L-NMMA是NOS酶的抑制剂,L-NMMA处理下,在精氨酸含量较低的情况下,ODC基因表达量降低,估计这是因为L-NMMA抑制NOS活性,导致更多鸟氨酸进入多胺生物合成,导致细胞下调ODC表达量。而精氨酸含量较高的情况下,HA组ODC表达量已经出现显著性下调,可能与较多的精氨酸经精氨酸酶转化为鸟氨酸进入多胺生物合成有关,细胞SSAT表达量上调,将对CPT-1起抑制作用,后者是长链脂肪酸β 氧化的限速酶[14]。
DFMO 与L-NMMA 处理对FAS 的基因表达量都没有产生显著性变化,反而是培养基中高浓度精氨酸下调FAS基因的表达量,表明在本研究设定的精氨酸含量范围以内,高精氨酸浓度对于尼罗罗非鱼脂肪酸合成有抑制作用。如前所述,尼罗罗非鱼细胞多胺途径与一氧化氮途径在调控脂肪代谢的过程中存在相互干扰的现象。但是由于精氨酸浓度范围的限制,具体推论仍需要进一步的实验验证。
4 结论
①高精氨酸浓度对于尼罗罗非鱼脂肪酸合成有抑制作用。
②尼罗罗非鱼细胞多胺途径与一氧化氮途径在调控脂肪代谢的过程中存在相互干扰。

