左西孟旦联合高容量血液滤过对脓毒症心肌损伤患者内毒素、神经内分泌激素和炎症指标的影响
吕品 牛晓娟 陈霞 周超 李建英
脓毒症在我国乃至全球发病率居高不下,是造成院内重症科室死亡率增高的主要原因之一[1,2]。心肌损伤则是脓毒症最常见的并发症,多数脓毒症患者合并心功能不全,最终导致多脏器衰竭,病死率高[3,4]。研究显示,组织灌注不足导致的全身性炎性反应及其引发的器官功能障碍是脓毒症发生发展的重要病理机制,其中炎症信号通路的激活是脓毒症诱发心肌损伤和循环衰竭的关键环节[5,6]。高容量血液滤过(HVHF)是治疗脓毒症的主要方式,能够有效清除毒素,抑制炎性反应,但疗效有限[7]。左西孟旦是一种新型钙离子增敏剂,在多种心脏疾病的治疗中被证实具有强心、扩血管作用[8]。本研究探讨了左西孟旦联合HVHF对脓毒症心肌损伤患者内毒素、神经内分泌激素和炎症指标的影响,并以Toll样受体4(TLR4)/核因子κB(NF-κB)信号通路为靶点探讨其治疗机制。报告如下。
1 资料与方法
1.1 一般资料 将2016年1月至2019年1月我院收治的脓毒症心肌损伤患者60例纳入研究范围,随机分为对照组和治疗组,每组30例。对照组男18例,女12例;年龄41~72岁,平均(56.18±7.05)岁;治疗组男20例,女10例;年龄42~68岁,平均(54.76±6.32)岁。2组基线资料比较差异无统计学(P>0.05),具有可比性。
1.2 纳入及排除标准 纳入标准:(1)符合脓毒症诊断标准[9],且心肌酶谱异常,超声检查显示左心室射血分数下降>50%,提示伴有心肌损伤[10];(2)患者自愿加入本研究,且签署知情同意书。排除标准:(1)既往有心绞痛、心肌炎、心肌梗死等基础心脏疾病者;(2)重要脏器功能障碍者;(3)消化道溃疡、血液系统疾病、自身免疫性疾病患者;(4)恶性肿瘤患者;(5)对左西孟旦过敏者。
1.3 治疗方法 2组均给予营养支持、机械通气、抗感染、纠正水电解质紊乱、去甲肾上腺素维持血压等基础治疗。对照组实施早期HVHF治疗,股静脉或颈内静脉穿刺、留管,建立血管通路,采用床边血液透析机进行血液滤过治疗,20 h/d,持续6 d;治疗组在对照组基础上加用左西孟旦注射液(成都圣诺生物制药有限公司),首负荷剂量12 μg/kg,静脉注射时间≥10 min,随后维持量0.1 μg·kg-1·min-1静脉滴注24 h,2 h后调整为0.2 μg·kg-1·min-1,持续静脉滴注。
1.4 观察指标
1.4.1 内毒素:采集患者空腹静脉血5 ml,离心取上清,采用微生物快速检测仪测定血清内毒素。
1.4.2 神经内分泌激素:采用酶联免疫吸附实验测定血清皮质醇(Cor)、肾上腺皮质激素(ACTH)、去甲肾上腺素(NE)、血管紧张素Ⅱ(AngⅡ)。
1.4.3 炎症指标:采用血球计数仪测定白细胞计数(WBC);采用全自动生化分析仪测定血清降钙素原(PCT)。
1.4.4 Real time-PCR:密度梯度离心法提取外周血单核细胞(PBMCs),采用Real time-PCR测定PBMCs TLR4、NF-kB、SIRT1 mRNA表达。Trizol提取细胞总RNA,逆转录试剂盒合成cDNA第1链,ABI 7300型荧光定量PCR仪进行扩增反应,设β-actin为内参照基因,目的基因表达相对值为2-ΔΔCt。
1.4.5 Western blot:提取PBMC总蛋白,经SDS-PAGE电泳后转移至PVDF膜,室温下10%脱脂奶粉封闭2 h。依次加入抗TLR4、NF-kB、SIRT1特异性一抗和辣根过氧化物酶标记的羊抗鼠IgG,TBST洗膜3次。ECL化学发光法显色、定影。

2 结果
2.1 2组内毒素比较 2组治疗前内毒素比较差异无统计学意义(P>0.05),2组治疗后内毒素均较治疗前显著降低(P<0.05),且治疗组改善程度更明显(P<0.05)。见表1。
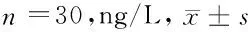
表1 2组内毒素比较
2.2 2组神经内分泌激素比较 2组治疗前Cor、ACTH、NE、AngⅡ比较差异无统计学意义(P>0.05);2组治疗后Cor、ACTH、NE、AngⅡ均较治疗前显著降低(P<0.05),且治疗组改善程度更明显(P<0.05)。见表2。
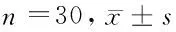
表2 2组神经内分泌激素比较
2.3 2组TLR4/NF-κB信号通路关键分子表达比较 2组治疗前TLR4、NF-κB mRNA和蛋白表达比较差异无统计学意义(P>0.05);2组治疗后TLR4、NF-κB mRNA和蛋白表达均较治疗前显著降低(P<0.05),且治疗组改善程度更明显(P<0.05)。见表3。
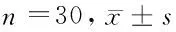
表3 2组TLR4/NF-κB信号通路关键分子表达比较
2.4 2组炎症指标比较 2组治疗前WBC、PCT比较差异无统计学意义(P>0.05);2组治疗后WBC、PCT均较治疗前显著降低(P<0.05),且治疗组改善程度更明显(P<0.05)。见表4。
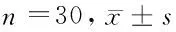
表4 2组炎症指标比较
2.5 2组SIRT1表达比较 2组治疗前SIRT1 mRNA和蛋白表达无差异(P>0.05);2组治疗后SIRT1 mRNA和蛋白表达均较治疗前显著升高(P<0.05),且治疗组改善程度更明显(P<0.05)。见表5。
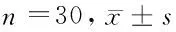
表5 2组SIRT1表达比较
3 讨论
随着致病菌生长繁殖,菌体裂解释放大量内毒素,导致全身过度炎性反应,同时机体清除致病菌能力降低,从而诱发多脏器功能损害,这是导致脓毒症病情加重的主要原因。且内毒素水平可在一定程度上反映致病菌生长繁殖和感染严重程度。此外,WBC是反映炎性反应程度的常用指标,但特异性差。PCT是甲状腺C细胞、肠道神经内分泌细胞分泌的细胞因子,正常情况下血清PCT水平较低,当机体发生感染、脓毒症、多器官衰竭时细菌内毒素能够促进PCT的合成和分泌,导致血清PCT水平增高,且与感染严重程度密切相关。因此,PCT已经成为诊断感染、脓毒症的重要指标,较传统指标具有更高的敏感性、特异性。本研究结果显示,2组治疗前内毒素、WBC、PCT比较差异无统计学意义(P>0.05);2组治疗后内毒素、WBC、PCT均较治疗前显著降低(P<0.05),且治疗组改善程度更明显(P<0.05),说明脓毒症患者存在明显的炎性反应,左西孟旦联合HVHF能够有效降低血清内毒素水平,控制炎性反应,从而减轻心肌损伤。
研究发现,TLR4/NF-κB信号通路在调控脓毒症全身炎性反应中发挥重要作用[11]。TLR4是介导非特异性免疫应答的一种跨膜糖蛋白,在单核巨噬细胞、心肌细胞、血管内皮细胞等多种类型细胞膜中均有表达,其配体为革兰阴性菌细胞壁成分脂多糖,通过MyD88依赖性和MyD88非依赖性途径能够激活NF-κB,后者转位进入细胞核后与炎性因子启动子区域结合,参与调控炎症相关基因的转录和表达,造成炎性反应进一步放大并损害心肌组织[12]。基础和临床研究证实,脓毒症时心肌组织TLR4、NF-κB及炎性因子表达增高,提示心肌组织存在过度炎性反应,而使用TLR4抑制剂能够阻断TLR4/NF-κB信号通路的活化,减轻心肌组织炎性反应[13]。因此,以TLR4/NF-κB信号通路为靶点有可能降低或逆转脓毒症全身炎性反应,进而减轻心肌损伤。本研究结果显示,2组治疗前TLR4、NF-κB mRNA和蛋白表达比较差异无统计学意义(P>0.05);2组治疗后TLR4、NF-κB mRNA和蛋白表达均较治疗前显著降低(P<0.05),且治疗组改善程度更明显(P<0.05),提示左西孟旦联合HVHF治疗脓毒症心肌损伤能够阻断TLR4/NF-κB信号通路的激活,降低炎性因子的合成和分泌,从而减轻心肌损伤程度。
SIRT1是一种组蛋白去乙酰化酶,参与调控细胞分化、凋亡、自噬、炎性反应等生理和病理过程[14]。多项研究表明,SIRT1表达下调与心肌肥厚、动脉粥样硬化等心血管疾病密切相关[15]。国内外研究发现,脓毒症小鼠心肌组织SIRT1表达降低,而恢复SIRT1表达能够抑制NF-κB的活化,进而减轻脓毒症诱发的心肌损伤[16,17]。本研究结果表明,2组治疗前SIRT1 mRNA和蛋白表达比较差异无统计学意义(P>0.05);2组治疗后SIRT1 mRNA和蛋白表达均较治疗前显著升高(P<0.05),且治疗组改善程度更明显(P<0.05),说明左西孟旦联合HVHF治疗脓毒症心肌损伤能够上调SIRT1表达,进而抑制TLR4/NF-κB信号通路的激活和炎性因子的分泌,减轻心肌损伤。
当脓毒症心肌损伤发生后,心肌细胞凋亡增多,进而激活神经内分泌系统,导致应激激素大量分泌,从而加重心肌损伤[18]。本研究结果显示,2组治疗前Cor、ACTH、NE、AngⅡ比较差异无统计学意义(P>0.05);2组治疗后Cor、ACTH、NE、AngⅡ均较治疗前显著降低(P<0.05),且治疗组更明显(P<0.05),说明左西孟旦联合HVHF治疗脓毒症心肌损伤能够抑制神经内分泌的激活,降低应激激素分泌,保护心功能。
综上所述,左西孟旦联合HVHF治疗脓毒症心肌损伤能够通过上调SIRT1的表达抑制TLR4/NF-κB信号通路的活化,抑制炎性反应,并降低神经内分泌激素水平。

