七叶皂苷钠对宫颈癌模型大鼠癌细胞凋亡的影响及作用机制研究
托鲁尼阿依·吐尔逊 万迎香 夏日瓦娜·阿巴斯
宫颈癌属于女性常见的生殖系统恶性肿瘤,主要是由宫颈上皮内瘤不断发展导致,突破上皮下基膜对间质进行浸润,导致宫颈浸润癌产生[1]。研究显示,宫颈转化区上皮化处于过度活跃状态,通过致癌因素的影响也容易引发宫颈浸润癌[2]。大多数专家认为宫颈癌发生与患者的性生活紊乱、高危型HPV感染、分娩次数多等因素有关[3]。七叶皂苷钠属于一种三萜皂苷钠盐,主要用于脑水肿治疗,以及创伤导致的肢体肿胀等治疗。李涌泉等[4]研究指出,七叶皂化钠的抗炎作用显著,能够有效的提高患者脑组织中超氧化物歧化酶活性,对新生血管、胰脂肪酶活性有抑制作用。也有研究显示,七叶皂苷钠在抗肿瘤方面,能够改善其微环境,作用于多种肿瘤[5]。本文旨在研究七叶皂苷钠对宫颈癌模型大鼠癌细胞凋亡的影响及作用机制,为其临床应用提供临床参考。
1 材料与方法
1.1 实验动物 研究动物:清洁级健康雄性SD大鼠30只[海南医学院实验动物中心,合格证号:SCXK(粵)2012-0002],大鼠周龄8~10周,平均(9.4±1.1)周;体重200~220 g,平均(210.5±5.4)g,由海南医学院实验动物中心提供。大鼠饲养严格按照动物饲养标准规程操作,环境温度保持于22~25℃,湿度45%~55%,每小时通风6~10次,每天按时给水及添加饲料,每2天更换垫料1次。本研究所做实验均获得医院伦理委员会批准。
1.2 方法
1.2.1 宫颈癌模型建立:参考文献[6],在无菌操作环境下进行,将人宫颈癌Hela细胞在RPMI-1640培养液,温度为37℃,5%的CO2中培养,使用0.25%胰酶消化细胞,之后使用10%的小牛血清培养基将消化终止,使用1 200 r/min离心处理10 min,之后洗涤。将细胞计数设置为107/ml,抽取人宫颈癌Hela细胞悬浊液,选取20只大鼠,在其腋窝进行皮下注射,剂量为0.5 ml。常规饲养7 d,观察肿瘤结节生长情况。
1.2.2 分组及给药:20只宫颈癌模型大鼠随机分为模型组和七叶皂苷钠组,每组10只,正常组大鼠10只。七叶皂苷钠组大鼠给予七叶皂苷钠注射液皮下注射干预,剂量为40 mg/L。正常组和模型组大鼠给予等体积的无菌0.9%氯化钠溶液进行干预。所有大鼠连续干预4周。
1.2.3 肿瘤体积、脏器指数检测:大鼠在干预4周后断头处死,剥离大鼠肿瘤组织,计算肿瘤体积。取大鼠胸腺和脾脏组织,使用扭力天平称取大鼠大鼠胸腺和脾脏重量,计算胸腺、脾脏指数。公式:脏器指数=脏器重量/体重。
1.2.4 病理学观察:大鼠处死后,立即提取大鼠宫颈内膜组织标本,使用40 ml/L的多聚甲醛进行固定,常温下使用15%的EDTA脱钙6周,脱水后进行石蜡包埋,制作3 μm的组织切片,HE染色,观察。
1.2.5 宫颈癌细胞增值率、凋亡率计算:将大鼠肿瘤组织放在有少量盐水的平皿中,使用剪刀将组织剪成匀浆,之后加入0.9%氯化钠溶液10 ml,使用吸管将肿瘤组织吸取。先使用100目的尼龙网过滤,在使用1 000 r/min离心沉淀5 min,之后使用0.9%氯化钠溶液清洗3次,其沉淀以500 r/min离心处理,将细胞碎片清除。使用300目尼龙网过滤后,使用70%的冰乙醇固定,在4℃环境中保存。采用MTT检测细胞增殖率,流式细胞仪检测细胞凋亡率。
1.2.6 Caspase-3、Caspase-7、Caspase-9、PI3K、pAKT蛋白检测:将采集到的血液标本,研磨后加入蛋白缓冲液,进行常规蛋白提取,采取BCA法进行定量分析。50 μg的蛋白样品上样后SDS-PAGE电泳,通过蛋白电转到PVDF膜,使用5%的脱脂奶粉TBST中进行避光封闭1 h,洗涤之后加入一抗稀释溶液[含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)、Caspase-7、Caspase-9、磷脂酰肌醇3-激酶(PI3K)、磷酸化蛋白激酶B(pAKT)按照1∶1 000比例进行稀释],在4℃的环境中过夜保存,洗涤后加入二抗稀释溶液(Caspase-3、Caspase-7、Caspase-9、PI3K、pAKT按照1∶5 000比例进行稀释),在温床中孵育1 h后再次洗涤,加入发光液ECL,曝光2~3次,取重叠值。使用软件分析蛋白条带灰度值。内参蛋白是GAPDH。

2 结果
2.1 七叶皂苷钠对宫颈癌模型大鼠肿瘤体积和脏器指数的影响 与正常组比较,模型组和七叶皂苷钠组大鼠肿瘤体积增加,胸腺指数、脾指数降低,差异有统计学意义(P<0.05);与模型组相比,七叶皂苷钠组大鼠体积增加,胸腺指数、脾指数降低,差异有统计学意义(P<0.05)。见表1。
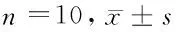
表1 3组大鼠肿瘤体积和脏器指数比较
2.2 宫颈癌模型大鼠病理学观察 正常组大鼠宫颈组织正常,细胞排列较为规则、整齐,结构完整;模型组大鼠宫颈组织出现炎症细胞浸润,细胞排列紊乱;七叶皂苷钠组大鼠宫颈组织有炎性细胞浸润现象降低。见图1。
2.3 七叶皂苷钠对宫颈癌模型大鼠癌细胞增殖、凋亡的影响 与正常组比较,模型组和七叶皂苷钠组大鼠癌细胞增殖率、凋亡率高,差异有统计学意义(P<0.05);与模型组比较,七叶皂苷钠组大鼠癌细胞增殖率降低,凋亡率升高,差异有统计学意义(P<0.05)。见表2。
正常组模型组七叶皂苷钠组
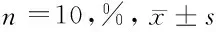
表2 3组大鼠癌细胞增殖率和凋亡率比较
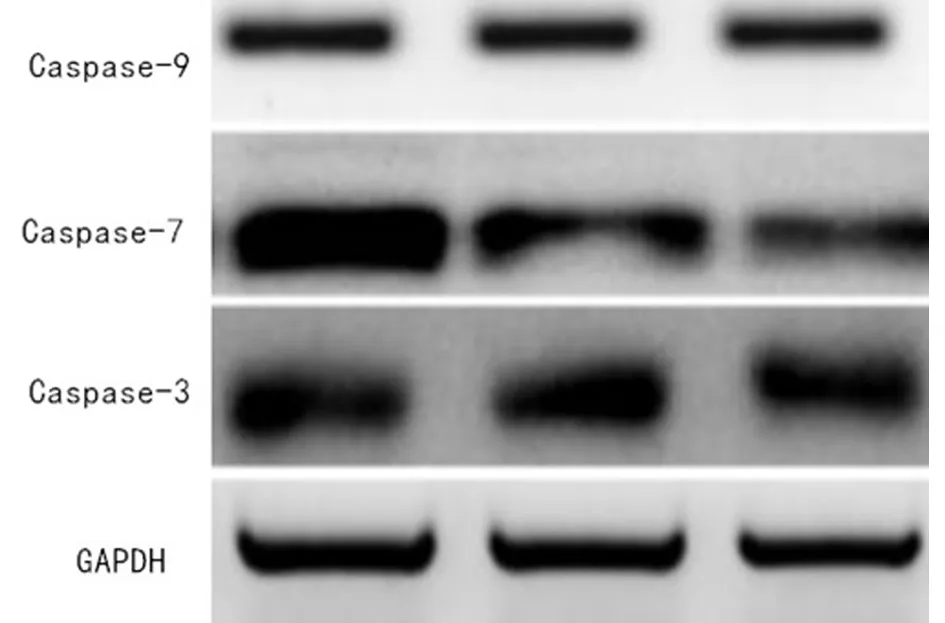
2.4 七叶皂苷钠对宫颈癌模型大鼠Caspase-3、Caspase-7、Caspase-9蛋白的影响 与正常组比较,模型组和七叶皂苷钠组大鼠Caspase-3、Caspase-7、Caspase-9蛋白表达降低,差异有统计学意义(P<0.05);与模型组比较,七叶皂苷钠组大鼠Caspase-3、Caspase-7、Caspase-9蛋白表达升高,差异有统计学意义(P<0.05)。见表3,图2。
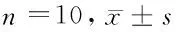
表3 3组大鼠Caspase-3、Caspase-7、Caspase-9蛋白表达比较
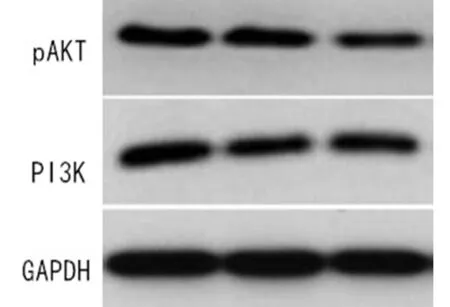
2.5 七叶皂苷钠对宫颈癌模型大鼠相关通路蛋白的影响 与正常组比较,模型组和七叶皂苷钠组大鼠PI3K、pAKT蛋白表达升高,差异有统计学意义(P<0.05)。与模型组比较,七叶皂苷钠组大鼠PI3K、pAKT蛋白表达降低,差异有统计学意义(P<0.05)。见表4,图3。

正常组模型组七叶皂苷钠组
图23组大鼠Caspase-3、Caspase-7、Caspase-9蛋白Western Blot图
表4 3组大鼠PI3K、pAKT蛋白表达比较
正常组模型组七叶皂苷钠组
3 讨论
肿瘤的发生发展不仅依靠细胞增殖,还与肿瘤细胞凋亡有关。凋亡细胞通过诱导细胞凋亡,新细胞代替凋亡细胞,维持细胞凋亡和细胞增殖之间的动态平衡[7]。研究指出,凋亡细胞数量降低,会造成凋亡抑制因子表达水平升高,对凋亡因子起到抑制作用,将细胞凋亡和细胞增殖间的动态平衡打破,导致肿瘤产生[6,8]。七叶皂苷钠对人类慢性髓细胞样白血病细胞以及急性T细胞白血病细胞有抑制增殖作用,同时能够提高5-氟尿嘧啶等抗肿瘤药物杀伤能力[9,10]。目前关于七叶皂苷钠对宫颈癌的作用机制尚未明确。
本研究结果显示,与正常组比较,模型组和七叶皂苷钠组大鼠体积增加,胸腺指数、脾指数降低,其中与模型组比较,七叶皂苷钠组大鼠体积增加,胸腺指数、脾指数降低,说明七叶皂苷钠能够减少宫颈癌体积,抑制肿瘤生长,降低胸腺指数、脾指数,改大鼠症状。高艳等[11]在研究中指出,苦参碱能够减少大鼠肿瘤体积,与本文研究结果保持一致,说明七叶皂苷钠能够起到与苦参碱相同的作用效果。Chen等[12]研究显示,七叶树中发现的皂苷类物质对非小细胞肺癌A549细胞和胃肠道肿瘤细胞毒性作用较强。也有研究显示,七叶皂苷钠对宫颈癌COX5细胞、HeLa细胞、乳腺癌细胞增殖有抑制作用,同时能够促进细胞凋亡[13,14]。本研究结果显示,与正常组比较,模型组和七叶皂苷钠组大鼠癌细胞增殖率、凋亡率高,与模型组相比,七叶皂苷钠组大鼠癌细胞增殖率降低,凋亡率升高。说明七叶皂苷钠能够促进宫颈癌细胞凋亡,抑制增殖。与Wang等[15]研究结果保持一致。
Caspase-3、Caspase-7、Caspase-9属于Caspase家族重要的凋亡促进因子,主要作用是诱导细胞凋亡[16]。人体中大部分细胞凋亡需要凋亡因子进行诱导,凋亡促进因子活性被抑制,会引发肿瘤。王剑等[17]研究指出,Survivin属于一种凋亡抑制因子,其水平下调,会促进Caspase因子上调,从而导致细胞发生凋亡。Song等[18]研究中,七叶皂苷钠干预宫颈HeLa细胞,会增加线粒体通透性,促进Caspase-9激活。本文结果显示,与正常组比较,模型组和七叶皂苷钠组大鼠Caspase-3、Caspase-7、Caspase-9蛋白表达降低,与模型组比较,七叶皂苷钠组大鼠Caspase-3、Caspase-7、Caspase-9蛋白表达升高。提示七叶皂苷钠能够促进宫颈癌大鼠Caspase-3、Caspase-7、Caspase-9蛋白表达升高,从而促进细胞凋亡。
PI3K/Akt信号通路与肿瘤发展有关,PI3K属于一种蛋白激酶,经过生长因子刺激后,PI3K被活化,PIP3产生,与细胞中的AKT结合后,AKT内部结构发生改变[19,20]。本文数据中,与正常组比较,模型组和七叶皂苷钠组大鼠PI3K、pAKT蛋白表达升高。提示,七叶皂苷钠活化PI3K/AKT,促进Caspase-3、Caspase-7、Caspase-9激活,通过有丝分裂性传递,促进细胞凋亡,抑制增殖。
综上所述,七叶皂苷钠能够减小宫颈癌大鼠肿瘤体积,改善胸腺指数、脾指数,通过激活PI3K、pAKT信号通路,调控Caspase-3、Caspase-7、Caspase-9蛋白表达,起到降低癌细胞增殖,促进凋亡作用。

