胃癌组织中PDK-1蛋白表达与临床病理特征及预后的相关性分析
王亚明 于丽霞 王静 杨龙龙 王朝辉 宋晓明 张小辉 郭晓娟 方丽
胃癌即发生于胃黏膜上皮的恶性肿瘤,与长期幽门螺旋杆菌感染、胃部疾病及饮食习惯等有密切联系。早期胃癌患者症状较隐匿,仅出现轻微的胃肠道症状,因而常被患者忽视。在中国,胃癌为排名第二位的恶性肿瘤,年发病率为36.2/10万,严重威胁我国公众的生命健康[1]。早期预防、早期诊断和早期治疗是改善胃癌患者生活质量,提高生存率的关键措施,因此寻求一种敏感度高的预测胃癌患者临床预后引起临床研究者的广泛关注[2]。3-磷酸肌醇依赖性蛋白激酶-1(PDK-1)是蛋白激酶B、p70核小体S6激酶、p90核小体S6激酶、血清和糖皮质激素诱导激酶以及蛋白激酶C等AGC激酶活化环的主要激酶,也是蛋白激酶B的上游信号分子,在人体心脏、肝脏、脾脏、大脑及胃等重要组织器官中广泛表达,近年来倍受国内外学者关注[3]。有研究发现,PDK-1在许多恶性肿瘤中异常活化,其主要是通过激活蛋白激酶B,进而介导PI3K/Akt信号通路来导致肿瘤的发生发展及浸润转移[4]。PDK-1参与和促进肿瘤的发生、发展和浸润转移,在食管癌、结肠癌等多种恶性肿瘤中均呈现高表达的现象。本研究选取2010年3月至2012年9月本院收治的96例行胃癌手术治疗患者作为研究对象,拟通过对本院收治的胃癌患者的PDK-1蛋白表达情况进行观察分析,旨在探讨胃癌组织中PDK-1蛋白的表达与临床特征及预后状况的关系,报道如下。
1 资料与方法
1.1 一般资料 选择2010年3月至2012年9月本院收治的行胃癌手术治疗患者作为研究对象,共纳入96例患者,其中男54例,女42例;年龄31~84岁,平均年龄(59.3±10.1)岁;根据原发肿瘤最大直径可分为:直径>5 cm 62例,直径≤5 cm 34例;根据肿瘤分化程度可分为:低分化48例,中分化34例,高分化14例;根据肿瘤原发部位可分为上部39例,中部40例,下部17例;根据国际抗癌联盟(UICC)第7版[6]胃癌TNM分期可分为:Ⅰ期14例,Ⅱ期26例,Ⅲ期56例;根据有无淋巴结转移可分为:区域淋巴结转移83例,无区域淋巴结转移13例。同时选取同期本院健康体检者96例,其中男55例,女41例;年龄30~85岁,平均年龄(59.4±10.3)岁;均满足本研究纳入、排除标准。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
1.2.1 纳入标准:①符合胃癌诊断标准[5],并经病理检查证实诊断;②患者及家属了解试验目的,明确试验风险,签署知情同意书,并经本院医院伦理委员会审核通过;③患者年龄>18岁;④既往不存在精神疾病等干扰试验正常进行的患者。
1.2.2 排除标准:①合并其他部位肿瘤;②手术治疗前有接受肿瘤相关治疗;③手术治疗前已经出现胃癌远处转移;④手术治疗后行放疗、二次手术或生物免疫治疗者;⑤试验过程中应不能耐受中途退出者;⑥存在其他部位严重疾病的患者。
1.3 方法
1.3.1 资料收集:收集入选胃癌患者的临床和随访资料,使用统一调查表摘录相关内容,资料内容主要包括性别、年龄、胃癌病理类型、临床分期、肿瘤部位和大小、治疗方式、转移情况、浸润情况等。
1.3.2 石蜡切片:选取所选患者的术后癌组织和癌旁正常组织(取距肿瘤边缘>5 cm处组织作为正常组织),取得合适组织标本修材后,甲醛固定,二甲苯透明,蜡块包埋,冷却后使用切片机以5 μm厚度每层连续切片,冷却后备用。
1.3.3 实验仪器与试剂:免疫组织化学检验化试剂盒及二步法抗兔购于杭州赫贝科技有限公司,兔源抗人PDK-1单克隆抗体购于上海昕浩生物科技有限公司。主要仪器有光学显微镜等。
1.3.4 实验方法:具体实验操作由专人严格按照试剂盒说明书严格进行,按照无菌条件操作,所用器具均按标准进行高压灭菌及烘干处理。首先取出保存在-80℃冰柜中的正常胃黏膜、胃癌组织,加入少量液氮,将其碾碎成粉末状态。将组织粉末转移至2 ml Eppendorf管中,加入1.2 ml PBS(pH值为7.4),充分震荡后离心20 min取上清液。获取胃组织匀浆后,采用免疫组织化学染色法检测所选胃癌组织中PDK-1的表达。操作过程中采用己知阳性切片作为阳性对照,用PBS缓冲液为一抗行阴性对照实验。
1.3.5 免疫组化:结果判断标准[7]采用半定量法,应用普通光学显微镜,随机选取5个不同高倍镜下(400×)视野,0分表示为无阳性细胞,1分表示为阳性细胞数目百分率<10%,2分表示为阳性细胞数目百分率为10%~50%,3分表示为阳性细胞数目百分率为51%~80%,4分表示为阳性细胞数目百分率>80%。同时观察染色强度,0分表示为无着色,1分表示为淡黄色,2分表示为棕黄色,3分表示为棕褐色。最后PDK-1的表达以染色强度积分与阳性细胞百分率积分的乘积进行判定,其中所得分数<6分为低表达,≥6分为高表达。病理阅片及染色积分判定由两位病理专家盲法观察完成。
1.4 随访方式 所选患者均经电话随访或门诊复查等方式进行随访,随访周期为术后1年内每3个月1次,3年内每3~6个月1次,5年内每6个月1次,之后每1年1次。随访至患者死亡或2017年9月1日为止,入选患者随访率为100%,生存时间以月为单位。

2 结果
2.1 胃癌组织中PDK-1蛋白的表达情况 PDK-1蛋白表达于胃癌癌细胞的细胞质,染色为棕黄色表示为阳性,无特异性染色表示阴性。在所选胃癌患者癌细胞组织中,PDK-1蛋白阳性表达率为68.75%;正常组织中,PDK-1蛋白阳性表达率为9.38%,胃癌组织PDK-1蛋白阳性表达率明显高于正常组织的阳性表达率(P<0.05)。见表1,图1。
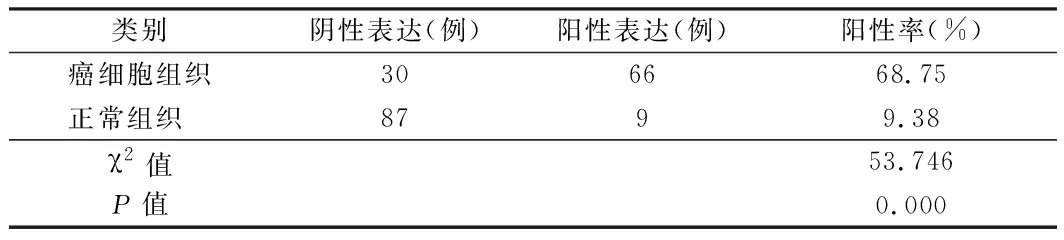
表1 胃癌组织中PDK-1蛋白的表达情况 n=96
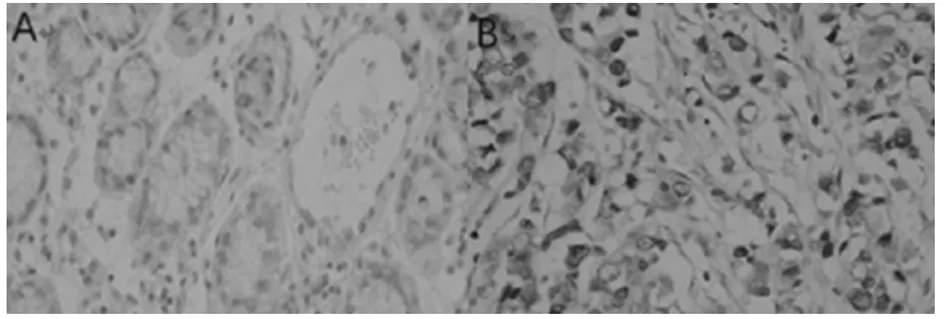
图1 正常组织和癌细胞组织的表达情况(免疫组化×400);A为正常组织,B为癌细胞组织
2.2 胃癌组织中PDK-1蛋白的表达与胃癌患者预后的关系 所选胃癌患者随访存活1~72个月,中位生存期为37个月,术后5年生存者共34例,生存率为35.42%(34/96)。不同PDK-1蛋白的表达水平患者生存情况:(1)PDK-1蛋白低表达患者随访存活1~72个月,中位生存期为61个月,术后5年存活率分别为70.83%(68/96);(2)PDK-1蛋白高表达患者随访存活1~64个月,中位生存期33个月;术后5年存活率分别为15.63%(15/96)。PDK-1蛋白高表达患者术后5年存活率明显低于PDK-1蛋白低表达患者(χ2=140.108,P<0.01)。
2.3 胃癌组织中PDK-1蛋白的表达与临床病理特征的关系 经Log-rank检验单因素分析显示:年龄、分化类型、TNM分期、肿瘤直径、浸润程度与胃癌组织中PDK-1蛋白的表达有关(P<0.05);性别、发病部位、手术方式、肝转移、淋巴结转移与胃癌组织中PDK-1蛋白的表达无关(P>0.05)。见表2。
2.4 胃癌患者预后多因素分析 经多元Cox逐步回归分析,除TNM分期晚期(Ⅲ期)、低分化类型、肿瘤直径>5 cm、浸润程度达浆膜及浆膜外之外,同时PDK-1蛋白高表达也是影响胃癌患者预后的独立危险因素(P<0.05)。见表3。
3 讨论
胃癌是消化科常见的消化道恶性肿瘤疾病,好发于50岁以上的中老年人,男女发病率比为2∶1,其较高的发病率和病死率严重威胁人们的健康[8,9]。虽然目前临床上存在放疗、化疗、中医药治疗、靶向治疗和支持治疗等多种综合治疗方案,但由于多数胃癌患者诊断时已处于进展期,对其进行临床治疗时往往效果较差,仅有20%左右的5年生存率。关于胃癌发病的确切机制目前尚未明确,而造成患者死亡的原因主要是进展期胃癌发生的侵袭与转移[10-12]。临床常采用TNM分期、淋巴结转移等指标对胃癌患者进行术前评估和预后判断,但这些指标敏感度均较低[13,14]。因此,寻求一种可以控制胃癌侵袭和转移的预测指标对胃癌治疗的进展就显得尤为重要。
PDK-1是一类促癌基因,有21个外显子,被研究者定位与5q21染色兔中,编码一个300 kD分子量、由556个氨基酸组成,属于AGC蛋白激酶家族。其为一类亲水性的胞聚蛋白,对细胞生长和细胞周期其调节作用。近年来,PDK-1在多种恶性肿瘤中的促癌作用已经引起了人们的广泛关注[15]。多项研究表明,PDK-1表达于多种恶性肿瘤细胞中,如前列腺癌、乳腺癌、肝癌、胃癌等[16-18]。关于其在癌症发展中的作用机制,主要是因为PDK-1作为蛋白激酶B的上游信号分子,其可通过磷酸化蛋白激酶B的苏氨酸308位点,激活蛋白激酶B,进而参与PI3K/Akt信号通路的活化,抑制细胞凋亡并刺激肿瘤细胞增殖、代谢和血管生成,最终导致肿瘤的发生发展[19,20]。有学者发现,PDK-1可引发额外的信号输出,直接诱发Polo Like激酶1的磷酸化,从而促进肿瘤发展[21]。本次研究中,无论在胃癌组织还是在癌旁正常组织中,PDK-1均主要表达与胃癌癌细胞的细胞质中,在癌组织中的表达水平均得到明显上调,胃癌组织PDK-1蛋白阳性表达率明显高于正常组织的阳性表达率,说明PDK-1蛋白的高表达参与了胃癌的生长、侵袭及转移过程。同时本次研究通过检测胃癌组织中PDK-1蛋白的表达水平,并结合入选胃癌患者的临床和随访资料,发现年龄、分化类型、TNM分期、肿瘤直径、浸润程度与胃癌组织中PDK-1蛋白的表达明显相关。这与国内一项研究报告研究结果相似,但那项研究同时认为淋巴结转移也与胃癌组织中PDK-1蛋白的表达有关[22]。分析其中原因可能与两项研究入选病例基线的差异有关。
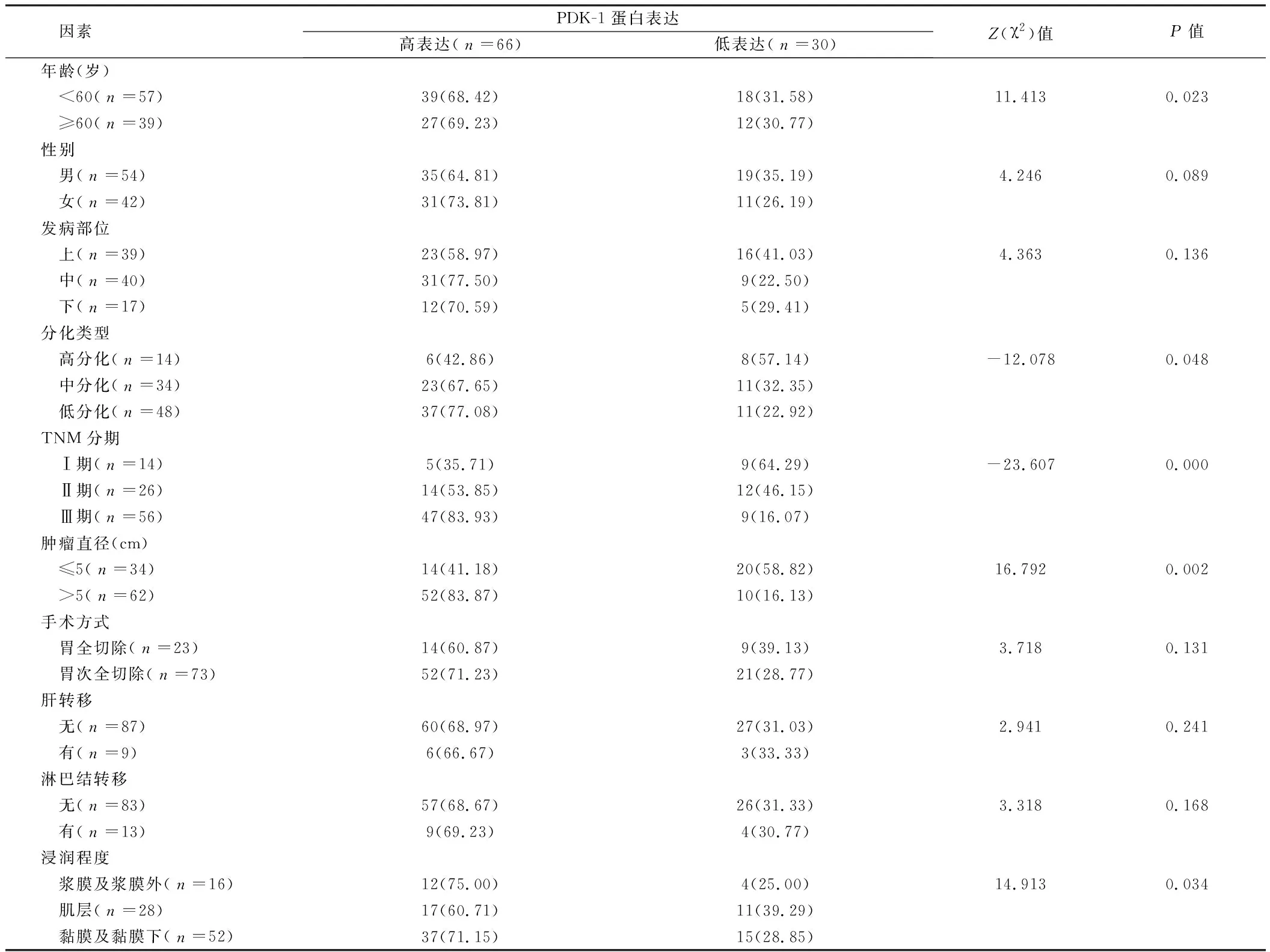
表2 胃癌组织中PDK-1蛋白表达与临床病理特征的关系 例(%)

表3 胃癌患者COX比例风险模型多因素分析
既往有研究表明,PDK-1和恶性肿瘤的预后有关,主要通过影响肿瘤的侵袭转移能力及细胞敏感性影响患者预后生存;同时该研究还发现,通过剔除PDK-1基因可有效抑制肿瘤生长,认为PDK-1是一个可行的恶性肿瘤治疗靶点[23]。国外有研究通过应用miRNA微阵列芯片来研究胃癌患者的临床特征,发现大部分胃癌患者的miR-375表达水平呈下调状态,PDK-1作为miR-375的靶基因之一,通过下调miR-375可以抑制PDK-1的表达,促进肿瘤凋亡[24]。在本次研究中所选胃癌患者随访存活1~72个月,中位生存期37个月,术后5年生存者共34例,生存率35.42%(34/96)。不同PDK-1蛋白的表达水平患者生存情况:(1)PDK-1蛋白低表达患者随访存活1~72个月,中位生存期为61个月,术后5年存活率分别为70.83%;(2)PDK-1蛋白高表达患者随访存活1~64个月,中位生存期为33个月;术后5年存活率分别为15.63%。PDK-1蛋白高表达患者术后5年存活率明显低于PDK-1蛋白低表达患者(P<0.01)。说明胃癌PDK-1蛋白低表达患者的预后明显优于PDK-1蛋白高表达患者。同时本次研究通过建立COX比例风险模型进行多因素分析发现,TNM分期、分化类型、肿瘤直径、浸润程度均是影响胃癌患者预后的独立危险因素,且PDK-1蛋白表达也是影响胃癌患者预后的独立危险因素之一,说明PDK-1蛋白的表达水平可有效反映胃癌患者预后的转归情况,可为以后胃癌治疗的有效靶点提供有力依据。
综上所述,胃癌组织中的PDK-1蛋白与胃癌的发生发展密切相关,其表达水平的高低与胃癌患者预后呈负相关性,可作为胃癌早期诊断或潜在治疗靶点的分子生物学指标。本研究的不足之处在于样本量较小,研究结果存在一定局限性。

