一种新型硫化氢近红外比率荧光探针的研制
韩志湘, 顾宇形, 王 洋, 董良欢, 姜 舒
(江苏大学 环境与安全工程学院, 江苏 镇江 212013)
众所周知,硫化氢是一种无色的具有臭鸡蛋气味的有毒气体[1].然而,最近的研究发现,硫化氢是人体内3种主要的气体信号物质之一[2],参与人体内许多生理和病理过程[3],如调节正常肝脏以及病变肝脏中的微血管循环、心肌收缩力调节、血管舒张、血压双向平稳调节等[4-6].同时,硫化氢能有效去除过氧化氢、超氧阴离子、次氯酸等,在人体内还具有抗氧化应激和抗炎反应等重要作用.因此,在活细胞、组织甚至活体中检测硫化氢对于了解其在生物体中的作用是非常重要的.
目前,研究人员已经开发出多种检测硫化氢的分析方法,如电化学方法、气相色谱法、比色法等[7-9],但这些方法由于检测所需时间长、制备复杂、会对组织和细胞造成破坏等缺陷而不适合检测生物系统中的硫化氢.而荧光分析法由于具有灵敏度高、选择性强、检测速度快、操作简便、对生物样品无损伤等优点,已广泛应用于化学、生物、医药等领域.目前为止,已有许多用于检测硫化氢的荧光探针被开发出来.但许多探针仍然存在一些问题,如响应时间长、灵敏度不够高、易受细胞内脂肪酶干扰等.而激发或发射波长在近红外区域(>650 nm)的荧光探针可以消除生物体自发荧光的干扰,同时在生物体内具有更深的组织穿透性和更少的样品损伤,因此在生物样品分析和生物体内成像方面具有明显优势[10-12].另一方面,比率型荧光探针具有双波长发射(或激发)的特点,因此可使用2个不同的荧光强度进行定量检测,可以消除探针浓度、光漂白、检测设备等因素所造成的数据失真.因此,研制一种响应速度快、灵敏度高、特异性强的近红外比率荧光探针具有重要的科学意义.
花色素染料具有优异的光物理性能、良好的生物兼容性、较高的荧光量子产率和结构易调控等优点而被广泛用于荧光探针的构建.文中拟研制一种含有半刚性环己基的花色素染料近红外比率荧光探针1,以期完成响应速度快、选择性强、灵敏度高且可用于活细胞内内源性和外源性的硫化氢检测.
1 材料和方法
1.1 仪器与试剂
无水N,N-二甲基甲酰胺(DMF)是先用无水硫酸镁干燥24 h,过滤后油泵减压蒸馏后得到,再加入活化的4Å分子筛后保存备用.其他试验中所用到的化学试剂均为市售分析纯试剂,不经纯化直接使用.整个试验过程均使用二次蒸馏水.柱层析所用硅胶(100~200目)购自青岛海洋化工厂.
核磁共振谱图在Varian INOVA 400核磁共振仪上获得;液相质谱分析是在LXQ Spectrometer (Thermo Scientific, USA)上得到的;所有的荧光分析试验均在Thermo Scientific Lumina荧光分光光度计上进行;紫外吸收光谱试验在Shimadzu UV-2600紫外-可见分光光度计上进行;溶液pH值用瑞士Mettler Toledo Five Easy Plus FE28型精密pH计测定.细胞成像在Carl Zeiss公司Axio Observer A1倒置荧光显微镜上测定.肝癌细胞(human hepatoma G2,HepG2)通过含10% 胎牛血清的培养基进行传代培养.
1.2 探针分子1的合成
图1给出了化合物1的合成路线.

图1 化合物1的合成路线
如图1所示,将化合物2(142 mg,0.5 mmol)和4-(二乙氨基)水杨醛(92 mg,0.5 mmol)溶于浓硫酸中(5 mL).混合物在90 ℃搅拌4.5 h,冷却至室温后,向溶液中加入冰(5 g)和70%高氯酸(0.25 mL),过滤,用水洗涤,得到粗产物.粗产物再通过硅胶柱层析(体积比V(二氯甲烷) ∶V(甲醇)=30 ∶1~20 ∶1)得到黑色探针固体化合物1(216 mg,80%).
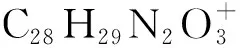
1.3 测量过程
将适量的探针分子1溶于色谱纯乙腈中得到10-3mol·L-1的探针储备液.称取适量的硫氢化钠固体,用蒸馏水溶解定容至100 mL,得到10-3mol·L-1的硫化氢标准溶液.上述溶液均在4 ℃条件下避光保存.所有光谱测试均在PBS缓冲溶液(体积比V(乙腈) ∶V(PBS)=3 ∶7,pH=7.4)中进行.向一定体积的PBS-乙腈缓冲溶液中加入20 μL的探针1和一定体积的硫化氢的标准溶液,得到2.0 mL的待测溶液.此时测试体系中探针1的最终浓度为10 μmol·L-1,硫化氢浓度为0.1~6.0 μmol·L-1.
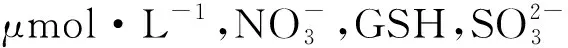
2 结果与讨论
2.1 光谱性质
图2是探针1(10 μmol·L-1)与不同浓度硫化氢的紫外吸收光谱图.

图2 探针分子1与不同浓度NaHS反应前后的紫外-可见光谱
由图2可见,探针分子1的最大吸收峰在674 nm处.随着硫化氢浓度的增加,674 nm处的吸收强度逐渐降低,同时在437 nm处出现新的吸收峰.这表明探针1与硫化氢反应后,其自身浓度逐渐降低而生成的新产物浓度逐渐增加.图3为探针1(10 μmol·L-1)与不同浓度的NaHS结合后的荧光光谱图.
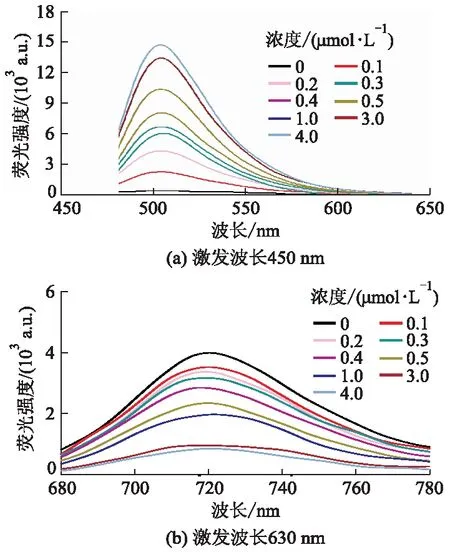
图3 与NaHS反应后探针分子1溶液的荧光光谱图
由图3可见,当溶液中仅存在探针分子时,荧光强度在503 nm(λex=450 nm)处最低,而在720 nm(λex=630 nm)处显示最强.随着加入的硫化氢浓度增加,探针1在503 nm处的荧光强度逐渐增加,而在720 nm处的荧光强度逐渐减小,呈现典型的比率发射模式.当加入4 μmol·L-1的硫化氢后,体系荧光强度达到最大值,表明二者已经反应完全;此时荧光强度较探针本身增强了19.2倍.图4是探针1在503,720 nm处的荧光强度比值(F503/F720)与硫化氢浓度线性关系图.

图4 NaHS浓度与探针分子1溶液荧光强度的关系图
由图4可见,探针分子1对硫化氢响应的线性浓度范围为0.1~4.0 μmol·L-1(R2=0.993 9).设I为503 nm处的荧光强度,根据滴定试验结果,以探针1的(Imin-I)/(Imin-Imax)对硫化氢浓度的对数作图(见图5),可以得到探针1对硫化氢的检测下限为57.8 nmol·L-1,远低于大多数报道的硫化氢比率型荧光探针.
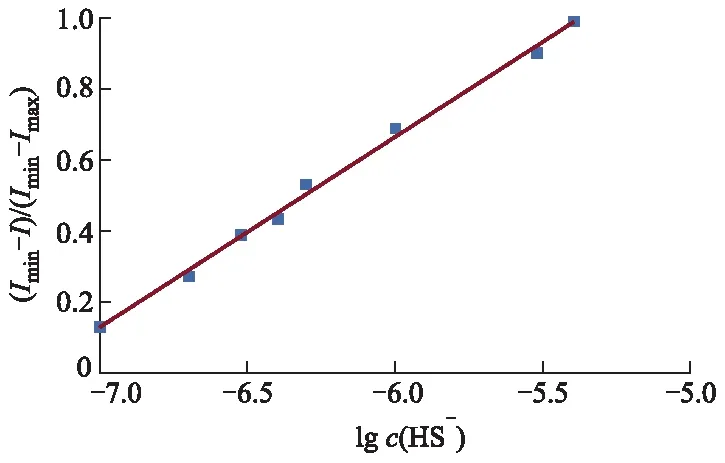
图5 探针1的(Imin-I)/(Imin-Imax)与NaHS浓度的关系曲线图
2.2 pH影响
为了探究探针1是否可以在生理pH范围内对硫化氢进行检测,考察了不同pH下探针1的检测性能,结果见图6.
如图6所示,探针分子本身在pH为6.5~9.5的范围内,荧光强度几乎没有变化,表明探针1在宽pH范围内保持稳定,探针分子本身的结构不会因为溶液pH环境的变化而改变.而探针分子1在503,720 nm处的2个发射信号荧光强度比值F503/F720在加入硫化氢前后有显著变化.当硫化氢加入后,pH在6.5~7.0时,溶液体系的荧光强度稍微增强;当pH处于7.5~8.5时,体系荧光强度比值波动最明显;pH在9.0~9.5时,荧光强度又略微下降.考虑到其实际应用,选取pH=7.4的生理条件为测试条件.
2.3 选择性
接下来考察了一些常见的各种无机离子、活性氧和生物硫醇等对探针分子1荧光强度的影响,结果见图7.
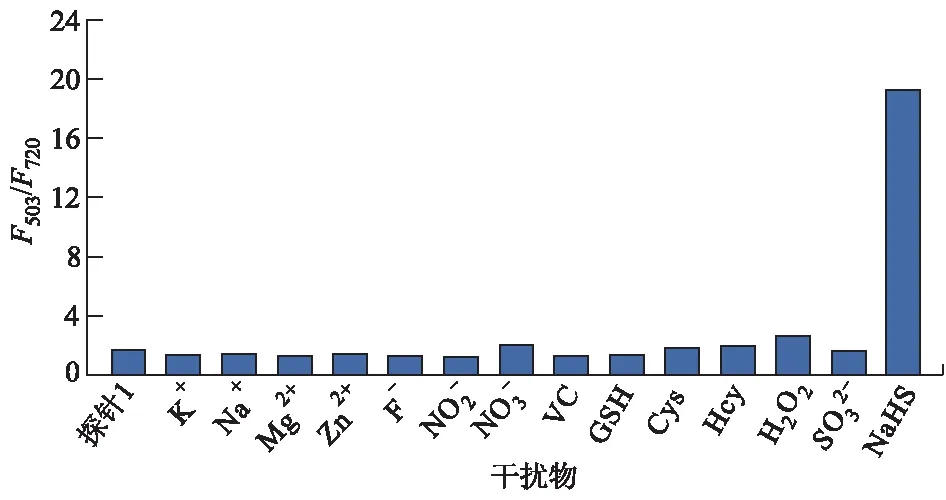
图7 探针分子1对NaHS识别的选择性
2.4 响应时间
进一步研究了探针分子1识别硫化氢的响应时间,结果见图8.

图8 探针分子1与NaHS的时间响应曲线
如图8所示,加入6 μmol·L-1硫化氢后可以观察到荧光强度显著增加,并且在110 s时荧光强度达到最大值并趋于平稳,这表明探针分子在110 s内就可以与硫化氢完全反应,响应速度很快,这对于检测活细胞中的硫化氢是非常有益的.
2.5 细胞试验
鉴于探针1具有响应速度快、选择性强、灵敏度高等优点,将其用于HepG2细胞中硫化氢的荧光成像检测,结果见图9.
如图9所示,仅用探针1(10 μmol·L-1)孵育的HepG2细胞在绿色通道中显示可忽略的荧光,但在红色通道中显示强荧光(图9e-h).然后再用200 μmol·L-1的硫化氢在37 ℃处理细胞30 min后(图9i-l),可以观察到红色通道中的荧光减少,而绿色通道中的荧光增加.为了验证荧光反应是由外源性硫化氢引起的,将HepG2细胞与200 μmol·L-1的N-甲基马来酰亚胺(NMM)预孵育30 min,以降低细胞内硫化氢水平,然后再加入探针1(10 μmol·L-1)在37 ℃孵育30 min.可以看到在抑制剂NMM的存在下,荧光响应被显著抑制(图9a-d),绿色通道中几乎没有荧光,而红色通道中也只有微弱的荧光.接下来,文中还评估了探针1用于检测内源性硫化氢的潜在效用.L-半胱氨酸是一种可以刺激细胞内硫化氢浓度的生物硫醇.因此先用300 μmol·L-1的L-半胱氨酸在37 ℃处理细胞30 min后,再用探针1(10 μmol·L-1)进一步培养30 min,在绿色通道中观察到明亮的荧光信号,而在红色通道中观察到很少的荧光信号.这意味着探针1还可以监测复杂生物系统中的内源性硫化氢.上述结果证明探针1可用于检测HepG2细胞中的内源性和外源性硫化氢.
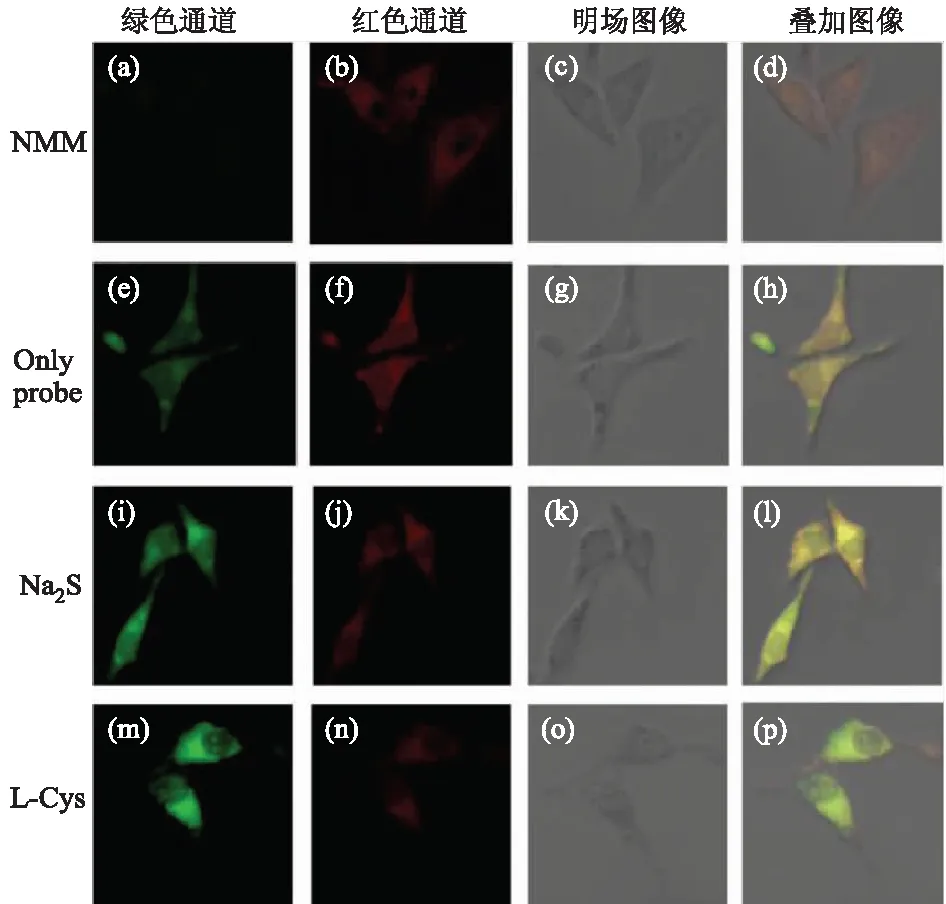
图9 探针分子1与内/外源性硫化氢作用前后的成像图
3 结 论
设计合成了一种基于花色素染料的新型近红外比率荧光探针1.该探针不仅合成快速简便、产率高,而且对硫化氢表现出比率响应、宽浓度范围识别、快速、高灵敏、高选择性及可在生理条件下检测等优异的分析性能.同时该探针还成功应用于HepG2活细胞中内源性和外源性硫化氢的红/绿双色可视化荧光成像检测.

