产壳聚糖酶内生真菌的筛选、鉴定及酶活力初步研究
金秋珠 颜桢灵 黄植清 袁海莹 刘广华 农小霞 李鑫 骆海玉
摘 要:植物内生真菌是挖掘不同类型壳聚糖酶及发现新酶的资源宝库。该研究从122株柑橘和血散薯内生真菌中筛选能产生壳聚糖酶的菌株,对其进行鉴定,初步研究酶活力影响因素,为后期其酶学性质及产壳聚糖酶内生真菌与宿主植物病害防御互作关系的研究奠定基础。通过透明圈法初筛结合液体发酵法进行复筛,得到2株可产生壳聚糖酶的内生真菌Stdif9和Stdif9-4,并发现Stdif9-4最高酶活力(0.968 U·mL-1)显著高于Stdif9(0.780 U·mL-1)。采用形态学和分子生物学结合的方法将菌株Stdif9-4鉴定为青霉属菌株,即Penicillium sp. Stdif9-4。通过DNS试剂法初步研究影响该菌株产壳聚糖酶活力的因素,发现不同培养时间对菌株壳聚糖酶活力具有显著影响,在培养96 h时,壳聚糖酶活力达到最大值。9种金属离子对菌株的酶活力具有不同影响,其中Mn2+和Ca2+对壳聚糖酶活力具有明显的激活作用;Ag+、Zn2+、Cd2+、Ba2+和Fe3+对壳聚糖酶活力具有不同程度的抑制作用,并且Ag+的抑制作用最为显著;K+和Na+对壳聚糖酶活力无显著影响。不同培养代数菌株产酶活力无显著差异,说明其产酶活力稳定。
关键词:植物内生真菌,壳聚糖酶,酶活力,青霉属,血散薯
中图分类号:Q939.99
文献标识码:A
文章编号:1000-3142(2020)09-1332-09
Abstract:Endophytic fungi are good sources for exploring high diversity of chitosanase and discovering new enzymes. In this study,chitosanase-producing strains were screened and identified from 122 endophytic fungi associated with citrus and Stephania dielsiana,and the factors affecting the activity of chitosanase were preliminarily studied,in order to provide an experiment basis for further study on the enzymatic properties and the interaction between chitosanase-producing endophytic fungi and host plant resistance to diseases. Two endophytic fungi Stdif9 and Stdif9-4 were found to produce chitosanase by transparent circle method and liquid fermentation method. The highest activity of Stdif9-4 (0.968 U·mL-1) was significantly higher than that of Stdif9 (0.780 U·mL-1). Stdif9-4 was identified as Penicillium sp. Stdif9-4 by morphological method and sequencing analysis of ITS gene. The factors affecting on the chitosanase activity were studied by DNS reagent method. The results showed that the chitosanase activity reached maximum at 96 h of cultivation. In addition,among the nine metal ions,Mn2+ and Ca2+ had obvious activation effect on chitosanase activity. Ag+,Zn2+,Cd2+,Ba2+ and Fe3+ had different inhibitory effects on chitosanase activity,and Ag+ showed more significant inhibitory effect,while K+ and Na+ did not show significant effect on enzyme activity. There was no significant differences in enzyme activity between different cultured generations,which indicate that the enzyme activity is stable.
Key words:plant endophytic fungi,chitosanase,enzyme activity,Penicillium,Stephania dielsiana
自1973年Monaghan et al.(1973)首先報道了壳聚糖酶(chitosanase)是一种不同于几丁质酶的新酶以来,壳聚糖酶的基础与应用研究已成为目前的研究热点。壳聚糖酶不水解胶态几丁质,但能够水解完全脱乙酰化的壳聚糖,所以该酶被认为是专一性水解线性壳聚糖的酶,主要存在于真菌、细菌及植物中(鲁晶娣等,2018)。近年来,大量研究表明,壳聚糖酶可以作为生物防治剂,能提高植物的抗病能力,与细胞壁的降解、营养代谢等均密切相关,在回收利用甲壳素中的氮和碳素等方面也起着重要的作用(Kouzai et al.,2012;Thadathil & Velappan,2014;Radhakrishnan et al.,2017;鲁晶娣等,2018)。此外,其水解产物壳寡糖具有抗菌、抗肿瘤、抗氧化、促进伤口愈合等多种独特的生理活性和功能,在医药、食品、化妆品等领域中具有广阔的应用前景(Aam et al.,2010;Park & Kim,2010;Jaiswal et al.,2019)。
不同微生物来源的壳聚糖酶的种类及性质具有较大差异。植物内生真菌是探索不同种类壳聚糖酶及发现新酶的资源宝库(Rajulu et al.,2011;Venkatachalam et al.,2015)。目前,对植物内生真菌壳聚糖酶的研究仍然极少。植物内生真菌是指在其生活史中的某一阶段或全部阶段生活在健康植物体各类组织内而不引起宿主植物产生明显病害症状、与宿主植物互惠共生的真菌(Abdalla & Matasyoh,2014)。Rajulu et al.(2011)首次从陆生植物内生真菌中筛选产几丁质修饰酶的菌株,发现其中37%的内生真菌可产生多种类型的壳聚糖酶。Venkatachalam et al.(2015)从海藻和海草的117株内生真菌中发现41%的菌株产生的壳聚糖酶可水解脱乙酰度为56%的壳聚糖,66%的菌株产生的壳聚糖酶可水解脱乙酰度为38%的壳聚糖,56%的菌株产生的壳聚糖酶可水解脱乙酰度为1.6%的壳聚糖。Rajulu et al.(2011)和Venkatachalam et al.(2015)的研究均发现来源于不同植物的同种内生菌的酶具有高度多样性。
植物中普遍含有内生真菌,种类繁多。从植物内生真菌中筛选产壳聚糖酶菌株将有利于发现种类丰富多样的壳聚糖酶,也将有利于水解产生多种不同类型的壳寡糖,为农业、医药业及食品工业等提供更多有利资源。本研究从柑橘和血散薯的122株内生真菌中筛选产壳聚糖酶的菌株,初步研究酶活力影响因素,为后续进一步研究其酶学特性和功能、明确产壳聚糖酶内生真菌与宿主植物互作关系等奠定基础。
1 材料与方法
1.1 植物内生真菌
122株植物内生真菌为广西师范大学珍稀濒危动植物生态与环境保护教育部重点实验室化学生态实验室前期从健康柑橘(Citrus spp.)和血散薯(Stephania dielsiana)植株中分离得到。柑橘样品采自广西桂林(110°19′44″ E、25°16′13″ N,110°16′36″ E、25°11′5″ N)、梧州(111°1′18″ E、23°29′46″ N);血散薯采自广西来宾市金秀瑶族自治县(109°59′34″ E、24°16′10″ N)。
1.2 仪器和试剂
主要仪器:超净工作台ZHJH-C1112C,上海智城;恒温培养箱,韶关泰宏医疗器械;恒温摇床LYZ-2102C,上海龙跃;生物显微镜DM3 000,德国徕卡;紫外可见光分光光度计UV-1 200,上海美普达。主要药品试剂:DNS试剂(购自优品实验室),壳聚糖(分子量29万,脱乙酰度95%,购自浙江玉环澳兴甲壳素有限公司),盐酸溶液(购自西陇科学股份有限公司),氢氧化钠(购自西陇科学股份有限公司),金属离子盐(所用的离子Na+、K+、Ca2+、Mn2+、Zn2+、Cd2+、Ba2+和Fe3+均为氯盐,Ag+为AgNO3)。
1.3 培养基
1.3.1 活化培养基 用于菌种从低温保存条件转到室温条件的活化适应,采用马铃薯葡萄糖琼脂培养基(PDA):去皮的马铃薯20%,葡萄糖2%,琼脂2%,pH 7.0,121 ℃高温高压灭菌20 min。
1.3.2 种子培养基 种子液同1.3.1,仅不添加琼脂。
1.3.3 产壳聚糖酶菌株筛选培养基 参考张涛(2005)的方法,配制初筛和复筛诱导培养基。
A组分:1%胶体壳聚糖,pH 5.6。B组分:酵母粉0.1%,K2HPO4·3H2O 0.3%,KH2PO4 0.2%,MgSO4·7H2O 0.14%,NaCl 0.1%,KCl 0.1%,CaCl2 0.02%,琼脂2%。C组分:土豆汁20%,葡萄糖0.2%,蛋白胨0.5%,酪蛋白0.2%,酵母浸膏0.5%,pH 5.6。以上A、B、C组分均单独灭菌。其中,将A、B两溶液等体积混合制得初筛固体培养基;将A、C两溶液等体积混合制得复筛液体发酵培养基。
1.4 产壳聚糖酶菌株筛选
1.4.1 初筛(透明圈法筛选) 在超净工作台中,用无菌打孔器(直径4 mm)在已活化的内生真菌菌落边缘取菌饼,转接至初筛培养基平板上,每皿接1块菌饼,设置3个重复,于28 ℃培养,每天观察菌株生长情况,并在有透明圈产生时,采用十字交叉法测量相应透明圈直径(D)和菌落直径(d),记录数据并拍照,计算D/d比值。挑选产透明圈明显的菌株,进一步摇培发酵检测酶活。
1.4.2 复筛 在超净工作台中,向装有100 mL种子培养基的三角瓶(250 mL)中转接3块活化的菌饼,设置3个重复,28 ℃、150 r·min-1振荡培养3 d,获得种子液。用移液枪吸取2 mL种子液接入装有100 mL复筛培养基的三角瓶(250 mL)中,设置3个重复,28 ℃、150 r·min-1振蕩培养3 d后,测定壳聚糖酶活力。
1.5 菌株鉴定
采用形态学结合分子生物学的方法对产壳聚糖酶的菌株进行鉴定。形态学鉴定菌株主要是通过不同的培养基(CA、PDA、CYA及G25N)对内生真菌进行培养,参考《真菌鉴定手册》(魏景超,1979)、《中国真菌志》(孔华忠,2007)及相关文献对其进行初步鉴定。鉴定特征包括菌落大小、形态、生长速率、边缘特征、菌落及培养基基质颜色,以及菌落在显微镜下的特征(如菌丝有无分隔、分支,分生孢子形态、大小,产孢结构特征等)。分子生物学鉴定菌株主要是利用真核生物在rDNA的ITS区段具有保守性和特异性序列的特性,以真菌通用引物ITS1和ITS4扩增菌株ITS碱基序列,委托北京六合华大基因科技有限公司武汉分公司进行检测纯化及测序。将获得的测序结果与NBCI数据库中的序列进行BLAST比对,选择相似度较高,亲缘关系近的菌株比对,并用MEGA Ⅹ软件,对ITS碱基序列进行聚类分析,Bootstrap进行自展次数为1 000的置信度检测,根据系统发育树中的组群关系对菌株进行分类。
1.6 壳聚糖酶活力测定
1.6.1 氨基葡萄糖标准溶液 准确称取0.863 g氨基葡萄糖盐酸盐(105 ℃烘至恒重),置于小烧杯中,加少量蒸馏水溶解后,转移到容量瓶中,用蒸馏水定容至1 000 mL,混匀,配制成4 μmol·mL-1氨基葡萄糖标准溶液,置于4 ℃冰箱中保存备用。
1.6.2 氨基葡萄糖标准曲线绘制 取6支洗净的10 mL试管,依次加入0、0.2、0.4、0.6、0.8、1.0 mL浓度为4 μmol·mL-1的氨基葡萄糖标准溶液,均加蒸馏水至1 mL,再分别加入1 mL DNS试剂,放入100 ℃的水中反应10 min后取出。冷却后,加蒸馏水定容至10 mL,混匀。在520 nm波长处,以0号管调节零点,测定其他号试管溶液的吸光值。重复3次测量,计算出每支试管吸光值的平均值。
1.6.3 DNS法测壳聚糖酶活力 参考胡远亮(2007)和刘昌燕等(2009)的方法,具体操作如下:首先,取0.5 mL发酵上清液和0.5 mL 1%胶体壳聚糖溶液,在50 ℃下保温60 min。然后,向试管中加入1 mL DNS试剂终止反应,并转至沸水中反应10 min,反应结束后用流动自来水进行降温。最后,向试管中分别加入蒸馏水至每管溶液体积为10 mL。以煮沸失活的酶液作为对照,用分光光度计测量520 nm处的吸光值(OD520),根据氨基葡萄糖标准曲线方程计算出其对应的氨基葡萄糖浓度。按照以下公式计算酶活力:酶活力=(测定样组的还原糖量-对照样组的还原糖量)×2(稀释倍数)/60(时间)。酶活力定义为每毫升发酵液每分钟产生1 μmol还原糖所需的酶量为一个酶活力单位(U)。
1.7 菌株Stdif9-4产酶曲线测定
参照毛贵珠等(2012)的方法,并进行适当改良,按照1.4.2的操作方法,将种子液接入250 mL三角瓶中,每菌接3瓶,28 ℃、150 r·min-1振荡培养,分别于24、48、72、96、120 h取发酵液离心(4 000 r·min-1,15 min),按照1.6.3方法测定上清液酶活力。
1.8 金属离子对菌株Stdif9-4酶活力的影响
分别配制浓度为100 mmol·L-1的金属离子(Na+、K+、Ag+、Ca2+、Mn2+、Zn2+、Cd2+、Ba2+和Fe3+)溶液,然后分别向混有0.5 mL发酵上清液和0.5 mL 1%胶体壳聚糖溶液的试管中加入上述金属离子溶液0.1 mL。按照1.6.3的方法测定酶活力,每个样品做3个平行实验。以不加金属离子的空白对照组酶活力为100%,在金属离子存在条件下的实验组酶活力相对于空白对照组酶活力的比例即为添加金属离子后的相对酶活力(高剑锋等,2012)。即相对酶活力=实验组酶活力/空白对照组酶活力。
1.9 菌株Stdif9-4酶活力稳定性测定
将菌株连续传代培养五代,分别测定每代菌株产壳聚糖酶活力,以判断菌株产酶活力是否稳定。从保种管内挑出Stdif9-4菌丝进行活化,作为第一代,培养3 d即转接至新的PDA培养基内,新转接菌株继续培养3 d,作为第二代,再转接,以此类推,至第五代。
2 结果与分析
2.1 氨基葡萄糖标准曲线方程
建立的氨基葡萄糖标准曲线方程为y=0.164 1x-0.003 3(R2=0.999 1),其中x为氨基葡萄糖浓度,y为不同浓度的氨基葡萄糖溶液的吸光值。
2.2 产壳聚糖酶内生真菌筛选
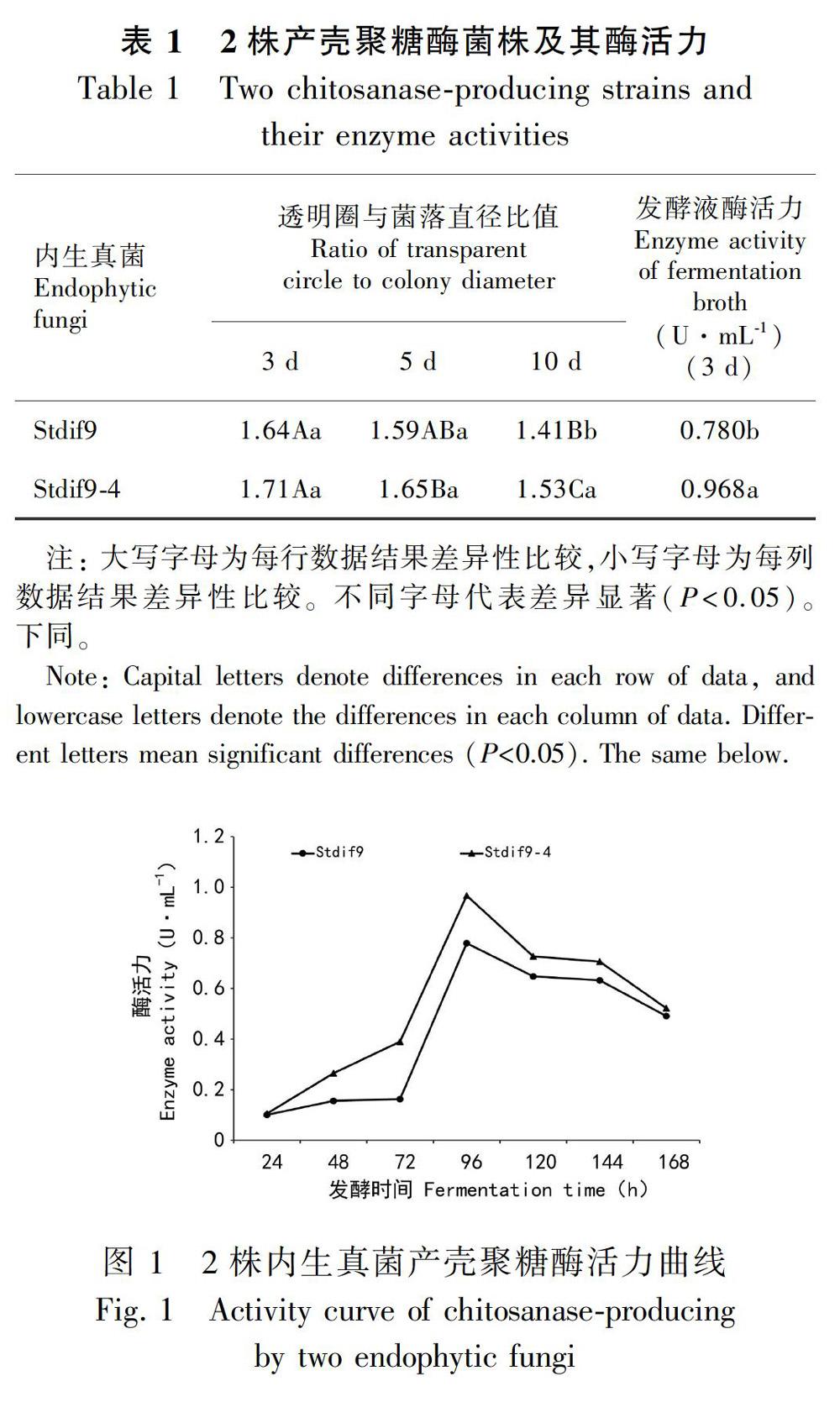
利用透明圈法,通过大量筛选,初步确定透明圈直径/菌落直径较大的2株内生真菌Stdif9和Stdif9-4(均分离自血散薯块根)为产壳聚糖酶较好的菌株。进一步测定2株内生真菌Stdif9和Stdif9-4发酵液(培养3 d)的壳聚糖酶活力,结果如表1所示。发酵培养3 d的内生真菌Stdif9和Stdif9-4对95%脱乙酰度壳聚糖有较好的酶解作用,其壳聚糖酶活力分别达到0.780和0.968 U·mL-1,Stdif9-4壳聚糖酶活力显著高于菌株Stdif9的。
2.3 2株内生真菌产壳聚糖酶活力曲线
分别测定内生真菌Stdif9和Stdif9-4在摇培24、48、72、96、120、144、168 h后的产酶活力,以确定其产壳聚糖酶活力最佳培养时间,结果如图1所示。2株内生真菌在前72 h产酶活力均较低,72 h后产酶活力迅速增加,并均在96 h时产酶活力达到最大值,96 h之后产酶活力开始逐渐降低。从酶活力曲线可知,在不同的培养时间段,Stdif9-4菌株产酶活力均高于Stdif9。因此,后续选取Stdif9-4进行进一步研究。
2.4 内生真菌Stdif9-4的鉴定
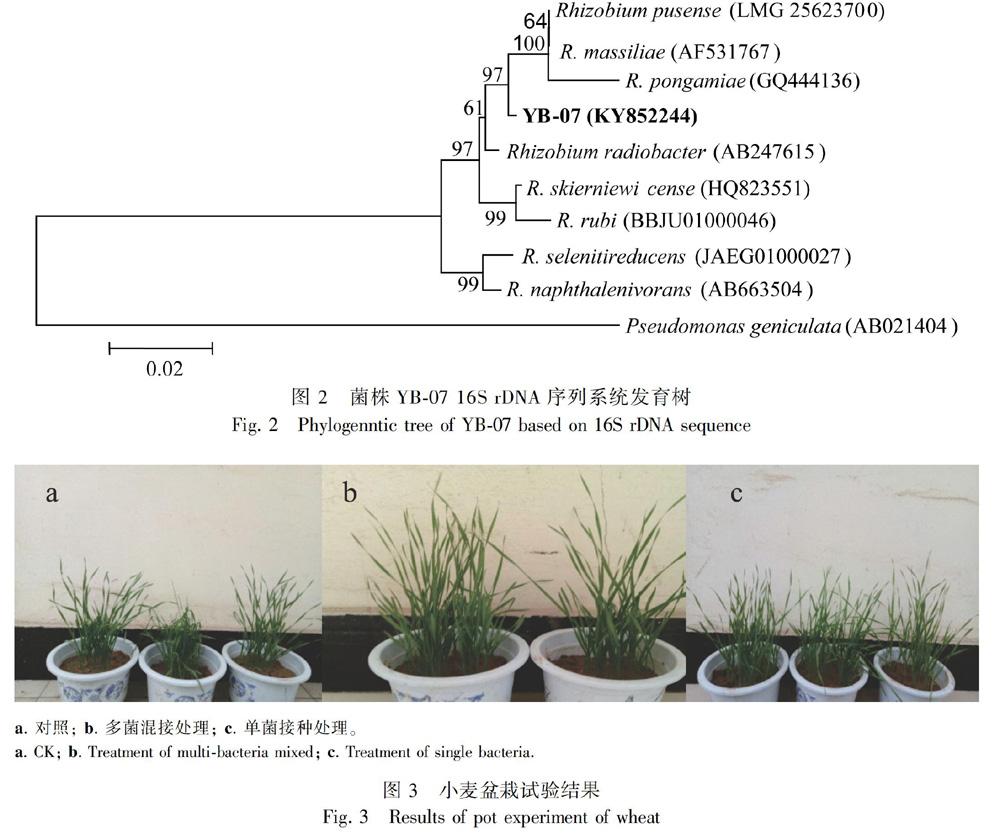
采用形态学和分子生物学方法对内生真菌Stdif9-4进行鉴定。参考《中国真菌志》(孔华忠,2007),根据显微形态图(图2),其分生孢子梗上只有一个分枝点,此分枝点上为单轮生的帚状枝;分生孢子梗和分子孢子表面平滑;分生孢子球形或近球形。结合Stdif9-4在不同培养基上的菌落直径(表2)和菌落形态(图3)初步确定内生真菌Stdif9-4为青霉属(Penicillium)菌株。结合分子生物学鉴定,将其测序结果与GenBank中的序列进行比对,发现其ITS序列与Penicillium sp.的相似性高达100%。因此,将Stdif9-4鉴定为Penicillium sp. Stdif9-4(GenBank登录号为MN238849)。
2.5 金属离子对内生真菌Stdif9-4壳聚糖酶活力影响
在确定Stdif9-4壳聚糖酶活力最高的发酵时间(96 h)的基础上,测定了9种金属离子(Na+、K+、Ag+、Ca2+、Mn2+、Zn2+、Cd2+、Ba2+和Fe3+,浓度均为100 mmol·L-1)对酶活力的影响,结果如表3所示。Mn2+和Ca2+对Stdif9-4所产的壳聚糖酶活力具有明显的激活作用;Ba2+和重金属离子Ag+、Zn2+、Cd2+、Fe3+對壳聚糖酶活力都有不同程度的抑制作用,其中Ag+的抑制作用最为显著;K+和Na+对壳聚糖酶活力无显著影响。
2.6 內生真菌Stdif9-4产壳聚糖酶稳定性测定
将内生真菌Stdif9-4转接继代培养五代,分别测定相应发酵液壳聚糖酶活性,发现酶活性无显著差异(图4)。图4结果表明该菌株产酶活力比较稳定。
3 讨论与结论
通过平板初筛和液体复筛,从122株内生真菌中筛选到了2株产壳聚糖酶的菌株。采用形态学结合分子生物学的方法对其中产酶活力较高的菌株进行鉴定,将其归为青霉属。目前,人们从植物内生真菌中筛选产壳聚糖酶菌株的研究较少,主要还是从土壤、海洋等环境中进行筛选(Zitouni et al.,2017;Chien et al.,2018;Fukamizo & Shinaya,2019),而且发现的产酶菌株大多数为青霉属(Penicillium)或曲霉属(Aspergillus)(曾嘉,2002;郑连英和隋斯光,2004;卓少玲,2012;单秋实,2015)。本研究筛选到的产壳聚糖酶的内生真菌Penicillium sp. Stdif9-4也为青霉属菌株,分离自我国重要药用植物血散薯块根。由于不同来源的壳聚糖酶的酶学性质往往有较大差异,Penicillium sp. Stdif9-4来源于药用植物,其特殊的生境是否会使得其壳聚糖酶的结构、功能有别于其他环境菌株,其对壳聚糖的作用类型是内切型还是外切型等,后期还需进一步研究。此外,不同培养基及不同营养成分配比对不同菌株的生长及酶的诱导往往有不同程度的影响,在进行初筛的过程中,由于只用了一种选择培养基,这很可能会导致漏筛一部分产壳聚糖酶的菌株。因此,后期可尝试多种含壳聚糖的培养基进行筛选。
发酵时间对壳聚糖酶活力有显著影响。Peni-cillium sp. Stdif9-4产壳聚糖酶活力在前72 h均较低,72 h后迅速增加,并在96 h时达到最大值,随后逐渐降低。这与张翔等(2018)、张子瑞(2016)报道的结果相似。与之相应的,王钦宏和蔡静平(2000)发现产酶活力最高时,培养液中活菌数也达到了最高水平,并确定3 d为适宜的收获时间。推测可能因为在发酵初期,培养基内的营养物质充裕,菌体大量繁殖,产生大量的壳聚糖酶,后期由于营养物质的减少及菌体进入衰亡期,壳聚糖的产生也随之减少(熊妍妍等,2018)。本文仅研究了发酵时间对壳聚糖酶活力的影响,接种量、培养基各营养成分(如碳源、氮源等)以及培养条件(如温度、pH等)等因素也均可影响壳聚糖酶活力,后期可利用单因素实验结合正交实验或响应面分析等进行综合分析,以确定最有效促进产壳聚糖酶活力提高的条件。
大部分壳聚糖酶活性均可受金属离子的影响。本研究使用8种氯盐分别提供了8种金属离子(Na+、K+、Ca2+、Mn2+、Zn2+、Cd2+、Ba2+及Fe3+)和AgNO3提供Ag+,考察不同金属离子对酶活力的影响。其中,Mn2+和Ca2+对Stdif9-4壳聚糖酶活力具有明显的激活作用。相似的,单秋实(2015)研究发现金属离子Mn2+、Ca2+对来源于土壤的青霉(Penicillium sp. QS7)壳聚糖酶活力也具有促进作用;卓少玲(2012)也发现Ca2+对来源于土壤的青霉(Penicillium sp. M-2)壳聚糖酶活力具有促进作用。Mn2+和Ca2+对大多数微生物来源的壳聚糖酶活性具有激活作用(曾嘉,2002;郝日光,2005;段妍,2006)。Ba2+和重金属离子Ag+、Zn2+、Cd2+、Fe3+对壳聚糖酶活力具有不同程度的抑制作用,K+和Na+对壳聚糖酶活力无显著影响。这与大多数微生物来源的壳聚糖酶一致(逄玉娟,2004;段妍,2006;游清徽,2006;王艳君等,2012;张翔等,2018),但也有部分金属离子对不同来源的壳聚糖酶活力起着相反的作用,如在单秋实(2015)的报道中,Zn2+对来源于土壤的青霉菌(Penicillium sp. QS7)壳聚糖酶活力具有促进作用。金属离子对酶的影响机制,可能与金属离子和底物壳聚糖形成稳定的复合物有关(陈小娥,2004);或金属离子通过参与壳聚糖酶活性中心的构建,结合酶活性中心以外的部位,增大酶与底物之间的亲和力,使酶活力得到增强(Chen et al.,2005;杨立红等,2013);或由于金属离子通过螯合作用,影响酶的构象,干扰酶对底物的降解作用,从而导致酶活力下降(王艳君等,2012)。并且,不同作用条件如温度、pH、酶的浓度、底物浓度以及金属离子本身的浓度都会影响其作用效果。后期应对以上作用条件进行优化,并进一步研究不同金属离子对菌株壳聚糖酶活力影响机制。
综上所述,本研究从血散薯内生真菌中筛选到产壳聚糖酶活力稳定的青霉属菌株,并初步研究了影响酶活力的因素。后期将进一步研究壳聚糖酶的酶学性质,对菌株产壳聚糖酶活力的最佳培养条件进行优化,进一步明确金属离子促进壳聚糖酶活力的最佳浓度、复合效应及其作用机制,并测定壳聚糖酶及其水解产物的抗菌活性或诱导活性,及探究其与宿主植物病害防御互作关系。
参考文献:
AAM BB,HEGGSET EB,NORBERG AL,et al.,2010. Production of chitooligosaccharides and their potential applications in medicine [J]. Mar Drugs,8(5):1482-1517.
ABDALLA MA,MATASYOH JC,2014. Endophytes as producers of peptides:An overview about the recently discovered peptides from endophytic microbes [J]. Nat Prod Bioprospect,4(5):257-270.
CHIEN D,THI T,VAN N,et al.,2018. Reclamation of marine chitinous materials for chitosanase production via microbial conversion
by Paenibacillus macerans [J]. Mar Drugs,16(11): 429-451.
CHEN XE,2004. Study on the characterization and mechanism of chitosanases from Aspergillus sp. [D]. Wuxi:Jiangnan University. [陈小娥,2004. 曲霉产壳聚糖酶酶学性质及作用机理研究 [D]. 无锡:江南大学.]
CHEN XE,XIA WS,YU XB,2005. Purification and characterization of two types of chitosanase from Aspergillus sp. CJ22-326 [J]. Food Res Int,38(3):315-322.
DUAN Y,2006. Study on optimal fermentation conditions of a chitosanase-producing bacterium,purification and characte-rization of the chitosanase [D]. Qingdao:Ocean University of China. [段妍,2006. 产壳聚糖酶菌株的发酵条件优化、壳聚糖酶的分离纯化与酶学性质研究 [D]. 青岛:中国海洋大学.]
FUKAMIZO T,SHINAYA S,2019. Chitin/chitosan-active enzymes involved in plant-microbe interactions [J]. Adv Exp Med Biol,1142(12):253-272.
GAO JF,LI WX,LI HL,et al.,2012. Screening and enzymatic characteristic of a cellulase producing strain [J]. Hubei Agric Sci,51(8):1566-1568. [高劍锋,李文鑫,李汇龙,等,2012. 一株产纤维素酶菌株的筛选及酶学性质 [J]. 湖北农业科学,51(8):1566-1568.]
HAO RG,2005. Breeding of chitosanase-producing strains,optimization of fermentation conditions and study on enzymatic properties [D]. Qingdao:Ocean University of China. [郝日光,2005. 产壳聚糖酶菌株的选育、发酵条件优化和酶学性质的研究 [D]. 青岛:中国海洋大学.]
HU YL,2007. Screning of chitosanase-producing mutant and study on its fermentation technology [D]. Wuhan:Huazhong Agricultural University. [胡远亮,2007. 产壳聚糖酶菌株的选育及产酶发酵工艺研究 [D]. 武汉:华中农业大学.]
JAISWAL S,TRIPATHI P,SINHA S,2019. Biocatalytic production of hetero-chitosan oligosaccharides as anti-oxidants [J]. Sustain Agric Rev,35:125-146.
KONG HZ,2007. Flora fungorum sinicorum [M]. Beijing:Science Press:35:112-115. [孔华忠,2007. 中国真菌志 [M]. 北京:科学出版社,35:112-115.]
KOUZAI Y,MOCHIZUKI S,SAITO A,et al.,2012. Expression of a bacterial chitosanase in rice plants improves disease resistance to the rice blast fungus Magnaporthe oryzae [J]. Plant Cell Rep,31:629-636.
LIU CY,JIN L,LIU YY,et al.,2009. Screening of chitosanase-producing fungi from soil [J]. Chin J Microecol,21(9):776-778. [刘昌燕,金玲,刘颖颖,等,2009. 土壤中产壳聚糖酶真菌的筛选 [J]. 中国微生态学杂志,21(9):776-778.]
LU JT,WEI PQ,ZHANG XM,et al.,2018. Research progress of chitosanase [J]. Chin Cond,43(12):168-173. [鲁晶娣,韦盘秋,张兴猛,等,2018. 壳聚糖酶的研究进展 [J]. 中国调味品,43(12):168-173.]
MAO GZ,ZHANG HM,SHAO YF,et al.,2012. Screening and identification of chitosanase-producing microorganisms from soil and optimization of the fermentation conditions [J]. Hubei Agric Sci,56(10):1913-1917. [毛贵珠,章晔敏,邵一凡,等,2012. 产壳聚糖酶土壤微生物的筛选鉴定及发酵条件优化 [J].湖北农业科学,56(10):1913-1917.]
ZENG J,2002. Purification and immobilization of chitosanase from Penicillium sp. ZDZ1 [D]. Hangzhou:Zhejiang University. [曾嘉,2002. 青霉屬菌株产壳聚糖酶的分离纯化及固定化的研究 [D]. 杭州:浙江大学.]
ZHANG T,2005. Purification and characterization of a novel chitosanase from Metarhizium guizhouense in solid-state fermentation [D]. Chengdu:Sichuan University. [张涛,2005. 产壳聚糖酶真菌的筛选与绿僵菌固态发酵以产壳聚糖酶以及酶的分离纯化和性质研究 [D]. 成都:四川大学.]
ZHANG X,ZHANG YH,LIU XY,et al.,2018. Optimization of fermentation conditions of the chitosanase-producing strain ncps116 and enzymatic properties of the chitosanase [J]. Chem Ind Eng Prog,37(6):2354-2363. [张翔,张彦昊,刘孝永,等,2018. 产壳聚糖酶菌株ncps116发酵条件优化及其酶学性质 [J]. 化工进展,37(6):2354-2363.]
ZHANG ZR,2016. Identification,fermentation and characte-rization of a marine bacterium Y-116 producing chitosanase [D]. Shanghai:Shanghai Ocean University. [张子瑞,2016. 一株产壳聚糖酶的海洋菌株Y-116的鉴定、产酶条件和酶学性质研究 [D]. 上海:上海海洋大学.]
ZHENG LY,SUI SG,2004. Screening and mutagenesis of chitosanase-producing strain and study on the optimal conditions of chitosanase formation [J]. J Zhejiang Univ (Eng Sci Ed),38(8):106-109. [郑连英,隋斯光,2004. 产壳聚糖酶菌株的诱变育种及其产酶条件研究 [J]. 浙江大学学报(工学版),38(8):106-109.]
ZHUO SL,2012. Screening of chitosanase-producing strain and research on immobilization of chitosanase [D]. Fuzhou:Fujian Normal University. [卓少玲,2012. 壳聚糖酶产生菌株的筛选及酶的固定化研究 [D]. 福州:福建师范大学.]
ZITOUNI M,VIENS P,GHINET MG,et al.,2017. Diversity of family GH46 chitosanases in Kitasatospora setae KM-6054 [J]. Appl Microbiol Biotechnol,101:7877-7888.
(责任编辑 周翠鸣)

