大豆对菲胁迫的生理响应及耐菲机理研究
杨丹 王罡 王戊腾 樊亚君 肖薇薇 张思琪 李倩 季静
(天津大学环境科学与工程学院,天津 300072)
多 环 芳 烃(Polycyclic aromatic hydrocarbons,PAHs)是一种存在于空气、土壤及水体环境中,具有毒性,且高度持久的污染物[1]。据报道,在中国长江三角洲地区就存在着多环芳烃污染的问题[2]。伴随着人类城市化和工业化进程的推进,人类活动,例如日常生活中汽车尾气以及工业“三废”的大量排放[3]所造成的碳基燃料消耗量日益增加,致使多环芳烃在全球环境中的含量与日俱增,且分布愈加广泛。环境中的多环芳烃大多存在于地表土壤中,土壤中的多环芳烃会被植物吸收,从而对植物的生长造成伤害[4-5]。与此同时,空气中的多环芳烃也同样会被植物叶片吸收[6-7]。菲(Phenanthrene,Phe)是含有3个苯环的煤焦油加工产品之一,也是最简单的非线性多环芳烃之一。菲在工业中具有广泛的应用,如可用于制造染料及树脂等。然而,菲会对人类的健康造成影响,其已经被世界卫生组织列为了致癌物质。
近年来,对多环芳烃污染环境的修复也逐渐成为研究的热点,植物修复作为一种低成本且环境友好的环境治理技术正在受到积极的关注[8]。Yin等[9]的研究表明,大豆在较低pH(4.5)及较高浓度的菲(0.8-1.2 mg /L)胁迫处理下,其细胞质膜具有较强的去极化,H+-ATPase的活性更高,转运蛋白与菲的亲和力更大,从而促使大豆可以吸收更多的菲。由此可见,大豆是可以进行菲污染修复的重要植物。此外大豆也是我国重要的粮食作物,是我国农业发展的重要支柱[10]。然而,大豆作为潜在的菲污染修复植物,其对菲的生理响应以及应对菲胁迫的防御机制,人们还知之甚少。现有研究表明,生长于较高浓度多环芳烃污染环境中的水稻的水含量、生物量、光合色素含量、电解质渗透率、抗氧化酶活性以及可溶性蛋白含量等都受到影响[11]。较高浓度的多环芳烃胁迫会影响大豆幼苗的发芽势、最终发芽率、胞间CO2浓度、叶绿素含量以及荧光强度[12]。鉴于此,本研究以菲作为多环芳烃的模式污染物,通过对菲胁迫下植物的生物量变化、光合色素含量变化、氧化损伤程度以及抗逆系统的活性等方面进行分析,研究菲对植物生长的影响,探究大豆响应多环芳烃胁迫的生理机制,为利用植物进行多环芳烃污染土壤的修复提供理论依据。
1 材料与方法
1.1 材料
本研究所选用的大豆(合丰25)种子由本实验室保存。选取籽粒饱满、大小均匀的大豆种子使用15% NaClO浸泡15 min后使用无菌水冲洗3次,随后将消毒后的种子置于无菌水中暗培养4 d。待种子生根后移至1/2 Hoagland 营养液中,使用16 h光照/8 h黑暗的光照周期,于25℃环境中培养。
1.2 方法
1.2.1 植物的胁迫处理 待大豆幼苗长出第一对真叶后,选取长势相似的幼苗移至Hoagland培养液。试验中使用甲醇配制100 mmol/L的菲母液,并在随后的试验中使用甲醇将母液稀释至25 μmol/L(P25),50 μmol/L(P50),75 μmol/L(P75),100 μmol/L(P100)。使用不同浓度的菲溶液,对叶片进行隔天喷施处理,每次喷施2 mL处理液。其中CK组作为对照组喷施等量的甲醇作为对照。取处理后第10天的幼苗进行随后的生理数据的测定。
1.2.2 生物量指标的测定 鲜重(FW)的测量:选取待测植株,清水洗净后,用滤纸吸干植物表面水分后称量。干重(DW)的测量:将新鲜的植株样品于105℃下杀青10 min,随后保持80℃恒温将样品烘干至恒重。
1.2.3 叶片相对含水量的测定 饱和鲜重(TW)的测定:取样品顶端叶片并将叶子漂浮在含有蒸馏水且密闭的培养皿中3 h至叶片恒重后取出,使用滤纸吸干叶片表面水分后称量,计为饱和鲜重。随后,按照公式计算叶片的相对含水量(RWC):RWC=(FW-DW)/(TW-DW)×100%[13]。
1.2.4 MDA含量的测定 将新鲜叶子0.1 g,使用0.2 mol/L磷酸盐缓冲溶液(PBS)研磨,加入硫代巴比妥酸,并充分混匀。将匀浆物在100℃加热15 min,然后在4℃以10 000 r/min离心10 min。使用岛津UV-2550紫外分光光度计测定上清液在600 nm,532 nm和450 nm处的吸光值,计算叶片中的MDA含量[14]。
1.2.5 光合色素含量的测定 本研究使用的叶绿素测定方法与Ma等[15]报道的相似。取新鲜植物叶片0.1 g,将叶片剪碎后浸没在3 mL 95%乙醇中48 h,至叶片完全变成白色。8 000 r/min离心5 min后,取上清液测定其在665 nm,649 nm及470 nm下的吸光度,计算总叶绿素及类胡萝卜素含量。
1.2.6 抗氧化酶活性的测定 取新鲜叶片0.1 g,使用2 mL浓度为10 mmol/L,pH为7.2的磷酸缓冲液充分研磨。将匀浆液在4℃下10 000 r/min离心15 min,取上清作为酶提取液备用。叶片中超氧化物歧化SOD酶活性使用硝基四氮唑蓝(NBT)光化还原法进行测定。叶片中POD酶活性使用愈创木酚法进行测定[14]。
1.2.7 渗透胁迫物质含量的测定 叶片中的脯氨酸含量测定时,使用酸性茚三酮法[14]。取0.1 g叶片置于3 mL的3%的磺基水杨酸中,沸水浴10 min。随后将其与2 mL的2.5% 的酸性茚三酮,以及2 mL的冰醋酸混合均匀后,置于沸水中40 min。随后迅速等却反应液,并向其中加入4 mL甲苯,混合均匀后静置,直至分层明显,取上层液体测定520 nm下的吸光值。
1.2.8 数据处理 采用Spss 18.0及单因素分析方法进行统计学分析,使用Origin 9.0进行图表的绘制。
2 结果
2.1 菲对大豆幼苗生物量的影响
表1显示了不同浓度的菲对大豆幼苗的叶片及根部生物量的影响。由表1可知,与对照相比,在较低浓度的菲(≤25 μmol/L)处理时,叶片及根的鲜重与干重均有明显的升高,这说明低浓度的菲对大豆叶的生物量有明显的促进作用。当菲的浓度上升到50 μmol/L时,叶片的的生物量有所提高。当菲的浓度达到100 μmol/L时,大豆叶片生物量都有明显的降低,表现为抑制作用。而随着菲浓度的增大,根部的生物量与对照相比,尽管差异不明显,但仍呈现出下降的趋势。
2.2 菲对大豆叶片相对含水量的影响
不同浓度的菲胁迫对大豆叶片水分含量的影响如图1所示。由图可知,随着菲浓度的增加,大豆叶片的含水量表现出先增加后降低的趋势,在50 μmol/L的菲存在时,植株叶片的含水量达到最高。当菲的浓度高于50 μmol/L时,叶片的相对含水量明显降低,当处理浓度达到100 μmol/L时,叶片的相对含水量降到最低。
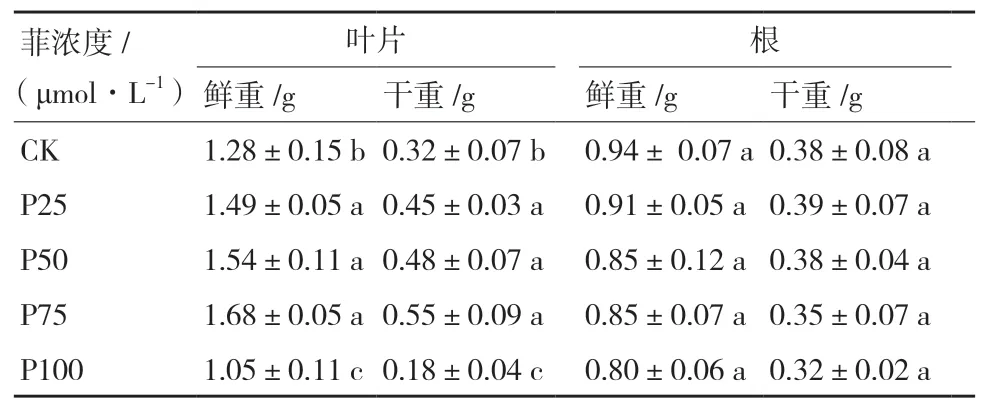
表1 不同浓度菲胁迫对大豆生物量的影响
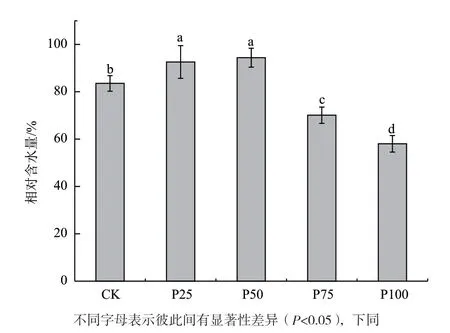
图1 不同浓度的菲胁迫对大豆叶片相对水含量的影响
2.3 菲胁迫下大豆叶片损伤程度情况
图2为在不同浓度的菲胁迫下,叶片受到损伤的程度。结果显示,植物叶片中MDA含量随着菲处理浓度的增大而逐渐增大。当在100 μmol/L处理浓度下,MDA的含量最大,其MDA的含量是CK的2.77倍。
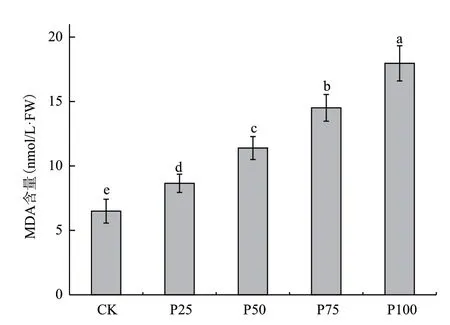
图2 不同浓度菲胁迫下叶片MDA含量差异
2.4 菲胁迫对大豆光合色素的影响
由图3-A可知,随着菲浓度的增大,叶绿素的含量先升后降,在50 μmol/L处理下达到最高。当处理浓度大于50 μmol/L后,叶绿素的浓度逐渐降低,在100 μmol/L处理下达到最低。类胡萝卜素是另外一类参与植物光合作用的重要色素。图3-B显示,随着菲浓度的提高,叶片的类胡萝卜素的含量较CK组虽然没有明显差异,但呈现升高趋势,当菲的处理浓度达到75 μmol/L时达最高,为CK组的1.81倍。而当菲处理浓度达到100 μmol/L时,类胡萝卜素的含量则表现出了降低的趋势,尽管不明显但仍然高于CK组,为CK组的1.37倍。
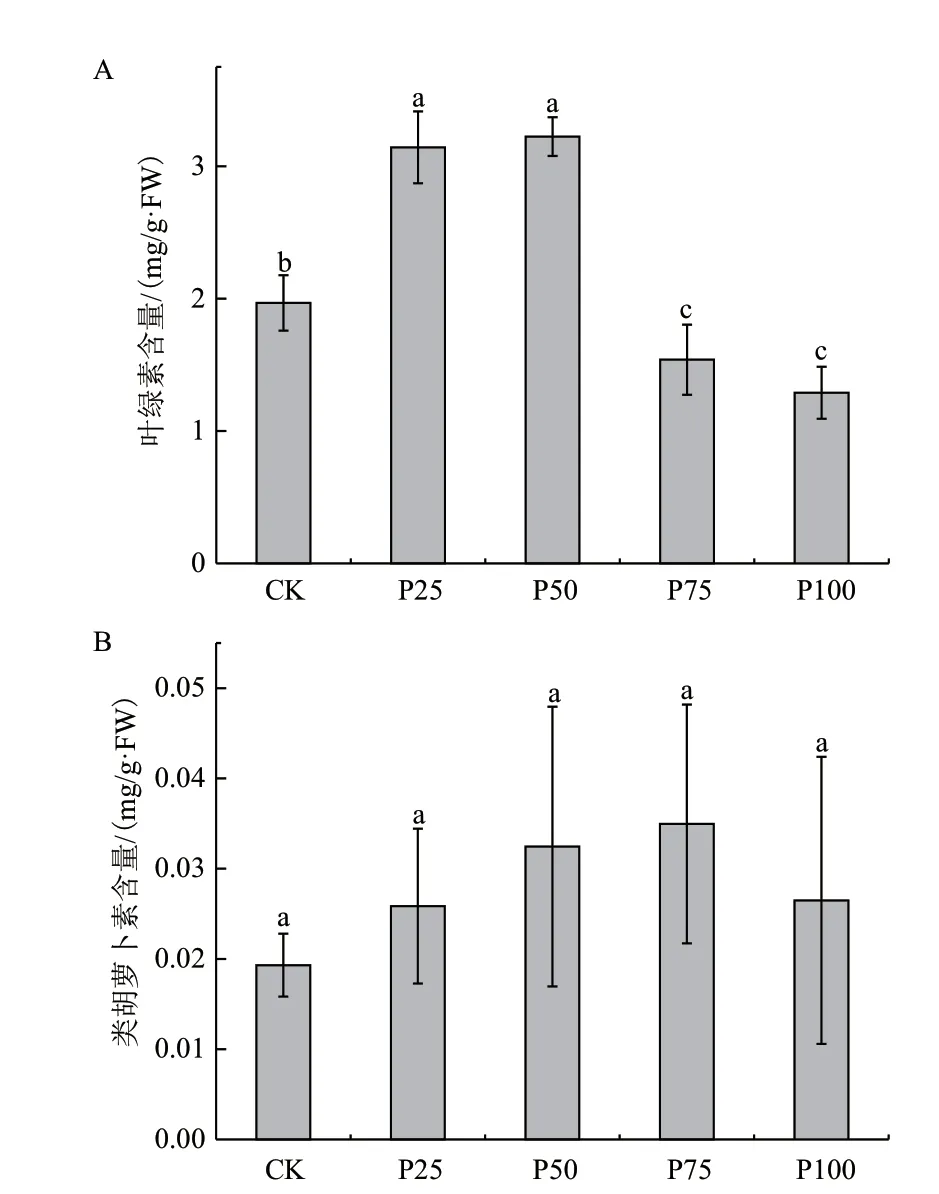
图3 不同浓度菲处理对光合色素含量的影响
2.5 菲胁迫对大豆叶片抗氧化酶活性的影响
由图4-A可见,培养液中添加低浓度的菲时,大豆叶片中的SOD酶活随着菲浓度的增加而提高。与对照相比,当使用0-50 μmol/L菲处理大豆时,SOD的活性逐渐升高,在菲浓度达到50 μmol/L时,SOD的酶活性达到最大,是CK组的2.03倍。随着菲浓度的继续增大,SOD的活性则逐渐降低。当菲浓度为100 μmol/L时,降至最低,且低于对照。
菲处理下POD的酶活性同样受到影响。由图4-B可知,随着菲浓度的增加,POD的活性逐渐升高,且明显高于对照,且在75 μmol/L时达到最大值。继续增加菲的浓度到100 μmol/L,POD的活性则表现出了下降的趋势,其活性仍然明显高于CK组。
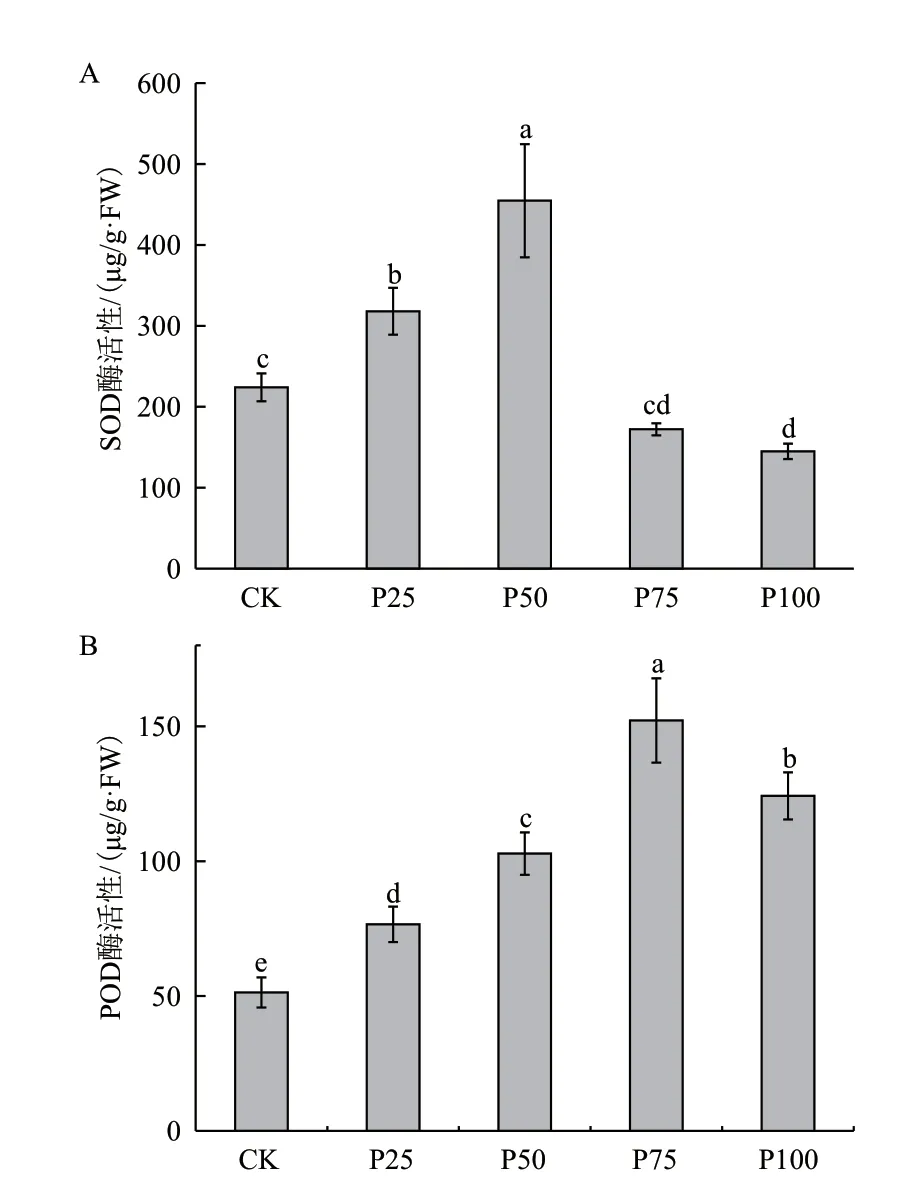
图4 不同浓度的菲处理对叶片SOD及POD酶活性的影响
2.6 菲胁迫下大豆叶片中游离脯氨酸的积累
图5显示了在不同浓度的菲胁迫下,叶片中游离脯氨酸的积累情况。如图所示,叶片中脯氨酸的含量随着菲处理浓度的增高而逐渐升高。当菲的浓度小于50 μmol/L时,虽然差异不明显,但非处理下脯氨酸含量的含量仍高于CK组。当菲浓度高于50 μmol/L时,与CK组相比,出现明显差异。在菲浓度达到100 μmol/L时,叶片中脯氨酸的含量达到最高。
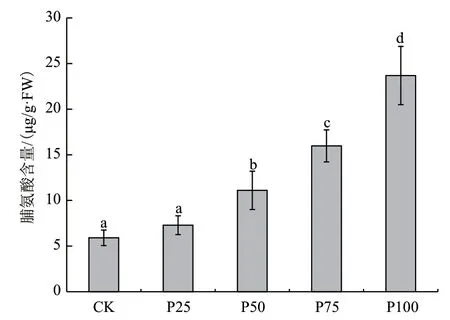
图5 不同浓度菲胁迫下叶片脯氨酸含量差异
3 讨论
多环芳烃是一类广泛存在的环境危害性污染物,植物会通过菲/氢质子泵同向转运系统(PHE/nH+symport)等方式将菲运送到植物体内,并对植物的生长产生危害[16-17]。试验结果显示,大豆幼苗中叶片的相对含水量随着叶施菲处理浓度的增加表现出先增加后降低的趋势,这与李玉龙等[18]的研究结果相似。本研究还发现,使用较低浓度的菲(≤25 μmol/L)处理植物时,叶片的干重与鲜重都有显著增加。而使用较高浓度的菲(≥75 μmol/L)处理植物时,则生物量明显下降。而在中浓度的菲(25-75 μmol/L)处理下叶片的生物量则保持较稳定的增长,而对植物根部的生物量的影响不大。这与钟建丹等[19]在研究不同浓度菲对水稻幼苗生长时,以及Chiapusio等[20]在研究菲对黑麦草(LoliumperenneL.)和红车轴草(Trifolium pratenseL.)的影响时的研究结果相似,即低浓度的菲会促进植物生物量的增加,而高浓度的菲则会造成明显的生物量的下降。这些结果表明,叶片施用不同浓度的菲会对植物叶片的含水量以及生物量产生影响。拟南芥受到胁迫产生的活性氧簇会氧化质膜并最终转化为MDA,导致菲胁迫的拟南芥中MDA的含量会随着菲浓度的增加而升高[21]。本研究的结果显示,幼苗叶片中的MDA含量随着菲处理浓度的增加而持续升高。此前的研究结果表明,生长于菲污染土壤中的大豆幼苗的MDA含量随着菲浓度的增加(0-200 μg/g)以及胁迫时间的延长(0-8 d)表现出显著的升高[22],与本研究的结果一致。以上的研究结果说明,叶片施以不同浓度的菲会造成植物叶片中MDA的积累,进而影响了植物体内水分及养分的运输,造成了叶片水分含量的降低,以及生物量的减小。
菲的添加会对叶片中的叶绿素含量造成影响[21]。本研究显示,叶片中叶绿素的含量在菲的胁迫下,以50 μmol/L的菲浓度为分界,呈现出了先升高后降低的趋势。有报道称,在菲处理下,叶绿素合成和降解都会得到增强,但速率不同,而叶片的颜色表现是叶绿素的合成和降解的综合结果[23]。因此,在较低菲浓度时,可能是叶绿素的合成速率高于降解速率,表现出了叶绿素含量的提高。而当菲浓度继续加大,叶绿素的合成速率低于降解速率,最终呈现出叶绿素含量的降低。这说明菲胁迫会造成植物叶片中叶绿素含量的改变,并通过迫影响了叶片的光合色素含量等,进而影响了植物体内水分及养分的运输,造成了叶片水分含量的降低,以及生物量的减小。此外,大豆叶片中的类胡萝卜素含量先上升后降低,但始终高于CK组,这与Shen等[24]的研究结果相一致。此外,在研究外源施加类胡萝卜素对菲胁迫小麦的影响时,发现类胡萝卜素的添加恢复了小麦叶片中的叶绿素组成以及MDA含量[23],这也证实了类胡萝卜素在抵御菲胁迫中的重要作用。这些结果表明,在菲胁迫下,叶片中的类胡萝卜素可能通过帮助维持光合作用以及降低膜氧化损伤程度来克服菲胁迫对植物生长造成的影响。
SOD酶是参与菲积累的小麦叶片中ROS清除的最有效的抗氧化剂[25]。POD酶作为ROS清除剂,其活性在菲胁迫时较敏感[26]。研究表明抗氧化酶的活性伴随着ROS的产生而增强[27]。本试验结果显示,SOD的活性在菲的浓度高于50 μmol/L后,出现了下降趋势,当菲的浓度达到100 μmol/L时,SOD的活性都有显著的降低,这说明在高浓度的菲处理下,SOD受到了更严重的ROS攻击,酶活性逐渐受到抑制,甚至失活[28]。Liu等[22]研究中发现,使用较低浓度菲(50 μg/g)处理大豆幼苗时,其SOD活性总体呈现上升趋势;而使用较高浓度菲(100 μg/g以及200 μg/g)胁迫大豆幼苗时,幼苗中的SOD酶的活性总体随着处理时间的延长呈现先上升后降低的趋势。这与本研究的结果相似,即随着菲处理浓度的升高,大豆叶片中的SOD酶活性先升高再降低。于此同时,随着菲浓度的升高,POD的酶活性始终高于对照组,这说明在较高浓度菲胁迫下,POD发挥了主要的抗氧化功能。而由于较高的POD活性,有效地减轻植物体受到的氧化胁迫,从而减缓了菲对大豆幼苗的伤害。当菲的浓度高于75 μmol/L时,POD的活性出现了下降的趋势,说明当环境中的菲浓度的持续增加,也会导致POD酶的失活,并最终影响到植物的生长。这些结果表明,植物叶片在受到直接的菲胁迫时,会通过提高酶的活性来抵御低浓度菲胁迫造成的损伤。SOD以及POD酶在克服菲胁迫时发挥了很重要的抗氧化作用。且本研究结果发现,在较高浓度的菲处理下,POD酶的作用更明显。
逆境胁迫会促使植物积累大量的脯氨酸以降低渗透胁迫造成的伤害,因此,植物体内脯氨酸的含量能够反映出植物受到逆境胁迫的强弱。傅聿青等[29]在研究不同浓度的盐对不同品种桑树的影响时,发现了其脯氨酸的含量随盐处理浓度增加而增加的情况。本研究结果显示,植物中脯氨酸的含量与MDA含量的变化趋势相似,即随着菲处理浓度的增加而逐渐升高,这说明随着菲浓度的增加,植物受到的渗透胁迫等也越来越强,并且植物会通过合成脯氨酸等物质来抵御菲胁迫造成的渗透胁迫。
4 结论
叶片喷施菲会对植物的生长造成不利影响。本研究结果表明,当大豆叶面喷施的菲浓度低于50 μmol/L时会提高植物生物量、类胡萝卜素含量、SOD以及POD酶活性,但仍然会造成叶绿素含量的降低、MDA的积累以及脯氨酸含量的升高。高浓度的菲(75-100 μmol/L)下类胡萝卜素含量、POD酶活性以及脯氨酸含量始终保持较高水平,但同样会降低幼苗生物量、叶绿素含量以及SOD酶活性,并增加MDA的积累。

