人CSE 蛋白的结构与功能分析
袁小燕,王 烨,刘艳萍,雷媛娣,张朝晖
(南华大学 公共卫生学院预防医学系,湖南 衡阳,421001)
硫化氢(H2S)是第三个气体信号分子。大量研究表明,H2S参与心血管重构、细胞增殖、迁移和侵袭、氧化应激和炎症等生物学过程[1-3]。内源性H2S主要由L-半胱氨酸经胱硫醚-β-合成酶(Cystathionine-β-synthase,CBS)、胱硫醚-γ-裂解酶(Cystathionine-γ-lyase,CSE)和3-巯基-丙酮酸硫转移酶(3-mercaptopyruvate sulfurtransferase,3-MST)[4-5]三种酶催化生成。而肺组织内源性硫化氢主要由胱硫醚-γ-裂解酶(CSE)在细胞浆里以L-半胱氨酸为底物催化产生[6]。有研究报道用H2S进行预处理可以减轻氧化应激和内质网应激介导的肺损伤[7],当暴露于烟草烟雾时缺乏CSE的小鼠表现出气道阻塞、气道高反应性和肺部炎症等疾病[8]。也有研究证实增加大鼠CSE表达和H2S生成可促进机体抗氧化、抗炎作用的发挥进而减轻移植性肺损伤[9]。本研究同样表明H2S对大鼠肺组织急性损伤具有保护作用[10]。许多证据表明CSE/H2S体系广泛参与了细胞的生物过程,通过调控CSE的表达从而增加肺部H2S生成有可能减轻或治愈慢性肺部疾病。
鉴于CSE蛋白的重要功能,且对于CSE蛋白的结构和功能研究尚不完善。利用生物信息学方法对人CSE蛋白进行理化性质,结构及功能分析,为深入研究CSE的作用机制提供基础。
1 材料与方法
1.1 人CSE蛋白序列
在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的蛋白质数据库( https: / / www.ncbi.nlm.nih.gov /)中以“cystathionine-γ-lyase+物种名”为关键词,搜索并下载人CSE蛋白的氨基酸序列( NCBI:CTH序列号: NP_001177392.1Gene ID:1 491)。
1.2 人CSE蛋白的理化性质预测
使用在线工具ExPASy-ProtParam Tool (https://web.expasy.org/protparam/)对人CSE蛋白的分子式、等电点,酸碱性和稳定性等理化性质进行分析;利用Protscale (https://web.expasy.org/protscale/)对人CSE 蛋白进行疏亲水性分析;使用TMHMM Serverv2.0(http://www.cbs.dtu.dk/services/TMHMM/)在线分析人CSE蛋白跨膜结构;使用SignalP-4.1(http://www.cbs.dtu.dk/services/SignalP-4.0/)在线预测人CSE蛋白有无信号肽及切割位点。
1.3 人CSE蛋白的结构域、亚细胞定位和磷酸化位点预测
利用NCBI CDD (https://www.ncbi.nlm.nih.gov/guide/domains-structures/)在线预测人CSE蛋白结构域;使用PSORT II Prediction(https://www.genscript.com/psort.html)及Gene card(https://www.genecards.org/)在线预测人CSE蛋白亚细胞定位;利用Netphos3.1(http://www.cbs.dtu.dk/services/NetPhos/)和Scansite 4.0 (https://scansite4.mit.edu/4.0/#home)在线预测人CSE蛋白磷酸化位点。
1.4 人CSE蛋白的二级结构及高级结构分析
用ExPAsy-GOR IV4.0在线工具(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)和PredictProtein(https://www.predictprotein.org/)预测人CSE蛋白的二级结构;用SWISS-MODEL(https://swissmodel.expasy.org/)构建人CSE蛋白的三级结构。
1.5 人CSE蛋白的相互作用蛋白预测
使用STRING数据库(https://string-db.org/),设置为高置信度0.7,不限制数量,在线预测人CSE蛋白互作网络。
2 结果与分析
2.1 人CSE蛋白理化性质结果分析
经ExPASy-ProtParam Tool 预测发现:人CSE 蛋白由 373个氨基酸组成,位于人类1号染色体,分子质量为41 260.23 ku,理论等电点为6.38,负电荷氨基酸残基数为39个,正电荷氨基酸残基数为34个,分子式为C1 839H2 883N501O542S18,原子总数为5 783个,不稳定系数为35.0(<40)属于稳定蛋白,脂肪系数为87.32,总平均亲水系数为-0.160。
2.2 人CSE蛋白亲水/疏水区域结果分析
经Protscale预测发现:人CSE蛋白亲水性最强的位点为第31位的谷氨酰胺,分值为-2.5;疏水性最强的位点是第191位的脯氨酸和第192位的甘氨酸,分值为1.978,亲水性值总和大于疏水性值总和(见表1),由图1可知,CSE序列中亲水区域多于疏水区域,据此推断CSE蛋白属于亲水性蛋白,这与理化性质分析结果一致。
2.3 人CSE蛋白跨膜结构结果分析
经TMHMM预测发现人CSE蛋白位于膜外(见图2粉色细线)的概率几乎为100%,位于膜内(见图2蓝色细线)和跨膜区域(见图2红色细线)的概率几乎为0。粉色粗线代表多肽链中跨膜区域所在位置,因CSE蛋白没有跨膜区域,所以不显示相应标记,据此推断人CSE蛋白不属于跨膜蛋白。

表1 人CSE 蛋白亲水性与疏水性氨基酸残基预测Table 1 Hydrophilic and hydrophobic amino acid residue prediction of human CSE protein

图1 人 CSE 蛋白亲水性/疏水性预测Fig.1 Hydrophilic / hydrophobic prediction of human CSE protein
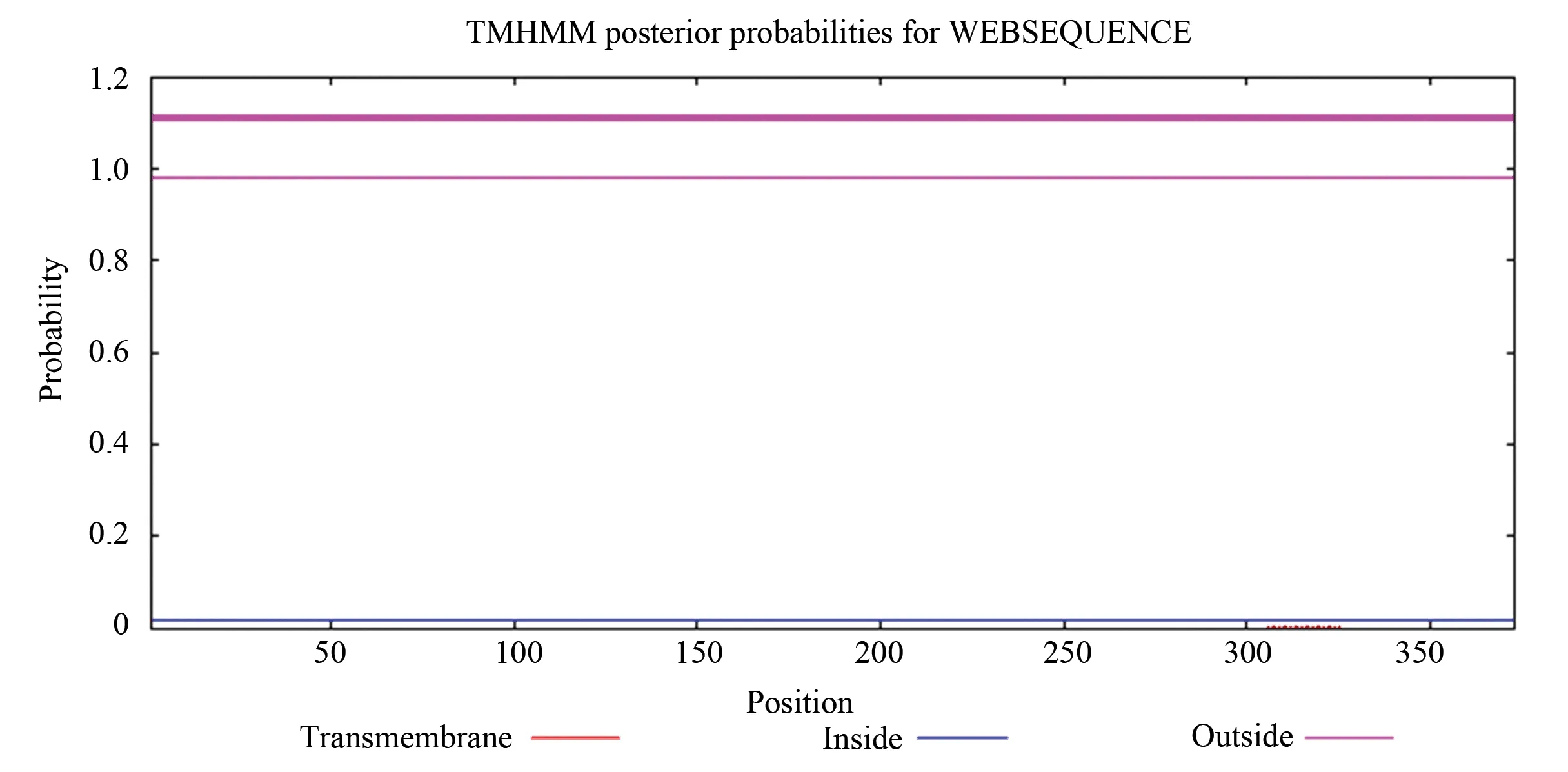
图2 人CSE 蛋白跨膜结构分析Fig.2 Transmembrane domains analysis of human CSE protein
2.4 人CSE蛋白信号肽切割位点结果分析
经SignalP-4.1(cut-off值设置为0.45)预测发现:人CSE蛋白无信号肽序列,属于非分泌蛋白。原始切割位点C值在第23位氨基酸,分值为0.124;被结合的剪切点Y值最高点在第23位氨基酸,分值为0.117;信号肽S值最高点位于第3位氨基酸,分值为0.140;位于1-22位氨基酸序列的平均信号肽分值为0.111,D值为0.114,不足以形成信号肽区域(见表2和图3)。

表2 人CSE蛋白信号肽切割位点预测Table 2 Signal peptide cleavage site prediction of human CSE protein

图3 人CSE 蛋白信号肽预测Fig.3 Signal Peptide prediction of human CSE protein
2.5 人CSE蛋白二级结构分析
利用ExPAsy-GOR IV4.0和PredictProtein两种工具预测人CSE蛋白二级结构,并绘制结构模型。经GOR预测发现人CSE蛋白一共有373个氨基酸,该序列主要含有Alpha helix螺旋,Extended strand延伸链和Random coil无规则卷曲,其中α螺旋(见图4蓝色)有112个氨基酸,占30.03%,β折叠(见图4红色)有71个氨基酸,占19.03%,无规则卷曲(见图4紫色)有190个氨基酸,占50.94%。
经PredictProtein预测发现CSE蛋白序列中α螺旋占38.87%,β折叠占16.62%,无规则卷曲占44.50%。ExPAsy-GOR IV4.0和PredictProtein预测结果比对表明,两种预测工具所预测的结果基本吻合,都表明CSE蛋白的二级结构以无规则卷曲为主。
在图4中,上部:示意图;下图:高峰数字。蓝色:α螺旋;红色:β折叠;紫色:无规则卷曲。
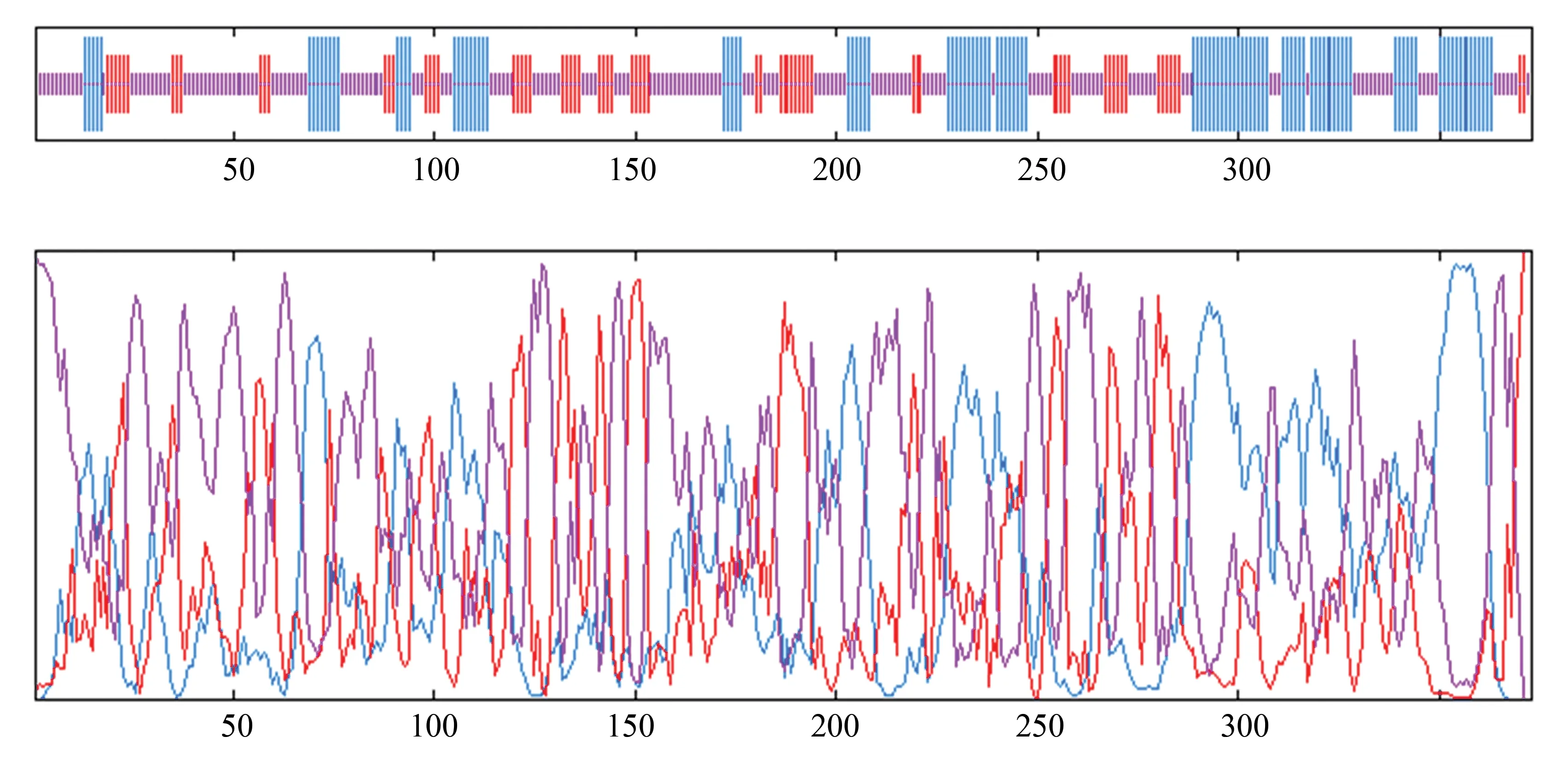
图4 人CSE蛋白二级结构分析Fig.4 Secondary structure analysis of human CSE protein
2.6 人CSE蛋白结构域结果分析
经NCBI CDD预测发现人CSE蛋白在19-347位氨基酸处含有保守结构域,属于PLP(磷酸吡哆醛)依赖性酶家族,该家族包括参与半胱氨酸和蛋氨酸代谢的酶并且都以PLP作为辅助因子(见图5)。
2.7 人CSE蛋白亚细胞定位结果分析
利用PSORT II Prediction和Gene card两种软件预测人CSE蛋白亚细胞定位,经PSORT预测发现CSE蛋白有52.2%可能存在于细胞质,有30.4%可能存在于细胞核,有17.4%可能存在于线粒体,说明CSE蛋白位于细胞质的可能性最大,Gene card预测发现CSE蛋白在细胞质中的得分最高 (见图6)两种软件的亚细胞定位结果相一致,据此推断CSE蛋白存在于细胞质中。

图5 人CSE 蛋白结构域预测Fig.5 Conserved domains prediction of human CSE protein
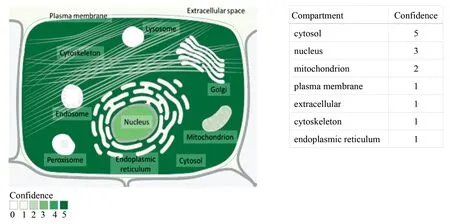
图6 人CSE 蛋白亚细胞定位预测Fig.6 Subcellular localization prediction of human CSE protein
2.8 人CSE蛋白磷酸化位点结果分析
利用Netphos3.1和Scansite 4.0 两种软件预测人CSE蛋白磷酸化位点。
经Netphos3.1预测发现CSE蛋白质有15个丝氨酸(Ser)磷酸化位点,13个苏氨酸(Thr)磷酸化位点及5个酪氨酸(Tyr)磷酸化位点(见图7)。
经Scansite 4.0预测发现CSE蛋白质有29个丝氨酸(Ser)磷酸化位点,21个苏氨酸(Thr)磷酸化位点和9个酪氨酸(Tyr)磷酸化位点。两种软件都表明CSE蛋白含有丝氨酸磷酸化位点最多。

图7 人CSE蛋白磷酸化位点预测Fig.7 Phosphorylation sites prediction of human CSE protein
2.9 人CSE蛋白三级结构分析
利用SWISS-MODEL预测人CSE蛋白的三级结构,GMQE为0.97,QMEAN为-0.54,序列与BLAST数据库中5tsu.1模板序列相似性高达99.19%,表明该模型结构合理,该蛋白质存在较多扭曲,结构较丰富,这对其生物学功能具有重要作用(见图8)。

图8 人CSE蛋白三级结构预测Fig.8 Tertiary structure prediction of human CSE protein
2.10 人CSE蛋白互作网络分析
使用STRING预测人CSE蛋白互作网络,设置为高置信度0.7,限制数量10个。结果发现人CSE蛋白与DLD、TST、CBSL、TXNRD1等蛋白质具有相互作用(见图9)。对以上互作蛋白的基因进行GO分析和KEGG通路分析,GO分析结果表明互作基因主要参与辅因子结合、维生素结合和催化活化等分子功能(见表3)涉及硫氨基酸代谢过程、硫氨基酸生物合成、α-氨基酸生物合成、细胞氨基酸代谢等生物过程(见表4)。KEGG通路分析结果显示,互作基因显著富集于半胱氨酸与蛋氨酸代谢、甘氨酸、丝氨酸和苏氨酸代谢、氨基酸生物合成、硒化合物代谢等通路中(见表5)。

图9 人CSE蛋白的相互作用网络预测Fig.9 Protein-protein interaction network predictionof human CSE protein

表3 GO分子功能分类结果Table 3 GO molecular function results

表5 KEGG pathway 路径列表Table 5 KEGG pathway lists
3 讨 论
胱硫醚-γ-裂合酶(cystathionine-γ-lyase,CSE)是转硫途径的最后一个关键酶,参与硫化氢(H2S)和谷胱甘肽(GSH)的生成,调节氧化还原平衡,是重要的抗氧化分子[11],然而CSE表达异常调节氧化还原稳态失衡可以引起慢性阻塞性肺病(COPD)、哮喘[12]以及急性肺损伤[13]等疾病。因此对于CSE蛋白功能的研究非常重要。本研究基于生物信息学方法,分析人CSE蛋白的结构和分子功能,结果显示:人CSE蛋白位于人类1号染色体上的短臂上。含有373个氨基酸,是稳定的亲水性蛋白,不具有跨膜结构,无信号肽属于非分泌性蛋白,蛋白定位于细胞质的可能性大提示该蛋白质可能主要在细胞质发挥生物学作用。具有大量的丝氨酸(Ser)磷酸化位点和较少的酪氨酸(Tyr)磷酸化位点、蛋白二级结构以无规则卷曲为主推测无规则卷曲是CSE蛋白主要的二级结构原件。结构域预测发现人CSE蛋白属于PLP依赖性酶的异亚家族,CSE是由两个二聚体组成的四聚体,每个单体都有三个独立的域:(I)较大的N-末端结构域,它是活性二聚体内相邻单体的活性位点的一部分、(II)携带大多数催化重要残基的PLP结合结构域和(III)C-末端结构域[14]。每个单体共价结合一个PLP辅助因子,通过Schiff碱与活性位点赖氨酸结合发挥生物学效应[15]。
蛋白质的磷酸化会影响蛋白质的活性,从而使其执行不同的生理功能。本研究发现人CSE蛋白含有33个磷酸化位点,其中Ser/Thr位点较多,推测丝氨酸/苏氨酸最有可能参与其蛋白质磷酸化。有研究表明PKC通过丝氨酸/苏氨酸蛋白质底物磷酸化可以转导细胞信号并在细胞信号作用下调节细胞生长、代谢、凋亡、分化、增殖和迁移运动[16-17]。CSE是一种硫转移酶,在活性位点具有活性半胱氨酸残基,负责稳定酶的结构及其功能。有研究证实Ser77突变会减弱组成四聚体结构的两个二聚体之间的相互作用而影响该酶的稳定性[18],也有研究报导CSE Ser磷酸化可以调节内皮细胞H2S的快速释放从而发挥心血管保护作用[19]和维持心肺平衡[20],因此推测CSE的丝氨酸/苏氨酸磷酸化是诱导细胞迅速产生H2S减轻氧化应激的关键点。
通过对人CSE蛋白的GO分析和KEGG分析可知互作基因主要参与辅因子结合和催化活化等分子功能涉及氨基酸代谢等生物过程,显著富集于半胱氨酸与蛋氨酸代谢等通路中。因此,CSE与互作蛋白中的TST、TXNRD1之间的关系值得探讨。CSE、TST和MST在L-半胱氨酸的厌氧、脱硫和代谢中发挥重要作用。研究发现TXNRD1(硫氧还蛋白还原酶1)是细胞氧化应激反应和细胞内RON水平控制的重要组成部分[21]。TST(硫代硫酸盐转移酶)是一种单结构域胞质硫转移酶,也被认为在硫代硫酸盐氧化合成谷胱甘肽过硫化物的过程中起一定作用,在不利生理条件下,例如硫缺乏或存在过氧化物时,TST表达增加发挥细胞保护作用[22]并在线粒体基质中进行后续加工[23]在硫代谢、铁硫簇形成[24-25]等多种途径中发挥作用。包括CSE在内的硫转移酶可以在活性氧含量增加的情况下局部防止-SH基团的可逆氧化,并可调节体内GSH水平来平衡氧化还原状态维持钙稳态[26]。由此说明CSE蛋白与相互作用蛋白的作用及参与的硫代谢途径具有一定的研究价值,有助于阐明CSE蛋白的作用机制和生理功能。
通过生物信息学方法对人CSE蛋白进行预测和分析,对明确CSE作用的分子机制具有参考意义。
- 生物信息学的其它文章
- mRNA序列与相应内含子序列匹配的普适性分析

