人参皂苷Rg3联合紫杉醇抑制人肝癌细胞HepG2增殖和对裸鼠移植瘤模型的作用机制研究
张奉海,张瑞荣,陈淑娟,王金红,于永兰
(山东省日照市莒县中医医院,山东 日照 276500)
紫杉醇(paclitaxel,Taxol)是从中药红豆杉中提取的抗肿瘤活性成分,在抗肿瘤方面具有显著的疗效[1],可有效抑制癌细胞的增殖扩散,在多种癌症的治疗上取得了一定的疗效,但是其潜在的不良反应及耐药性使得紫杉醇的使用受到了一定的限制[2]。人参皂苷Rg3(Ginsenoside-Rg3,GS-Rg3),是从中药人参中提取的单体,国内外许多实验和临床研究发现具有抗肿瘤的作用,目前人参皂苷Rg3对胃癌、肺癌、肝癌、胰腺癌、大肠癌等肿瘤方面的实验研究较多,但是对于人参皂苷Rg3联合紫杉醇治疗肝癌方面的研究较少[3-5]。
本实验旨在通过人参皂苷Rg3联合紫杉醇抗肝癌的体内外研究,初步探讨两药联合是否具有协同抑制肝癌细胞的作用,为临床应用人参皂苷Rg3联合紫杉醇治疗肝癌提供基础理论及实验依据。
1 材料
1.1 主要试剂
人参皂苷Rg3(瑞锦生物技术有限公司,纯度>99%,批号JZ15110202);紫杉醇(山东博科生物,纯度>98%,批号A0820a);DMEM (山东博科生物,批号20170521);MTT(山东博科生物,批号20180607)。
1.2 主要仪器
CO2培养箱(Thermo,型号LHH.CP-250-Q);倒置显微镜(上海精密仪器仪表公司,型号XDS-1A);H2050R台式低速离心机(湖南湘仪实验室仪器开发有限公司);多功能酶标仪(美国Thermo公司);电泳仪(美国Bio-Rad公司);暗盒(上海百研生物科技有限公司)。
1.3 动物及细胞株
人肝癌HepG2细胞株(中国科学院生命科学研究所);无特定病原体(SPF)级BALB/cA-nu裸鼠40只,体质量(100±20)g,购于山东医科大学动物实验中心。
2 方法
2.1 细胞的培养
肝癌细胞培养于含10%的胎牛血清的DMEM培养基或1640培养基,并加入1%青霉素和链霉素,置于37 ℃、5% CO2培养箱中培养,倒置显微镜观察细胞生长状态,1~2 d更换培养基1次,每2~3 d加入胰酶进行消化,传代。
2.2 人肝癌细胞HepG2裸鼠移植瘤
取“2.1”项培养的对数生长期的细胞,在低速离心机(1 000 r/min,5 min)上离心,制成浓度为1×106/mL的混悬液。蘸取碘伏消毒裸鼠右腋下部位,使用1 mL一次性无菌注射器抽取0.2 mL混悬液注入此处皮下,5~7 d内即可触及皮下有结节,2周左右可见肿瘤形成,选择瘤体直径为(65±5)mm的裸鼠移植瘤模型纳入下一步实验。
2.3 分组及给药
将造模成功的40只裸鼠随机分为4组:对照组,生理盐水0.2 mL,灌胃;人参皂苷Rg3组,GS-Rg3:10 mg/(kg·d),灌胃;紫杉醇组,Taxol:10 mg/kg,腹腔注射,每周2次;联合组,GS-Rg3+Taxol,给药剂量和方法同上。每组10只,给药3周后,颈椎脱臼处死,分离瘤体组织。
2.4 抑瘤率
取“2.3”项分离的瘤体组织,计算各实验组的肿瘤体积(V)、相对肿瘤体积(RTV)及相对肿瘤抑制率(T/C)。具体计算方式[6]如下:
肿瘤体积(V)=(a×b2)/2
相对肿瘤体积(RTV)=Vt/ V0
相对肿瘤抑制率(T/C)=(1-TRTV/ CRTV)×100%
其中a为肿瘤的最长直径,b为垂直于a的最短直径;V0为首次给药前的肿瘤体积;Vt为每次测量的体积;TRTV为给药组的相对肿瘤体积;CRTV为对照组的相对肿瘤体积。
2.5 MTT检测细胞的增殖
将肝癌细胞随机分为对照组(正常培养)、人参皂苷组(10、20、40、80、100 μg/mL)、紫杉醇组(80 μg/mL)、联合组给药剂量同上;调整各组细胞至合适浓度,接种于96孔板上,置于培养箱中培养0、24、48、96 h后,每孔细胞加入20 μL MTT,37 ℃孵育4 h,每孔加入200 μL DMSO,置于酶标仪中检测细胞在570 nm的吸光值。
2.6 Western blot实验检测细胞凋亡
加入裂解液,提取总蛋白,测定其浓度,并与适量上样缓冲液混合均匀,沸水加热10 min,变性;将配置好的聚丙烯酰胺凝胶放入电泳槽,加入电泳液,微量移液器吸取40 μg总蛋白加入上样孔中,电泳至蓝色条带分离后调整电压,待蓝色条带到达凝胶底部,切断电源,准备转膜。将PVDF膜浸泡与甲醛中,然后在预冷的电转缓冲液中处理5 min,将PVDF膜与凝胶贴合,不要产生气泡,两侧覆盖滤纸,转膜;转膜完毕后将PVDF膜浸泡与5%的脱脂奶粉溶液中,促进非特异性蛋白结合位点封闭;根据抗体说明书稀释抗体,与PVDF膜4 ℃孵育过夜,37 ℃水浴复温1 h,TBST漂洗2次,每次5 min,加入二抗,37 ℃孵育PVDF膜2 h,TBST漂洗2次,每次5 min,避光,加入ECL液孵育5 min,凝胶成像仪中拍照,Quantity One分析蛋白质灰度值。
2.7 统计学分析
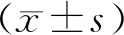
3 结果
3.1 人参皂苷Rg3联合紫杉醇对人肝癌细胞HepG2增殖的抑制作用
MTT结果如表1 所示,人参皂苷Rg3(10、15、30、60、120 μg/mL)联合紫杉醇(80 μg/mL)分别处理肝癌HepG2细胞24、48、72 h后,对其增殖作用均有不同程度的抑制作用。与24 h处理组比较,紫杉醇联合人参皂苷Rg3(30、60 μg/mL)在48、72 h后对肝癌HepG2细胞增殖的抑制作用显著升高(P<0.05);与48 h处理组比较,紫杉醇联合人参皂苷Rg3(30、60、120 μg/mL)在72 h后对肝癌HepG2细胞增殖的抑制作用显著升高,差异有统计学意义(P<0.05)。
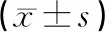
表1 不同剂量人参皂苷Rg3联合紫杉醇对人肝癌细胞HepG2各时间点的MTT结果
3.2 人参皂苷Rg3联合紫杉醇对人肝癌细胞HepG2裸鼠移植瘤体内抗肿瘤作用
各实验组小鼠体内肿瘤的生长情况和肿瘤抑制率分别见图1和图2。由图可见,相比于对照组,给予不同药物处理均可抑制小鼠体内肿瘤的生长,其中联合给药组抑制作用最为明显。由图2可以看出,在给药14 d后,人参皂苷Rg3联合紫杉醇组肿瘤抑制率(64.13±2.02)%较人参皂苷Rg3组(48.34±3.86)%和紫杉醇组(54.21±3.21)%显著升高,差异有统计学意义(P<0.05);在给药28 d后,联合组肿瘤抑制率(69.38±2.19)%较人参皂苷Rg3组(57.30±3.95)%和紫杉醇组(61.08±4.16)%显著升高,差异具有统计学意义(P<0.05)。

图1 各实验组裸鼠移植瘤肿瘤体积

注:与人参皂苷Rg3组比较,*P<0.05,**P<0.01;与紫杉醇组比较,P<0. 05。图2 人参皂苷Rg3联合紫杉醇对人肝癌细胞HepG2裸鼠移植瘤生长的抑制作用
3.3 人参皂苷Rg3联合紫杉醇对人肝癌细胞HepG2裸鼠移植瘤凋亡相关蛋白caspase-3、bac-2/bax表达的影响
Western blot实验结果如图3所示,从图中可以看出,与对照组比较,联合用药组人肝癌细胞HepG2裸鼠移植瘤凋亡相关蛋白caspase-3表达显著升高,差异有统计学意义(P<0.05);与对照组比较,联合用药组和紫杉醇组bac-2/bax表达显著降低,差异有统计学意义(P<0.05)。
4 讨论
肝癌又称肝恶性肿瘤,是常见的恶性肿瘤之一,我国肝癌患者死亡率约10万人/年,仅居食管癌和胃癌之后,其年死亡率占全世界肝癌死亡率的45%,如果不及时给予救治,生存期仅0.7~8个月[7-9]。肝癌手术后期的治疗多以放化疗为主,紫杉醇为常见广谱化疗药物[10-11],与其他化疗药物一样,紫杉醇在用于肝癌治疗过程中,除杀死肝癌细胞外,还会影响机体的正常细胞甚至致其死亡[12-14]。因此,研究更多替代或者辅助化疗的药物,从而起到减毒增效的作用是当下研究的热点问题[15-16]。
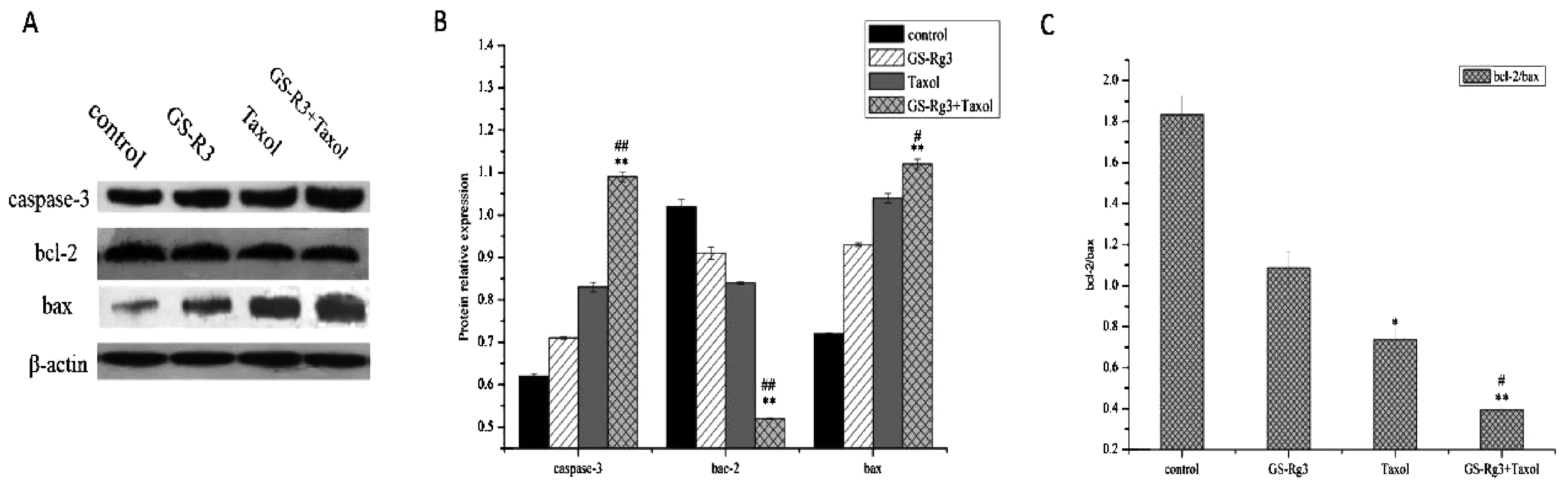
注:A:caspase-3、bcl-2、bax蛋白免疫印迹条带;B:caspase-3、bcl-2、bax蛋白相对表达量分析;C:bcl-2/Bax蛋白相对表达量分析。与对照组比较,*P<0.05,**P<0.01;与紫杉醇组比较,#P<0.05,##P<0.01。图3 人肝癌裸鼠移植瘤caspase-3、bac-2/bax蛋白表达水平变化的免疫印迹分析
本研究选用人参皂苷Rg3联合紫杉醇,通过体内外实验考查其联合肝癌的作用。通过MTT法检测发现两药联合可显著抑制人肝癌细胞HepG2的增殖,与单用紫杉醇相比,其抑制作用更加明显,而抑制肝癌细胞增殖的作用在一定范围内呈现出浓度依赖性关系,当给药浓度超过一定范围时,其抑制作用趋于平稳,这与郑展等人[17]研究的结果一致。此外,通过作用于裸鼠移植瘤肝癌模型,发现随着给药时间的延长,人参皂苷Rg3联合紫杉醇对于体内肿瘤的生长也具有显著的抑制作用。为了从多方面探究两药联合抗肝癌的作用机制,本研究进一步采用Western blot实验检测肝癌细胞凋亡相关蛋白caspase-3、bcl-2/bax的表达水平,结果显示,联合给药组caspase-3蛋白表达显著升高,bcl-2/bax显著降低,推测人参皂苷Rg3联合紫杉醇可通过caspase-3、bcl-2/bax信号通路诱导肝癌细胞的凋亡。
综上所述,人参皂苷Rg3联合紫杉醇可通过抑制肝癌细胞的增殖和诱导其凋亡达到协同抗肿瘤的效果,但是肝癌的形成、生长、发展和转移机制复杂,不单与肿瘤细胞的增殖、凋亡相关,其他方面的作用还有待进一步研究。

