脱氢表雄酮预处理联合生长激素对卵巢储备功能低下IVF-ET患者妊娠结局及卵巢储备功能的影响
孟 靠,马 娟,王 振
近年来随着社会竞争、环境污染、心理压力等不良因素的影响,以及生育年龄的推迟,不孕症发病率逐年升高,有资料显示欧美国家不孕症发病率为5%~8%[1]。卵巢储备功能用于评价卵巢存留卵泡的数量和质量,可反映女性的生育能力[2]。卵巢储备功能低下(DOR)表现为卵巢产卵能力减弱及卵母细胞质量下降,临床表现为生殖能力减退或绝经,约占女性不孕因素的10%[3]。随着现代生活节奏的加快,高龄婚育群体的增多,以及环境污染、心理压力、遗传、免疫、食品安全、手术等不良因素的影响,DOR不孕患者越来越多,且呈年轻化趋势[4]。辅助生育技术为众多不孕女性带来生育的希望,但DOR不孕患者体外受精-胚胎移植(IVF-ET)过程中表现为卵巢反应不良、卵子质量下降、获卵数目少,从而影响IVF-ET治疗结局,使得妊娠率明显降低,增加患者精神压力和经济费用[5]。所以如何改善DOR IVF-ET患者的妊娠结局,提高妊娠率,已成为辅助生殖领域的研究热点和难点。研究发现,生长激素(GH)对卵巢和卵泡发育起着重要的调节作用,体内外研究证实促排卵过程中联合应用GH能够直接或间接通过胰岛素样生长因子来调节卵巢功能,可有效改善DOR患者的卵巢反应性,提高临床妊娠率[6]。新近研究发现,脱氢表雄酮(DHEA)预处理能改善DOR患者卵巢储备功能,提高卵巢对促排卵药物的反应,且能通过减少非整倍体的发生提高妊娠率[7]。但目前尚无足够有力证据支持DHEA预处理有助于DOR IVF-ET患者的妊娠结局。因此,本研究旨在观察DHEA预处理联合GH对DOR IVF-ET患者妊娠结局及卵巢储备功能的影响。
1 资料与方法
1.1一般资料 选取2018年1月—2019年1月我院收治的符合上述纳入及排除标准的DOR IVF-ET患者112例,其中年龄35~43(38.4±4.0)岁;不孕年限3~8(5.5±2.4)年;不孕类型:原发不孕71例(63.4%),继发不孕41例(36.6%);体重指数22~27(24.6±2.2)kg/m2;双侧窦卵泡数5~7(6.3±1.2)个;既往IVF-ET次数1~3(1.9±0.3)次;基础FSH为8~17(12.7±2.4)U/L;黄体生成激素(LH)2~6(4.3±1.8)U/L;雌二醇(E2)23~86(49.9±24.7)pg/ml。所有患者根据治疗方法的不同分为观察组58例和对照组54例。2组的一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。本研究经医院医学伦理委员会审批同意。

表1 2组DOR IVF-ET患者的一般资料比较
1.2纳入与排除标准
1.2.1纳入标准:①女性,年龄35~43岁;②平素月经规律,不孕年限3~8年;③符合DOR诊断标准[8]:高龄(≥35岁)或有其他已知的遗传性或获得性导致卵泡减少的风险因素;既往有因<3个卵泡发育致周期取消病史,或每天至少使用卵泡刺激素(FSH)150 U但获卵数仍<4个的病史(不包括微刺激);卵巢储备功能检测异常,如窦卵泡低于5~7个或抗苗勒管激素(AMH)低于0.5~1.1 ng/ml。出现上述≥2条即可诊断,若年龄或卵巢储备功能检测正常,连续应用2个周期最大化卵巢刺激方案仍出现卵巢低反应也可诊断。
1.2.2排除标准:①伴甲状腺功能亢进、糖尿病、高泌乳素血症等内分泌疾病;②伴多囊卵巢综合征、卵巢肿瘤、子宫内膜病变、生殖器畸形等疾病;③伴心脑血管、肝肾等重要脏器功能不全;④有卵巢手术史者;⑤对本研究使用药物过敏者;⑥重度少、弱精症等男方不育症者;⑦近3个月使用内分泌药物、糖皮质激素或其他药物治疗者;⑧临床资料欠缺者。
1.3方法 观察组在IVF-ET治疗前先给予DHEA预处理,后在IVF-ET治疗过程中加用GH;对照组不予DHEA预处理,常规给予IVF-ET治疗。
1.3.1DHEA预处理:前次IVF-ET失败后休息1个月,然后给予DHEA胶囊(美国Natrol Inc公司,进口药品批准文号JX20060004E)25 mg口服,3/d,连续服用1~3个月后再行IVF-ET助孕。
1.3.2IVF-ET治疗:所有患者于上个周期的第2~4天,一次性给予注射用醋酸曲普瑞林(法国博福-益普,注册证号:H20140298)3.75 mg皮下注射进行降调节,间隔28~35 d后,当达到降调节标准(子宫内膜厚度≤5 mm,卵泡直径<5 mm,FSH、LH均<5 U/L,E2<50 pg/ml)后应用注射用尿促卵泡素(丽珠集团丽珠制药厂,国药准字H20052130)225~300 U/d启动促排卵,当卵泡发育成熟时即主导卵泡直径有1个达20 mm或有2个直径达18 mm时应用HCG(天津德普生物技术和医学产品有限公司,国药准字S10970035)10 000 U。观察组在给予注射用尿促卵泡素的同时应用GH 4.5 U/d至HCG注射日,对照组不应用GH。注射HCG 36~37 h后在超声引导下行无痛取卵术,术后予黄体支持治疗,给予黄体酮(浙江仙琚制药股份有限公司,国药准字H20041902)40 mg肌内注射,2/d。获得卵子经体外受精,体外培养72 h后选择优质胚胎(Ⅰ~Ⅱ级)移植入宫腔,移植术后14 d检测血HCG以明确是否妊娠,术后35 d行B超检查妊娠囊数及心管搏动情况以确定是否临床妊娠。
1.4移植胚胎评分标准 Ⅰ级:卵裂球大小均匀,无碎片;Ⅱ级:卵裂球大小均匀或轻度不均,碎片<20%;Ⅲ级卵裂球大小均匀或轻度不均,碎片20%~50%;Ⅳ级:卵裂球大小不均,碎片>50%。Ⅰ~Ⅱ级定为优质胚胎,Ⅰ~Ⅲ级为可移植胚胎[9]。
1.5观察指标与方法
1.5.1促排卵参数:比较2组尿促卵泡素用药量、尿促卵泡素用药时间和HCG注射日的内膜厚度。
1.5.2胚胎发育指标:比较2组获卵数、可利用胚胎数、优质胚胎数。
1.5.3卵巢储备功能指标:2组均于治疗前1 d及治疗后1 d抽取空腹静脉血3 ml,2000 r/min离心10 min,取上清,采用电化学发光法检测血清FSH、AMH、E2、孕酮(P)水平。
1.5.4妊娠结局:比较2组流产率、种植成功率和临床妊娠率,流产率=(平均流产周期数/平均临床妊娠周期数)×100%,种植成功率=着床胚胎总数/移植胚胎总数×100%,临床妊娠率=临床妊娠例数/总例数×100%。
1.5.5不良反应:比较2组治疗过程中不良反应发生情况。

2 结果
2.1促排卵参数比较 观察组尿促卵泡素用药量少于对照组,尿促卵泡素用药时间短于对照组,HCG注射日内膜厚度大于对照组,差异均有统计学意义(P<0.05)。见表2。
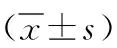
表2 2组DOR IVF-ET患者的促排卵参数比较
2.2胚胎发育指标比较 观察组的获卵数、可利用胚胎数及优质胚胎数均多于对照组,差异有统计学意义(P<0.05,P<0.01)。见表3。
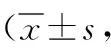
表3 2组DOR IVF-ET患者的胚胎发育指标比较枚)
2.3卵巢储备功能指标比较 治疗前,2组FSH、E2、AMH、P比较差异均无统计学意义(P>0.05)。治疗后,2组FSH、E2较治疗前降低,AMH、P较治疗前升高,且观察组FSH、E2降低,以及AMH、P升高程度均大于对照组,差异有统计学意义(P<0.05,P<0.01)。见表4。
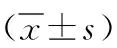
表4 2组DOR IVF-ET患者的治疗前后卵巢储备功能指标比较
2.4妊娠结局比较 2组流产率比较差异无统计学意义(P>0.05);但观察组种植率及临床妊娠率均高于对照组,差异有统计学意义(P<0.05)。见表5。

表5 2组DOR IVF-ET患者的妊娠结局比较(%)
2.5不良反应比较 治疗期间2组均未发生明显不良反应,观察组部分出现轻微关节疼痛、轻微胃胀满、多毛、痤疮、声音变粗及性欲增强,未经特殊处理,停药后症状自然消失。
3 讨论
据相关报道显示,9%~24%的育龄期妇女伴有DOR[10]。DOR主要是因卵母细胞线粒体结构发生变异和功能减退,致使卵巢卵泡闭锁,卵泡数急剧减少,氧化应激系统受到损伤[11]。目前,IVF-ET在辅助生殖领域应用广泛,是治疗不孕症的首选,但DOR患者卵母细胞数、可用胚胎数少,周期取消率高,临床妊娠率低,对促性腺激素反应不良,常导致妊娠结局不佳。故如何改善DOR IVF-ET患者的妊娠结局,提高妊娠率,已成为辅助生殖领域的研究热点和难点。
GH是一种受下丘脑生长激素释放激素和生长抑素双重调节的调节机体生长发育的多肽类激素[12]。有研究指出,GH通过调节下丘脑-垂体-卵巢轴,促进性腺细胞增殖,从而影响卵泡发育和排卵[13]。GH可直接作用于卵巢细胞表面的GH受体或通过胰岛素样生长因子等介质介导,并通过增加卵巢基质动脉的血流灌注,改善卵巢的营养状态,增强子宫内膜容受性,在一定程度上能提高卵巢对促性腺激素的反应性[14]。高龄(年龄>35岁)患者体内GH水平相对较低,外源性GH与卵巢内GH受体结合后可发挥对卵巢的良性作用;并且在IVF-ET治疗过程中GH能在尿促卵泡素的协同下减少卵泡细胞凋亡,促进早期卵泡发育及卵母细胞成熟,提高卵母细胞质量,进而改善妊娠结局[15]。
越来越多研究证实,外源性补充DHEA在改善DOR患者卵巢储备功能和妊娠结局方面发挥着巨大的作用[16]。DHEA主要由肾上腺网状带合成,广泛分布于组织器官及循环系统。DHEA由肾上腺及卵巢合成并分泌,具有弱雄激素作用,女性15~19岁时其血浆含量达到高峰,后随年龄增长血浆含量不断降低。外国学者认为各年龄阶段DOR患者均处于雄激素缺乏状态,因此外源性补充DHEA可改善DOR IVF-ET患者妊娠结局[17]。笔者分析其作用机制为:①DHEA为合成类固醇激素的必需底物:卵泡生长需要雄烯二酮、E2等类固醇激素,而DHEA正是合成上述激素的必需底物;②影响卵泡生长:DHEA还可通过增加胞内雄激素水平,与FSH协同促进卵泡生长;③改善卵泡液环境:DHEA为肾上腺雄激素,可通过雄激素受体介导作用改善卵泡液环境;④增加血清胰岛素样生长因子浓度:DHEA能增加血清胰岛素样生长因子浓度,进而促进卵泡雄激素、雌激素的产生,增加窦前和窦卵泡的数量[18]。但目前尚无足够有力证据支持DHEA预处理有助于DOR IVF-ET患者的妊娠结局。
本研究结果显示,观察组尿促卵泡素用药量少于对照组,尿促卵泡素用药时间短于对照组,HCG注射日内膜厚度大于对照组;观察组治疗后获卵数、可利用胚胎数及优质胚胎数均多于对照组;观察组种植率及临床妊娠率均高于对照组。提示DHEA预处理联合GH可增强DOR IVF-ET患者的卵巢反应性,显著减少促排卵所需的尿促卵泡素总剂量、缩短尿促卵泡素用药时间及增加HCG注射日内膜厚度,并有效促进卵泡生长发育,改善患者妊娠结局。DOR患者基础FSH、E2水平升高,AMH、P水平降低,均为反映卵巢储备功能的常用临床指标[19]。本研究结果显示,治疗后,2组FSH、E2较治疗前降低,AMH、P较治疗前升高,且观察组FSH、E2降低,以及AMH、P升高程度均大于对照组。提示DHEA预处理联合GH可极大改善DOR IVF-ET患者的卵巢储备功能。笔者分析产生上述结果的原因在于DHEA预处理联合GH可通过雄激素受体或其他非经典途径影响卵泡生长发育,促进雌激素合成,提高颗粒细胞FSH受体表达,提高卵巢内胰岛素样生长因子-1水平等多重机制调节卵泡募集与生长发育,进而改善卵巢储备功能及IVF-ET临床结局[20]。此外,治疗期间2组均未发生明显不良反应,观察组部分出现轻微关节疼痛、轻微胃胀满、多毛、痤疮、声音变粗及性欲增强,未经特殊处理,停药后症状自然消失。说明DHEA预处理联合GH治疗的安全性高。
综上所述,DHEA预处理联合GH可增强DOR IVF-ET患者卵巢反应性,减少IVF-ET治疗期间尿促卵泡素用药量及缩短用药时间,提高卵巢储备功能,改善患者妊娠结局。

