T波形成机制研究进展及争议
陈程 夏云龙
自1887年Augustus记录到人类首份心电图以来,心电图技术经过百年的发展已成为临床心内科最重要的无创检查方法之一。然而,虽然心电图有了一个多世纪的临床应用,但其许多机制特别是T 波形成仍然存在争议。笔者将对T 波相关研究作一综述和总结。
1 T波的早期研究
1856年,两个德国生理学家Kolliker and Muller首次尝试探究心脏电活动并发现两个收缩波形,而第二个“收缩”可能就是Einthoven在日后提及的T 波[1]。到1880 年,Burdon-Sanderson等[2]首次在青蛙心脏上发现心室激动顺序是基底到心尖部,同时记录到正向的R 波和负向的T 波双向波形,并且认为T 波与心室复极相关。Cohen等[3]通过对羊心室基底部和心尖部的组织切片做电生理检测,发现基底部的动作电位长于心尖部。并且通过升高基底部的温度可以缩短动作电位时程,同时形成更深、更长并且倒置的T 波。自此心尖-基底部离散度被认为是T 波在哺乳动物形成的主要理论依据,直到90年代初Antzelevitch等人发明离体楔形模型并提出中层(M)细胞的概念才将这一理论打破[4-5]。
2 对T波形成意义的探索
M 细胞的发现极大了推动了对T 波形成的理解。Antzelevitch等人发现心室肌并非均一性的结构,其可以分为心外膜细胞、M 细胞以及心内膜细胞三种类型,并且每种细胞都有独特的电生理学特性[4-6]。随后,Yan 及Antzelevitch[7]对离体左室楔形模型同时记录三类细胞的动作电位和该块心肌的模拟心电图。研究发现M 细胞与心外膜细胞和心内膜细胞复极过程中产生的电位差形成了T 波的上升支和下降支,T 波顶峰对应着心外膜细胞复极结束,而T 波终点对应M 细胞复极结束。因此,M 细胞的动作电位时程基本等同于心电图上的QT 间期,心外膜细胞动作电位时程基本等于QTpeak 间期,而从T 波顶点至T 波终点的距离(Tpeak-Tend)等同于心室跨壁离散度(图1)。同时,该研究进一步应用索他洛尔等药物干预心脏组织块动作电位时程和幅度,并得到一致的结论。随后,一些研究也为复杂形态T 波比如负向T 波、双峰T 波甚至三相T 波的形成提供了理论基础[8]。至此,T 波形成依赖于心室跨壁离散度成为新的T 波形成机制理论基础。
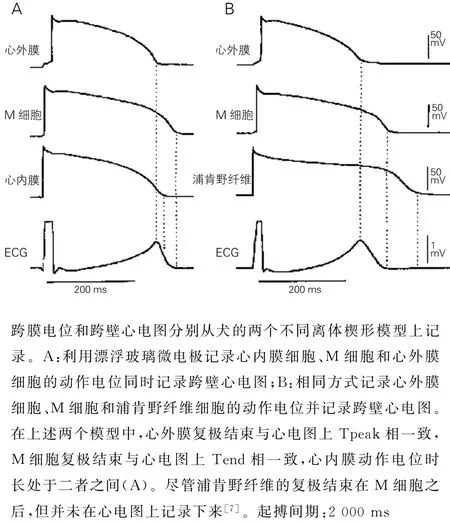
图1 正常T 波形成的细胞基础
3 心室整体复极离散度在体研究的进展
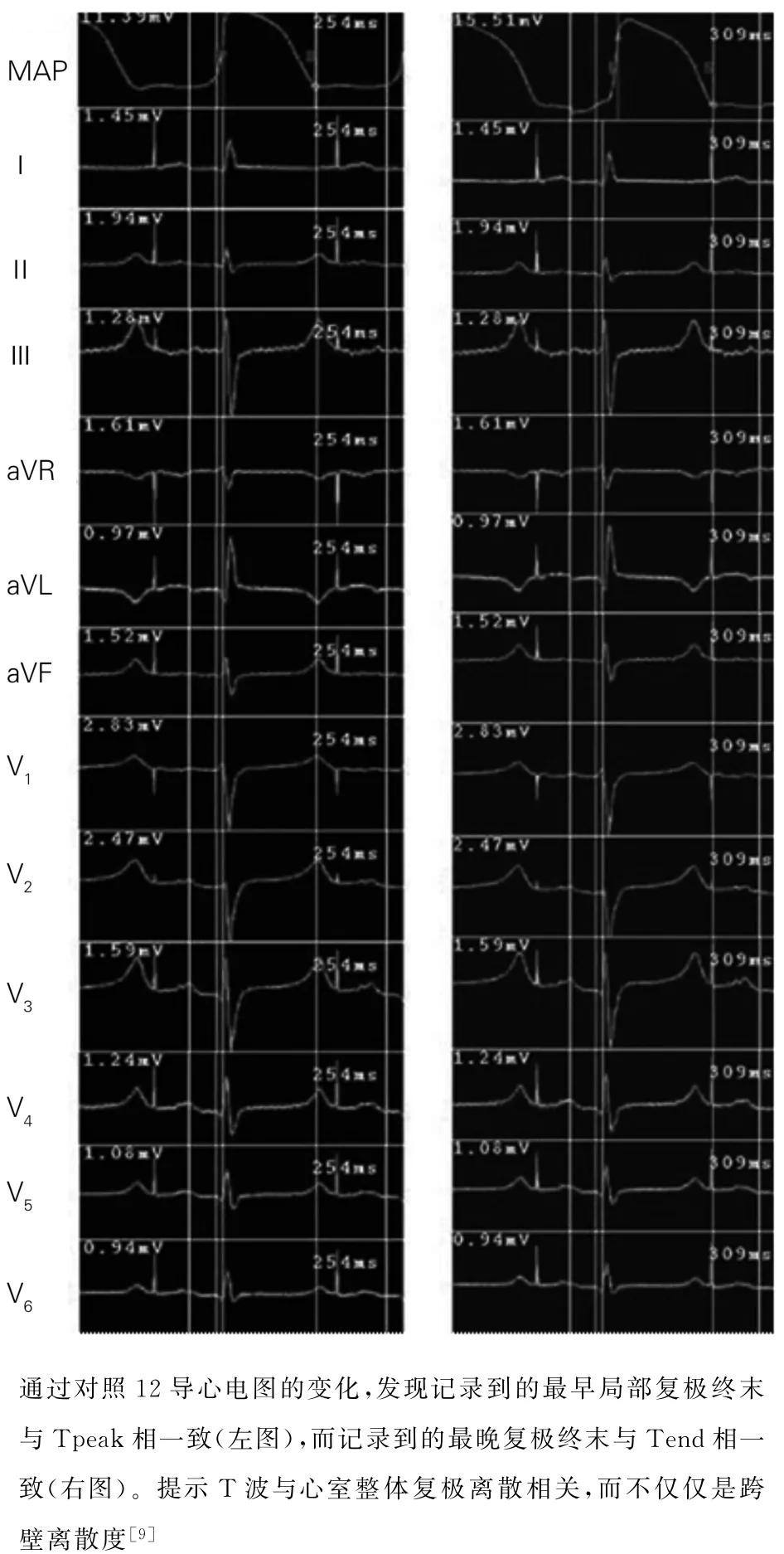
图2 应用CARTO 三维标测系统结合单向动作电位记录技术进行心室的整体复极研究
Xia等[9-10]结合单向动作电位和三维电磁标测系统,在120次/分的心房起搏频率下对在体猪心进行高密度标测。结果发现虽然单向动作电位复极最晚多位于心外膜,但是心室整体复极离散度远远大于相同条件下的心室组织块的跨壁复极离散度,而在心电图上心室整体最早复极与Tpeak一致,心室整体复极最晚与Tend一致,提示Tp Te可能更多反映的是心室整体复极离散度。同时,Opthof等[11-12]也进行了狗的在体研究,该研究在同时记录心室心内膜和心外膜复极特点的同时,也标测了心室壁内的电位记录,并同时起搏心室刺激心室电重构以观察T 波的变化。结果类似于Xia等的发现,并发现整体心室的复极离散度在T 波形成中起重要作用。另外,心室电重构虽增加了心室跨壁复极离散度,但Tpeak-Tend并未出现明显的变化。值得一提的是,在整个该研究过程中心肌间电极未发现复极时程最长的中间层M 细胞(图2)。随着研究的不断深入,越来越多的实验发现在T 波形成的过程中包括心尖-基底部,左室-右室在内等不同方向的心肌整体复极离散度起主导作用,这一结论也在包括狗[11-15]、猪[9-10,16]以及人类[17-19]等不同物种的心脏上得到印证。也有研究发现,双峰T 波或切迹T 波是由于左室和右室的复极离散增加导致的[20]。2014 年Meijborg等[16]首次比较不同轴向的复极离散度和T 波形成的关系,并发现Tp Te_total(定义为ECG 上所有导联中最早的Tpeak到最晚Tend的距离)和心室整体复极离散度最相关,也就是说T 波形成是不同轴向的复极离散度综合作用的结果(图3)。最近,Opthof等[17]对3 个心脏捐献患者的健康心脏进行体外灌注Langendorff液和血液,通过24根跨壁探针共92个单极电极标测心脏除极、复极以及激动恢复时间(activation repolarization interval,ARI),结果提示3个心脏复极模式不尽相同,复极从多个位点同时开始,复极向量包括心电各轴且仍未发现复极明显延长的M 细胞(图4)。因此,是否存在跨壁复极离散度,如果存在其对T 波形成究竟有无贡献仍在争论之中。另外,也有观点认为T 波形成是心室跨壁离散度和心脏整体复极离散度共同作用的结果[21-22]。
但是为何在不同模型下会得出截然不同的结论? 首先,有研究认为离体楔形模型和完整心脏模型的不同导致了结论的差异[23]。通过标测猪的完整心脏的ARI后将该心脏制备成离体楔形模型,并用相同方法测量ARI,发现离体楔形模型的ARI明显长于完整心脏模型的ARI。提示在离体楔形模型上得出的结论并不能推论到完整心脏模型;其次,并非所有制备的楔形模型都是相同的。不同的切割方式得到的离体楔形模型对结果可能产生巨大的影响。有研究报道[13],将心肌块垂直切割制备离体楔形模型可以发现心肌中存在动作电位时程明显延长的M 细胞,而沿心肌束解剖走形方向进行切割时,其心内膜层、中层和心外膜层的动作电位时程均一致,并未发现动作电位时程延长明显的M 细胞(图5);第三,心脏本身为三维空腔器官,离体楔形模型无法体现心室前壁、后壁、心尖、心底及间隔部心肌细胞动作电位差异对T 波形成的影响[22];第四,心室传导具有时间性,离体楔形心肌作为有限大小的心肌组织无法反映传导时间对心室复极离散度的影响[24];第五,离体楔形模型建立在较慢的起搏频率基础上(40 次/分),而在较快的频率起搏时(100次/分)跨壁复极离散度会明显缩短[6];第六,离体楔形模型缺少记录组织和细胞间的相互电张力以及电偶联影响[25]。综上,离体楔形模型的局部动作电位不能完全反映在体的复极离散变化,存在明显的局限性。
4 心室心肌复极顺序与T波极性关系的争议及探索

图3 典型的除极和复极在不同层面(基底区、中间区及心尖区)的电生理标测结果

图4 3个离体人类心脏的除极(第一行)和复极模式图(第二行)
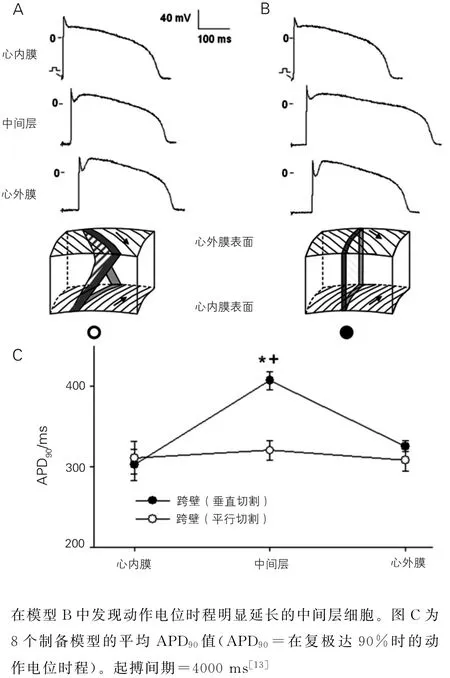
图5 在犬心中分别按心肌束解剖结构进行切割(A)和直接垂直切割(B)的方式支配离体模型,分别记录心内膜、中间层和心外膜细胞的单向跨膜动作电位
早在1913年,Mines[26]就发现T 波不仅是心肌复极的电表达形式,而且T 波极性与动作电位时程的变化相关。随后Wilson[27]于1931年将这一结论进一步完善,认为T 波和R 波极性一致原因是在部分心肌除极和复极必须是方向相反,也就是说在细胞层面上,先除极的心肌细胞必须最后复极才能使T 波和R 波的极性一致,换言之,先激动的心肌细胞其动作电位时程必须长于最后激动的心肌细胞。Cohen等[3]发现羊心室基底部和心尖部心肌切片动作电位时程有明显的差别,认为这就是造成T 波直立的主要原因。而Higuchi和Nakaya等[28]认为,T 波与QRS波极性一致是由于跨壁离散度导致的。他们记录了7只狗的心内膜和心外膜单向动作电位,发现在室温下心外膜的T 波倒置(与正常狗心电图一致),当逐渐加热升高心外膜温度时,T 波负极性逐渐消失。当心内膜动作电位时程比心外膜动作电位时程长20~40 ms时出现等电位线T 波,并且当动作电位时程差增加到40~60 ms时正向T 波出现。但是,Janse等[13]认为并非跨壁离散度影响了T 波极性,QRS波和T 波极性是否一致取决于心外膜(或心内膜)的除极和复极时间。对正常人类来说,除极晚的区域复极时间短,除极早的区域复极时间长。而在犬心中则相反,其复极和除极顺序大致相同,也就是说除极晚的区域复极时间反而长。这也就是为什么在人类心电图中QRS波和T 波极性一致,而在狗心电图中二者极性相反的原因。同时,Janse等人也对比了跨壁方向和心尖-基底方向的复极时间和激动时间的线性关系,发现T 波极性和跨壁离散无关(图6)。类似的还有Cowan等人的研究,结果提示QRS波与T 波极性一致的心脏复极时间与激动时间成反比,而极性相反的心脏激动时间与复极时间成正比[29-30](图7)。然而,随着高密度电生理技术发展,研究发现在完整心脏中并非所有心肌除极复极都遵循上述线性关系。Maffessanti等[31]对30 名伴或左束支传导阻滞的心力衰竭患者分别在左右室和冠状窦进行电生理标测,结果发现心力衰竭伴左束支传导阻滞的患者T 波倒置是因为左右室间复极离散造成的,而T 波的极性不单单与复极时间和激动时间的线性关系有关,可能是多因素作用下的结果。因此,在真实心脏中心肌除极和复极顺序和T 波极性的关系可能更加复杂和多样(图8)。
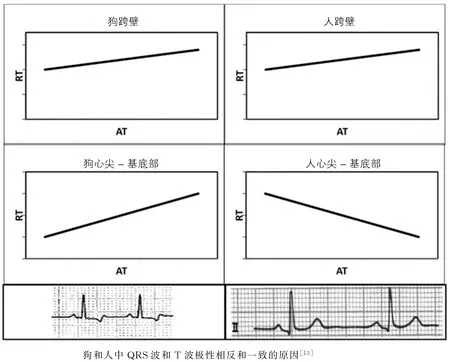
图6 图中分别表示在狗和人心脏中复极时间和激动时间分别在心尖-基底部方向和心室跨壁方向的关系

图7 在T 波与QRS波极性一致和不一致的病人中,AT、RT 和APD 的关系
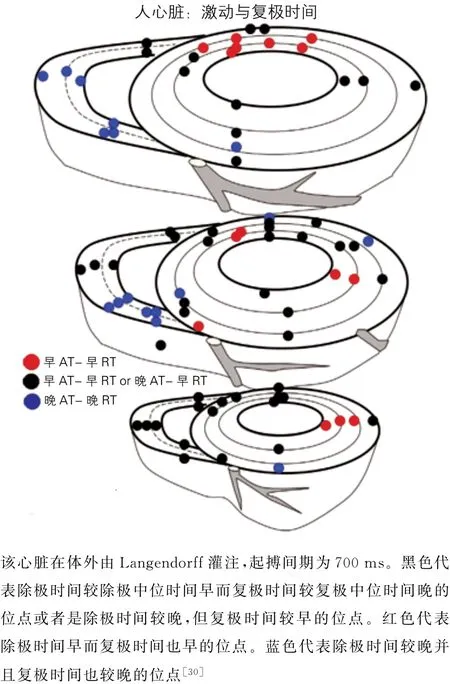
图8 在正常人类完整心脏中,不同部位除极和复极先后关系
总之,经过数十年的研究发展,心电生理学家对T 波形成的机制以及心脏复极离散的机制有了更深的理解。跨壁复极离散和心脏整体复极离散的争论随着研究的不断进展,越来越多的证据支持心脏整体复极离散对T 波形成的贡献,但这并不意味否定离体楔形模型和心室跨壁复极的价值。对于心电生理学家们来说,T 波形成机制及心脏的复极仍有许多未知和争议,比如究竟M 细胞是否存在,以及究竟哪个导联可以更好的反映复极离散等一系列问题仍需进一步研究及探讨。

