嗜水气单胞菌感染暗纹东方鲀脾脏的蛋白质组学分析
付胜利, 刘海粟, 廖绍安*, 郭 政*
(1. 天津市水产生态及养殖重点实验室, 天津 300384; 2. 华南师范大学生命科学学院∥广东省水产优质环保养殖工程技术研究中心, 广州 510631)
暗纹东方鲀(Takifuguobscurus)属硬骨鱼纲,辐鳍亚纲,鲈形总目,鲀形目(Letrodontiforms),鲀科(Terradontidae),东方鲀属(Takifugu),在我国主要分布在东海、渤海、黄海以及长江中上游[1],其味道鲜美,脂肪含量低,蛋白质含量高,是享誉国内外的“长江三鲜”之一[2]. 2016年9月我国出台了新的河豚产品购销政策,取消了对暗纹东方鲀和红鳍东方鲀的限制性养殖,中国河豚市场初步开放,其人工养殖产量亦逐年增长,具有广阔的开发和利用前景[3]. 随着河豚养殖业的快速发展,养殖面积不断扩大,集约化程度不断提高,养殖水质易恶化,在养殖过程中,鱼病害频发,对河豚养殖业造成巨大损失. 嗜水气单胞菌作为一种广泛存在于淡水、污水以及土壤中的病原菌,是我国危害养殖鱼种类最多、影响区域最广、流行季节最长、发病率和死亡率高、造成经济损伤最严重的细菌性病原之一,对我国水产养殖业造成了严重的威胁[4-6].
在硬骨鱼中,脾脏作为主要的免疫器官之一,也是红细胞和各种粒细胞等产生、储存和成熟的主要场所,可为鱼体提供充足的血液和大量的免疫细胞[7-8],其功能主要包括:清除大分子物质,降解和呈递抗原以及抗体生成等[9]. 当硬骨鱼受到外源刺激时,脾脏可以产生大量的黑色素巨噬细胞,它可以通过结合抗体和淋巴细胞来调节免疫功能[10]. 目前,对于暗纹东方鲀抵抗病原菌的研究较少,主要集中在基因表达层面上的探究[11-13],而相对于基因组学,蛋白质组学对生命现象的诠释更直接、更准确. 本研究采用TMT标记、高效液相色谱(HPLC)分级技术以及基于质谱的定量蛋白质组学技术,检测病原菌感染暗纹东方鲀后脾脏蛋白的表达变化,分析其抵抗病原菌的关键蛋白和富集通路,为进一步探究病原菌感染暗纹东方鲀的致病机理提供了一定的理论基础.
1 材料与方法
1.1 实验动物
健康暗纹东方鲀购于广州市金洋水产有限公司,平均体质量为45.4 ± 2.2 g,体长为9.2 ± 1.3 cm. 购买回来的暗纹东方鲀暂养2周,使其适应养殖环境,暂养期间饲养于300 L/桶循环养殖系统中,养殖循环水温度为23~25 ℃,pH为7.5~7.7,氨氮的质量浓度≤0.05 mg/L,溶解氧的质量浓度≥6.0 mg/L,期间个体死亡率极低(≤0.5%).
1.2 主要试剂和仪器
碘代乙酰胺(Iodoacetamide)、二硫苏糖醇(Dithiothreitol)、尿素(Urea)、三氯乙酸(Trichloroacetic Acid)、四乙基溴化铵(TEAB)购买于美国Sigma公司;1×磷酸缓冲盐溶液(1×PBS)、RPMI-1640培养液购买于美国Gibco公司;Annexin V-FITC细胞凋亡检测试剂盒、Fluo-3 AM、BCA试剂盒购买于中国碧云天生物技术公司;TMT标记试剂盒购买于德国Thermo公司; Easy nLc色谱系统、Q ExactiveTM质谱仪、Multiskcan FC酶标仪购买于德国Thermo公司;低温高速离心机、真空离心浓缩仪购买于德国Eppendorf公司;匀浆仪购买于中国杭州米欧有限公司;AKTA Purifier 100纯化仪购买于美国GE Healthcare公司;流式细胞仪购买于美国BD公司.
1.3 暗纹东方鲀感染及取样
暗纹东方鲀致病菌嗜水气单胞菌(BYK00810)(购买于水产种质资源发掘与利用教育部重点实验室,上海海洋大学)经活化计数. 暗纹东方鲀分为实验组和对照组,各50尾,实验组每尾注射100 μL菌液,菌液浓度为1×108CFU/mL[1],对照组注射等体积无菌磷酸缓冲盐溶液(PBS). 在注射后0、3、6、12、24、48、72 h各采集实验组和对照组脾脏,每个时间点各3尾,脾脏细胞用于流式细胞仪检测. 另外,感染12 h时,采集实验组和对照组脾脏各5尾,-80 ℃冻存. 感染嗜水气单胞菌后的暗纹东方鲀相对于健康暗纹东方鲀,游动缓慢,肝脏充血.
1.4 脾脏细胞凋亡率
将取好的脾脏组织用2.5 mL注射器捣碎后通过75 μm一次性筛网过滤组织,细胞提取步骤参照本实验室潘训彬等[14]的实验方法,利用Annexin V-FITC细胞凋亡检测试剂盒通过流式细胞仪检测细胞凋亡. 将脾脏细胞稀释后计数,用无菌PBS稀释至1×106个/mL,取200 μL细胞悬液,加入2.5 μL Annexin V-FITC和5 μL PI工作液避光染色15 min,再加入50 μL 5×Annexin V 结合缓冲液后上机检测.
1.5 胞内游离Ca2+含量
以Fluo-3AM为荧光探针,利用流式细胞仪检测细胞内游离的钙离子含量. 根据本实验室XIAN等[15]的实验步骤. 取上述脾脏细胞悬液200 μL,加入10 μmol/L Fluo-3AM避光孵育30 min,1×PBS洗涤3次,每次500×g、4 ℃离心3 min,洗涤结束后用1×PBS悬浮细胞,上机检测.
1.6 蛋白质提取及酶解
取适量组织样品,于研钵中充分研磨至粉末,期间不断添加液氮制冷. 将粉末转移至含有4倍体积裂解缓冲液(8 mol/L尿素,1%蛋白酶抑制剂)离心管中,超声裂解后离心,离心条件:4 ℃,12 000 r/min,10 min,去除细胞碎片,上清液转移至新的离心管,利用BCA试剂盒进行蛋白浓度测定.
向蛋白溶液中添加终浓度为5 mmol/L的二硫苏糖醇,56 ℃孵育30 min. 之后加入终浓度为11 mmol/L的碘代乙酰胺,室温避光孵育15 min. 将样品的尿素浓度稀释至2 mol/L以下. 加入胰酶适量(m(胰酶)∶m(蛋白)=1∶50),酶解过夜. 再加入胰酶适量(m(胰酶)∶m(蛋白)=1∶50),酶解4 h.
1.7 TMT标记和HPLC分级
将上述酶解蛋白用Strata X C18 (Phenomenex)除盐后真空冷冻干燥. 然后用0.5 mol/L 四乙基溴化铵溶解,操作参照陈敏氡等[16]步骤.
将每组标记后的肽段采用高pH反向HPLC分级,在Agilent 300 Extend C18 (5 μm粒径,4.6 mm内径,250 mm长)中进行分离. 操作如下:分级梯度为8%~32%乙腈,调整pH 9,60 min分离60个组分,然后肽段合并为18个组分,真空冷冻干燥后进行后续操作.
1.8 液相色谱-质谱联用分析
肽段用液相色谱流动相A相(体积分数为0.1%的甲酸水溶液)溶解后. 使用EASY-nLC 1000超高效液相系统进行分离. 液相梯度设置:0~24 min 7%~25%;24~32 min 25%~40%;32~36 min 35%~80%;36~40 min 80%,流速维持在350 nL/min. 肽段用液相色谱流动相A相(0.1%甲酸和2%乙腈的水溶液)溶解后进行分离. 分离后的肽段注入NSI离子源中进行电解,然后用Q ExactiveTM质谱仪进行分析. 具体分析步骤参照陈敏氡等[16]步骤.
1.9 数据库搜索
用Maxquant(v1.5.2.8)检索二次质谱分析数据. 检索参数设置:数据库为本实验室转录组(57 208条序列),添加了反库以计算随机匹配造成的假阳性率(FDR),并且在数据库中加入了常见的污染库,用于消除鉴定结果中的污染蛋白的影响,具体分析步骤参照陈敏氡等[16]步骤. 定量方法设置为TMT-6plex,蛋白鉴定、PSM鉴定的FDR都设置为1%. 依据蛋白质丰度水平,以注射PBS组暗纹东方鲀脾脏为参考,将注射嗜水气单胞菌12 h的暗纹东方鲀脾脏样品与之比较,当差异倍数≥1.3(上调)或≤0.77(下调),且经统计检验其P<0.05时,视为差异表达蛋白质.
1.10 生物信息学分析
Gene Ontology (GO)对蛋白组学层面的注释来源于UniProt-GOA数据库(www.http://www.ebi.ac.uk/GOA/). 首先,系统会将蛋白ID转化为UniProt ID,之后用UniProt ID去匹配GO ID,并依据GO ID从UniProt-GOA数据库中调取相应的信息. 如果UniProt-GOA数据库中没有所查询的蛋白信息,那么会使用InterProScan,去预测该蛋白的GO功能,通过KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库(http://www.kegg.jp/kegg/pathway.html)分析差异表达蛋白主要参与的生化代谢途径和信号转导途径.
2 结果与分析
2.1 脾脏细胞凋亡率和胞内游离钙离子含量
利用流式细胞仪检测感染嗜水气单胞菌后的暗纹东方鲀脾脏细胞凋亡水平和细胞质游离钙离子含量变化,PBS组为对照. 实验结果表明(图1):感染3 h后脾脏细胞凋亡率升高,相对于对照组,差异具有统计学意义(P<0.01),在12 h达到最高值,为对照组的5.4倍,之后逐步下降(图1A),但仍极显著高于对照组(P<0.01). 病原菌介导脊椎动物细胞凋亡主要有2条途径:一条是外在或死亡受体途径,另一条是内在或线粒体途径,两者相互关联,最终通过含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)家族基因,介导细胞凋亡[1]. 暗纹东方鲀的Caspase家族基因的结构和功能有待进一步分析.
感染6 h后,脾脏细胞的细胞质中游离钙离子含量显著上调,差异极显著(P<0.01),在12、24 h达到最大值,分别为对照组的3.74、3.71倍,之后逐步下调(图1B),72 h后仍极显著高于对照组(P<0.01). 胞内钙离子来源主要包括胞外的钙离子内流和钙库的钙离子外流[17],硬骨鱼的钙离子信号通路与病原菌感染之间的关系有待进一步探究.
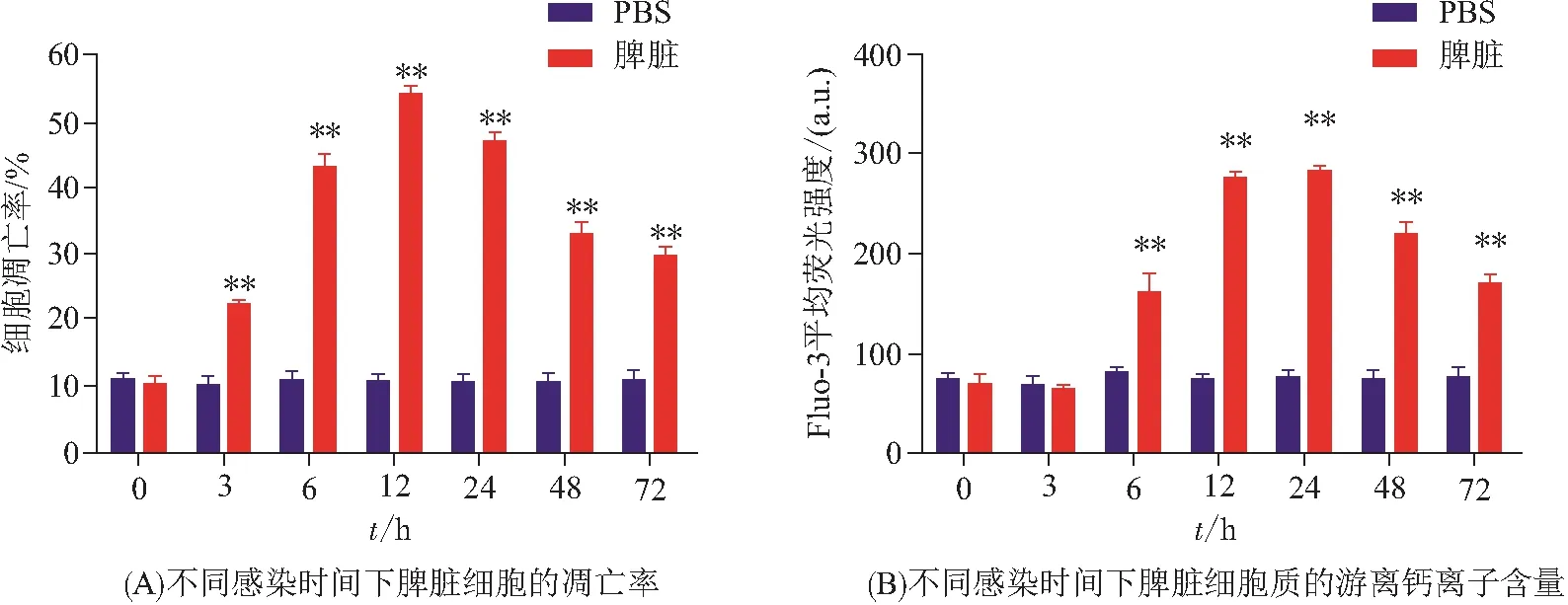
图1 感染嗜水气单胞菌后暗纹东方鲀的脾脏细胞凋亡水平和细胞质游离钙离子含量变化Figure 1 The apoptosis level of spleen cells and the concentration of free Ca2+ in the cytoplasm of T. obscurus after infection with A. hydrophila
2.2 差异表达蛋白的统计及分析
2.2.1 差异表达蛋白统计 本实验通过光谱仪获得的光谱数188 618,与对比蛋白匹配的光谱数32 913,获得肽段21 588个,鉴定到蛋白4 133个,包括定量蛋白3 672个. 以差异倍数值变化超过1.3倍作为显著上调、小于1/1.3作为显著下调的变化标准,获得差异表达蛋白306个,其中120个蛋白表达上调,186个蛋白表达下调,其中和免疫相关的差异蛋白有整合素β1(ITGB1)、血浆血管性血友病因子(VWF)、Ⅰ型胶原α1(COL1A)、CD44、免疫球蛋白重链(IGH)、1,3,4-三磷酸肌醇5/6激酶(InsP3)、CD38、经典蛋白激酶Cβ型(PRKCB)、一氧化氮合成酶(NOS1)、磷脂酰肌醇磷脂酶C(PLCD).
2.2.2 差异表达蛋白的亚细胞结构定位分析 使用Wolfpsort软件对差异表达蛋白进行了亚细胞结构的预测和分类统计,从结果(表1)中可以看出:上调蛋白和下调蛋白定位在细胞质中的比例最高,分别占22%和27%,上调蛋白定位在细胞膜和线粒体中也较多,而下调蛋白则定位在细胞核和胞外的较多.
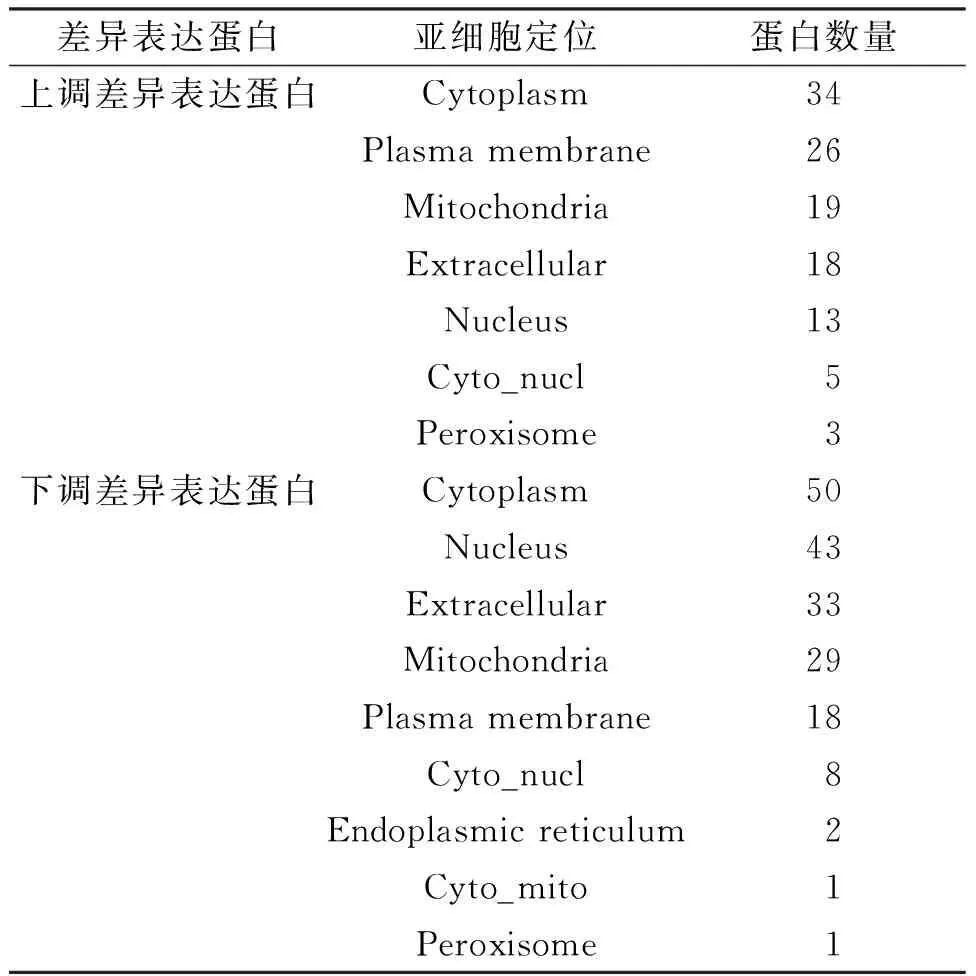
表1 上调和下调差异表达蛋白的亚细胞结构定位分布情况Table 1 The location of subcellular structures of up- and down-regulated expression proteins
2.2.3 差异表达蛋白的GO注释 对差异表达蛋白的生物进程、细胞组成和分子功能进行分析(表2、表3),结果表明:差异表达蛋白参与的主要生物进程有8个,上调蛋白参与最多的生物进程是代谢过程,下调蛋白参与最多的是细胞进程;从差异蛋白所属细胞组分(5个)来看,上调蛋白以细胞膜上蛋白居多,下调蛋白以细胞中蛋白居多;在主要分子功能(4个)方面,上调蛋白和下调蛋白均以结合功能和催化活性为最多.

表2 上调蛋白在GO二级注释中的分布情况Table 2 The distribution of up-regulated expression proteins in GO annotation

表3 下调蛋白在GO二级注释中的分布情况Table 3 The distribution of down-regulated expression proteins in GO annotation
2.2.4 差异表达蛋白的功能富集分析 将GO注释中除了一级三大类之外的条目进行了富集分析(图2). 细胞组分上,上调蛋白主要富集到6个,其中胞外区富集最多,而下调蛋白主要富集到8个,其中核糖核蛋白复合体富集最多;分子功能上,上调蛋白和下调蛋白各富集到8个类别,其中上调蛋白主要富集到钙离子结合、羧酸酯水解酶活性、果糖二磷酸醛糖酶活性、醛裂合酶活性、脂结合蛋白、氧化还原酶活性、血红素结合、四吡咯结合等功能,下调蛋白主要富集到结构分子活动、核糖体的结构组成、细胞外基质结构组成、三价铁离子结合、黄素单核苷酸结合、水解酶活性、铁离子结合、肌动蛋白结合等功能;生物进程上,上调蛋白富集到12条生物进程,包括碳水化合物代谢过程、脂质转运、多元醇代谢过程等进程,下调蛋白富集到14条生物进程,包括翻译、细胞酰胺代谢过程、肽生物合成过程等进程.
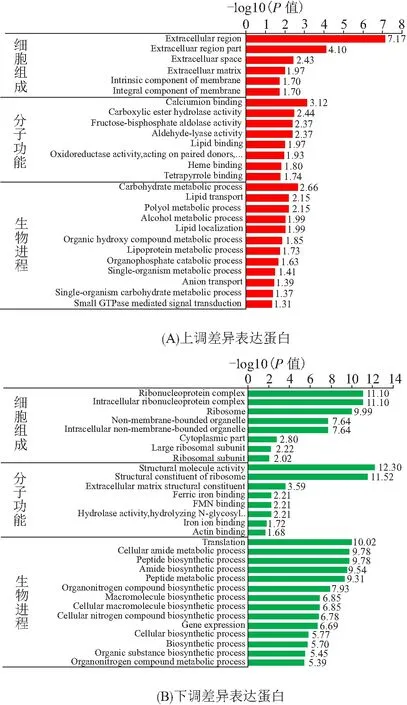
图2 差异表达蛋白的GO富集结果Figure 2 The GO enrichment results of DEPs
差异表达蛋白KEGG通路富集结果显示(图3):上调蛋白主要富集到和代谢相关通路上,如叶酸合成、精氨酸和脯氨酸代谢、组氨酸代谢、烟酸和烟酰胺代谢、药物代谢;而下调蛋白主要富集到核糖体、视黄醇代谢、钙离子信号通路、ECM受体相互作用、糖尿病并发症中的AGE-RAGE信号通路. 其中和免疫相关通路主要是钙离子信号通路和ECM受体相互作用,注释到这2条通路上的差异蛋白具体见表4和表5.
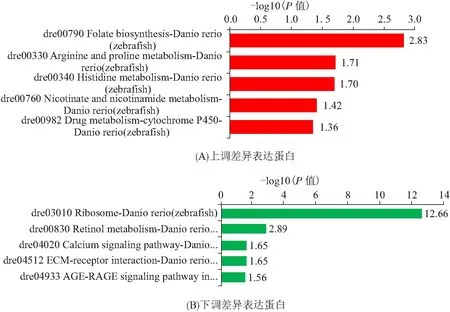
图3 差异表达蛋白的KEGG通路富集结果Figure 3 The KEGG pathway enrichment of DEPs

表4 嗜水气单胞菌感染暗纹东方鲀后脾脏和免疫相关表达上调的差异蛋白Table 4 The immune-related up-regulated DEPs in spleen of pufferfish after A. hydrophila infection
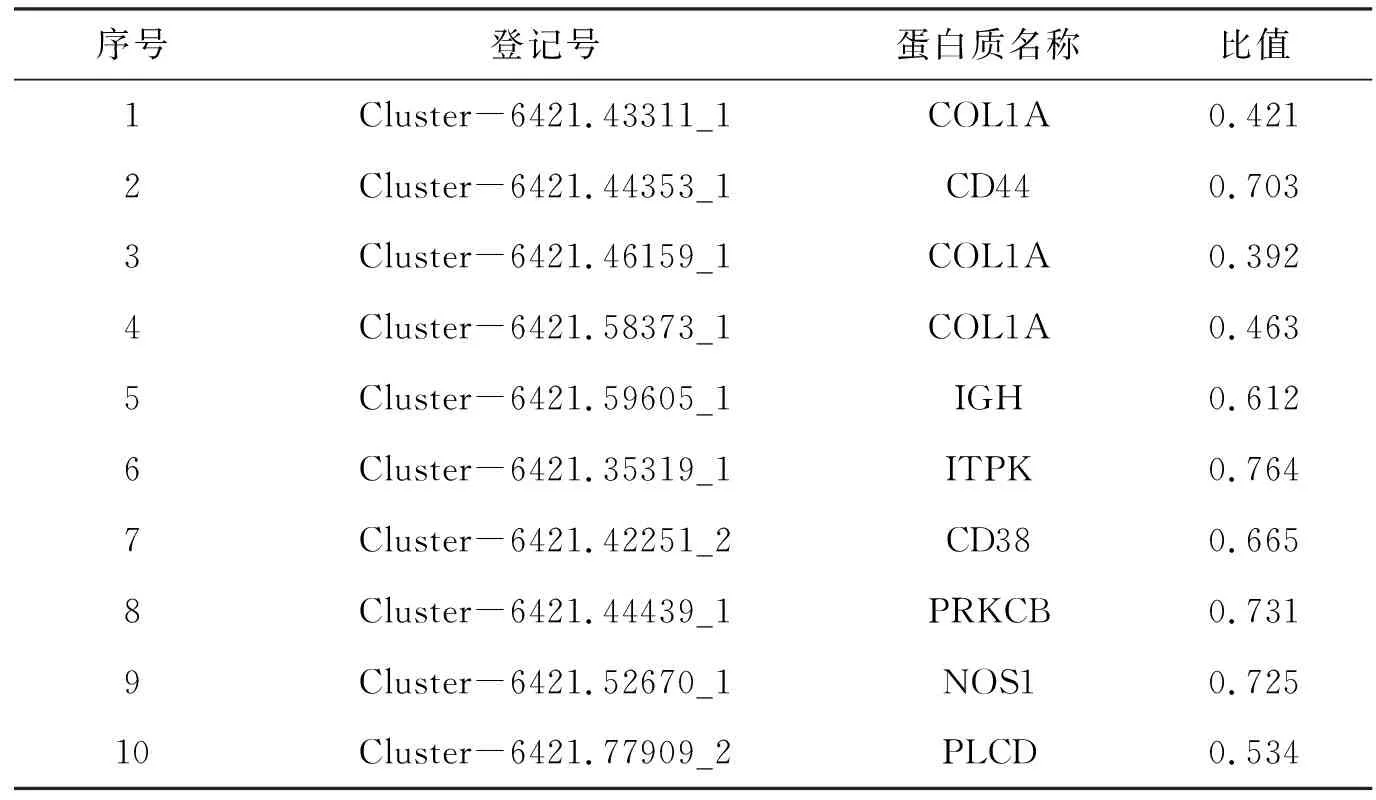
表5 嗜水气单胞菌感染暗纹东方鲀后脾脏和免疫相关表达下调的差异蛋白Table 5 The immune-related down-regulated DEPs in spleen of pufferfish after A. hydrophila infection
2.3 差异蛋白的PRM验证
选取4个差异表达蛋白进行PRM验证,其中包括1个上调表达蛋白ITGB1和3个下调表达蛋白IGH、CD38、COL1A(表6). 结果显示:蛋白质组测序和PRM结果一致,说明本次测序具有一定可靠性.
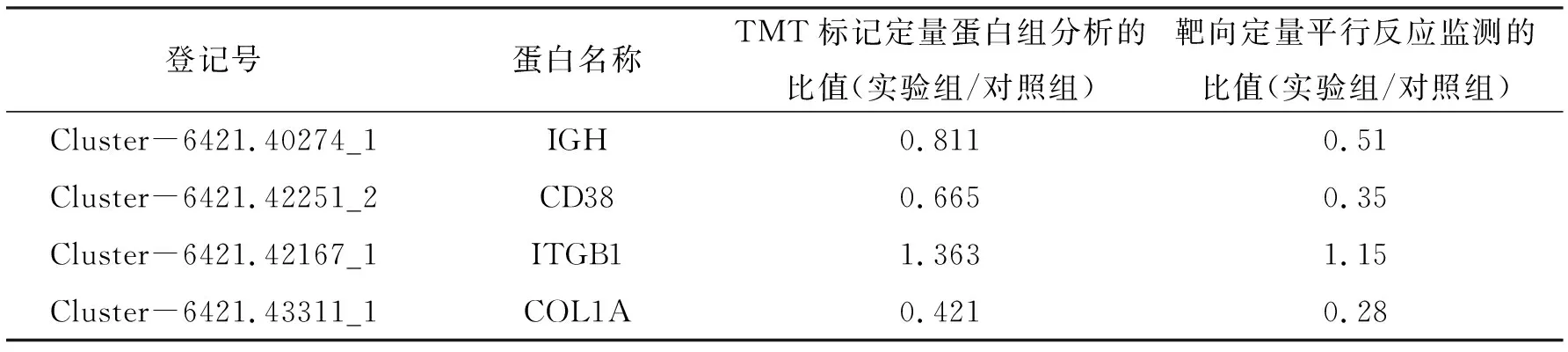
表6 PRM实验验证差异表达蛋白Table 6 The confirmation of DEPs detected in PRM analysis
3 讨论
本实验利用TMT蛋白质组学技术,探究了暗纹东方鲀感染嗜水气单胞菌前后脾脏组织蛋白质表达变化. 实验共筛选到306个差异表达蛋白,其中120个差异蛋白上调,186个差异蛋白下调;从中筛选4个和免疫相关的差异表达蛋白(1个上调,3个下调),利用PRM试验进行验证,表达结果一致. 对免疫相关的差异蛋白进行分析发现:上调蛋白有整合素β1、血浆血管性血友病因子,下调蛋白有Ⅰ型胶原α1、CD44、免疫球蛋白重链、1,3,4-三磷酸肌醇5/6激酶、CD38、经典蛋白激酶Cβ型、一氧化氮合成酶、磷脂酰肌醇磷脂酶C.
整合素β1(ITGB1)是整合素家族的跨膜蛋白,作为主要的细胞黏附分子和细胞外基质(ECM)相关分子,其激活的下游通路参与了多种细胞功能的调控,包括增值、存活、迁移和分化[18]. 对小菜蛾(Plutellaxylostella)ITGB1基因进行克隆表达,发现其在昆虫免疫的包囊作用中起到重要作用,表明ITGB1蛋白在小菜蛾血细胞免疫过程中发挥重要作用[19]. 在稀有鮈鲫(Gobiocyprisrarus)的研究表明:ITGB1的缺失对凋亡相关基因的表达有一定影响,同时降低了草鱼肠孤病毒(GCRV)的进入效率[20]. 暗纹东方鲀受到嗜水气单胞菌感染后脾脏ITGB1蛋白表达量上调,说明其可能参与了暗纹东方鲀抵抗病原菌感染过程,其具体机制还有待进一步探究.
血浆血管性血友病因子(VWF)是一种重要的血浆成分,参与血小板的黏附和聚集过程[21]. 斑马鱼中的研究表明,斑马鱼血小板聚集过程中VWF表达上调[22]. 暗纹东方鲀受到嗜水气单胞菌感染后脾脏VWF蛋白表达量上调,说明嗜水气单胞菌感染后可能造成暗纹东方鲀血小板聚集进而导致血管堵塞.
CD44是一种细胞表面糖蛋白,存在于许多正常细胞,主要是淋巴细胞和上皮细胞[23]. 通过多种途径广泛参与细胞-细胞/基质间黏附、细胞内外信号传导及淋巴细胞归巢等重要功能[24],其多种生理活性表现在多种疾病的病理中,暴露癌症、关节炎、细菌和病毒感染等[25]. 目前,硬骨鱼中CD44相关研究未见报道. 在哺乳动物中,有研究表明,CD44可以通过促进巨噬细胞中的CCL2的表达来调节细胞的迁移,TNF-α可以显著提高细胞中CD44的表达[26];CD44与糖胺聚糖透明质酸(HA)相互作用可介导白细胞迁移和活化[27];利用CD44缺失小鼠,确定了CD44在炎症部位白细胞募集中的作用,同时揭示了CD44在限制炎症反应和解决炎症方面的作用[28]. 暗纹东方鲀受到嗜水气单胞菌感染12 h后脾脏CD44蛋白表达量下调,其基因和蛋白水平动力学变化有待进一步确定,其功能有待进一步探究.
钙离子是细胞内最古老、作用最广泛的信号物质,钙离子参与细胞增殖、分化、生长、衰老等生命活动的信息传递与调控,并在各种生理活动中起着十分重要的作用[29-30]. 细胞质钙离子来源主要有2个:一个是胞外钙离子内流,另一个是细胞器钙离子外流[31]. 胞外钙离子内流存在3种机制:(1)配体结合触发的钙离子跨膜流动,即受体门控性钙通道(ROCs);(2)细胞膜去极化激活电压门控性钙通道(VOCs)导致的钙内流;(3)当细胞内钙离子耗竭,为了补充钙离子不足,储存开启性钙通道(SOCs)开放,促使钙离子大量内流. 胞内钙离子外流是指钙库(内质网或肌质网)中钙离子通过钙离子释放通道1,4,5-三磷酸肌醇(InsP3)受体和Ryanodine受体(RyR)进入细胞质[30]. 钙库中钙储量下降时,钙离子可以从细胞外进入细胞,这一过程在基因表达调控以及免疫反应中都发挥着重要作用[29]. 钙离子外排主要有Na+/Ca2+交换体可协助钙离子从细胞中排出和内质网上的Ca2+-ATP酶(SERCA)、线粒体上的MCU将细胞质钙离子摄入内质网或线粒体中[32-33]. 暗纹东方鲀脾脏感染病原菌后,钙离子信号通路相关蛋白如免疫球蛋白重链(IGH)、CD38、ITPK、PRKCB、NOS1和PLCD均发生下调,而流式细胞术结果显示细胞内钙离子含量在6 h开始出现显著上调(图1B),可能是由于病原菌进入后与细胞表面BCR结合后激活了初始钙离子信号通路[34]. CD38催化环腺苷二磷酸核糖(cADPR)合成,通过作用于鱼尼丁受体(RyR)参与细胞内钙库的钙动员[35],其表达量的下调说明病原菌感染后暗纹东方鲀胞内钙离子浓度的上调可能主要是胞外钙离子内流导致的. 钙离子信号通路相关蛋白在抵抗病原菌中的功能有待进一步研究.
综上所述,本研究应用TMT蛋白质组学技术,定量分析了暗纹东方鲀感染嗜水气单胞菌后脾脏蛋白质组的表达变化,并对差异表达蛋白在参与的生物学过程、分子功能、亚细胞定位以及富集通路等进行了归纳整理,并深入分析了免疫相关蛋白功能,为揭示嗜水气单胞菌的分子致病机制奠定了理论基础.

