内质网应激相关性细胞凋亡在HMGB1介导严重烧伤小鼠脾脏树突状细胞功能障碍中的作用
吴 瑶 许碧磊 ,2 郭 方 董 宁 于 燕 祝筱梅 姚咏明
(1.解放军总医院医学创新研究部创伤修复与组织再生研究中心,北京 100048;2.武汉市普仁医院体检中心,湖北 武汉 430081)
脓毒症和多器官功能障碍综合征(MODS)是现代重症医学的难题,其确切发病机制尚未充分理解,尤其是对机体免疫功能紊乱的关键发病环节以及可调控的作用靶点认识不足,尚没有可应用于临床的行之有效的防治措施[1-3]。树突状细胞(dendritic cell, DC)是体内功能最强的专职抗原呈递细胞,其大量凋亡以及抗原呈递能力的降低是机体免疫功能抑制、抗感染能力下降、并发脓毒症的关键环节[4]。我们团队的前期研究表明,过度的内质网应激(endoplasmic reticulum stress,ERS)诱导DC大量凋亡在严重烫(烧)伤小鼠免疫功能紊乱发生的信号机制中具有重要意义[5-6]。但是目前对于过度ERS反应的关键诱发因素尚不明确。高迁移率族蛋白B1 (high mobility group box-1 protein, HMGB1) 作为一种重要的晚期炎症因子,参与了脓毒症病理过程。本研究探讨HMGB1是否通过诱导ERS反应导致烧伤小鼠脾脏DC过度凋亡,以及拮抗HMGB1对烧伤小鼠的保护作用及机制。
1 材料与方法
1.1 实验材料 健康 Balb/C小鼠(SPF清洁级),雄性,6~8周,体重(20±2)g,购自北京华阜康科技股份有限公司。CD11c+免疫磁珠、MS柱、LS柱购自德国Miltenyi Biotec公司;藻红蛋白标记抗CD11c+抗体(PE-CD11c)、细胞凋亡检测试剂盒购自美国BD公司;HMGB1购自美国R&D公司;HMGB1兔多克隆中和抗体委托北京康为世纪生物科技有限公司定制;Salubrinal(Sal)购自美国Selleck公司;抗GRP78(Bip)抗体、CHOP抗体购自美国Cell Signaling Test公司;β-actin抗体、辣根过氧化物酶(HRP)标记羊抗兔二抗、HRP标记羊抗小鼠二抗购自北京普利莱基因技术有限公司;小鼠淋巴细胞分离液购自天津灏洋生物公司;磷酸盐缓冲液(PBS)、RPMI-1640、胎牛血清购自依科赛生物科技有限公司。MiniMACS磁性分选仪为德国Miltenyi Biotec公司产品;流式细胞仪为美国BD公司产品;电泳仪(DYY-7)为北京六一仪器厂产品;凝胶成像系统Image Quant LAS 4000 为美国GE公司产品。
1.2 小鼠严重烧伤模型复制 小鼠禁食12 h,经5%水合氯醛0.2 ml腹腔注射进行麻醉,刮剃背部和侧腹部毛后,浸于(99.0±0.5)℃水浴中7 s,形成12% TBSA的Ⅲ度烧伤区,烧伤部位涂20 g/L碘伏进行抗感染处理(每日2次),伤后1 h耳后皮下注射1 ml/kg林格液抗休克。假伤组小鼠除所浸水浴为37 ℃外,其余处理同烧伤组。
1.3 动物分组与处理 ①烧伤模型小鼠和假伤组小鼠于烧伤后1、2、3、5、7 d处死小鼠,留取血清和脾脏,酶联免疫吸附法(ELISA)检测血清HMGB1水平,Western Blot检测脾脏HMGB1蛋白水平。②将烧伤模型小鼠和假伤组小鼠均随机分为3组:HMGB1抗体干预组于烧伤(或假伤)后6 h、18 h经尾静脉注射定制的抗HMGB1中和抗体(兔免疫血清纯化产物,抗体效价1:27 000,每只200 μl);未免疫血清干预组同样方法给予等量的未经免疫的兔血清IgG;生理盐水对照组同样方法注射等量生理盐水。部分批次小鼠用于7 d生存率观察,各实验组样本数为:烧伤组44只,烧伤后HMGB1抗体干预组45只,烧伤后未免疫血清干预组44只,假伤组(生理盐水对照)16只。另有部分小鼠于48 h后处死,留取脾脏,Western Blot方法检测脾脏DC中ERS相关分子蛋白的表达(n=3)。③ 正常小鼠给予亚致死量HMGB1(每只10 μg或20 μg)经尾静脉进行体内注射,48 h后处死小鼠,留取脾脏,分离提纯CD11c+DC后用于ERS相关分子蛋白水平的检测。
1.4 小鼠脾脏DC分离与鉴定 无菌留取小鼠脾脏,严格按照试剂盒操作说明,应用鼠淋巴细胞分离液(Ficoll-Paque)分离出单个核细胞悬液,与CD11c+免疫磁珠共孵育,用MiniMACS磁化细胞分选仪分离纯化,所获得的DC细胞进行细胞活性鉴定和纯度检测,确定适合用于后继实验。
1.5 HMGB1诱导DC凋亡及ERS反应的体外实验正常小鼠脾脏DC 用细胞培养液(RPMI-1640,含10%胎牛血清)重悬,调整为2×106/ml,接种到细胞培养板,细胞培养箱中进行适应性培养(37oC,5%CO2),24 h后随机分为以下5组:正常对照组,1 ng/ml HMGB1低剂量刺激组,10 ng/ml HMGB1中剂量刺激组,100 ng/ml HMGB1高剂量刺激组,以及salubrinal (Sal)干预组(20 μmol/L Sal预处理1 h后加入HMGB1刺激),培养24 h后收集各组细胞,检测DC凋亡及DC中ERS相关分子蛋白水平。
1.6 DC凋亡率测定 收集细胞,预冷PBS洗涤2次,用 100 μl结合缓冲液(binding buffer)重悬,按照试剂盒说明进行PE-Annexin Ⅴ和7-AAD染色,避光孵育(室温,15 min)后,流式细胞仪检测细胞凋亡。
1.7 Western blot检测小鼠脾脏HMGB1及ESR相关分子GRP78、XBP-1、sXBP-1、CHOP蛋白表达 收集细胞,用预冷的PBS洗涤2次后离心弃上清,细胞团加入200 μl细胞裂解液 (含混合蛋白酶抑制剂)充分混匀,放置冰上30 min,然后浸入液氮反复冻融3次,低温高速离心机12 000 r/min离心15 min,留取上清,利用BCA法进行蛋白浓度测定,调整蛋白浓度一致后按比例与上样缓冲液混匀,98 ℃煮沸5 min,冷却,4 ℃冰箱保存。经10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行蛋白电泳后电转至聚偏氟乙烯(PVDF)膜,室温下应用10%脱脂奶粉溶液孵育2 h,按顺序进行相应的一抗、二抗孵育后,凝胶成像系统进行显影,Quantity One软件分析,结果以灰度值表示。
1.8 统计学方法 应用SPSS 17.0软件,计量资料以表示,多组间比较采用单因素方差分析(ANOVA),q检验进行组间两两比较;χ2检验比较各组存活率差异。双侧P<0.05认为有统计学差异。
2 结 果
2.1 严重烧伤致HMGB1水平升高及抗HMGB1中和抗体的保护作用 与假伤组相比,小鼠脾脏及血清HMGB1蛋白水平在烧伤后1 d即有明显升高,于烧伤后2~3 d达到峰值,并持续保持较高水平至5~7 d(见图1)。于伤后6、18 h给于抗HMGB1中和抗体干预,以未免疫兔血清IgG为对照,观察小鼠7 d生存率,结果显示,严重烧伤小鼠7 d存活率为38.64%(17/44只),抗HMGB1中和抗体可有效提高烧伤小鼠7 d存活率至71.11%(32/45只),且明显较未免疫血清干预组存活率52.27%(23/44只)为高(P<0.05,见图2)。
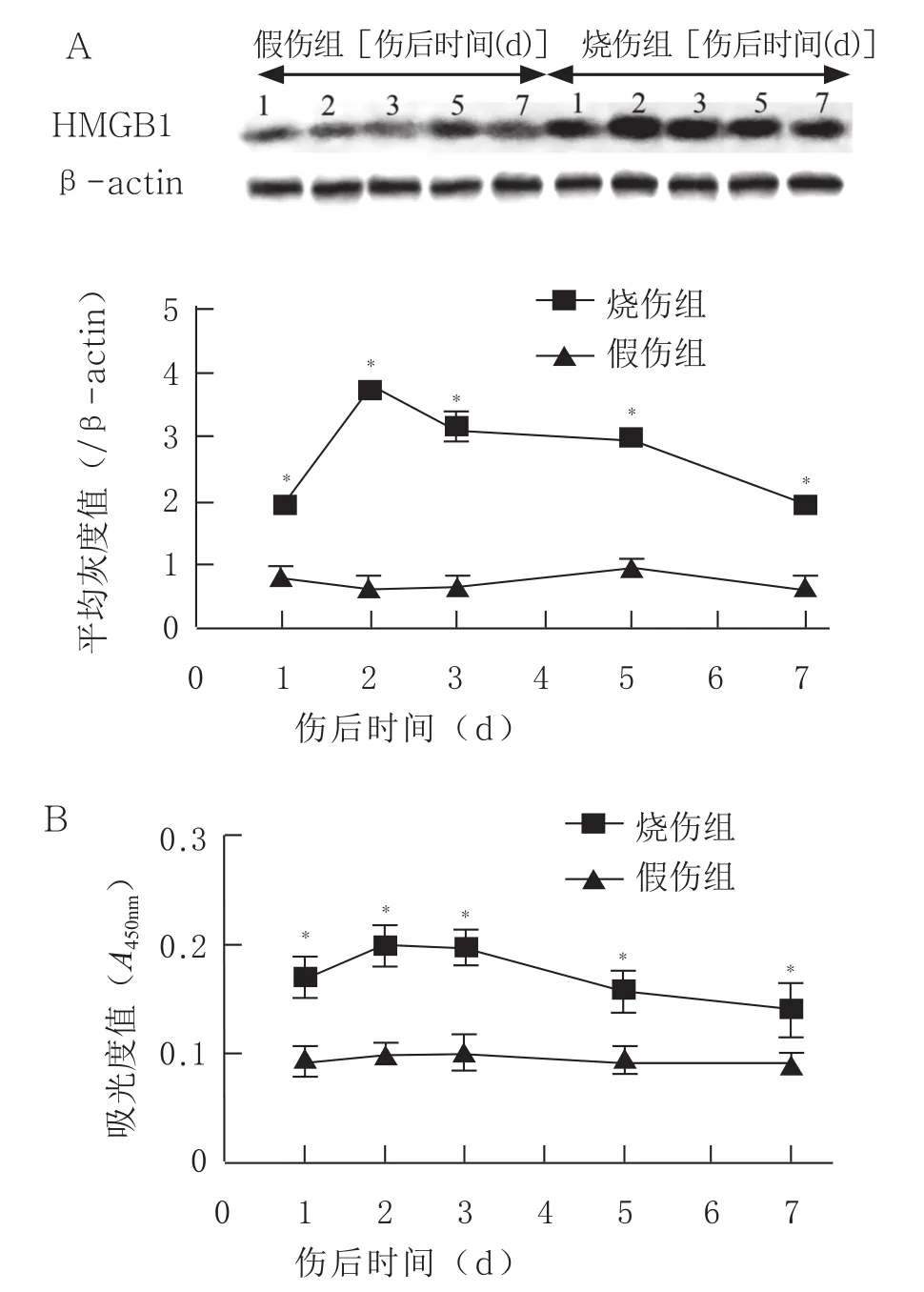
图1 小鼠脾脏及血清中HMGB1蛋白检测(A:Western blot技术分析小鼠脾脏组织HMGB1含量;B:ELISA方法检测小鼠血清HMGB1水平)
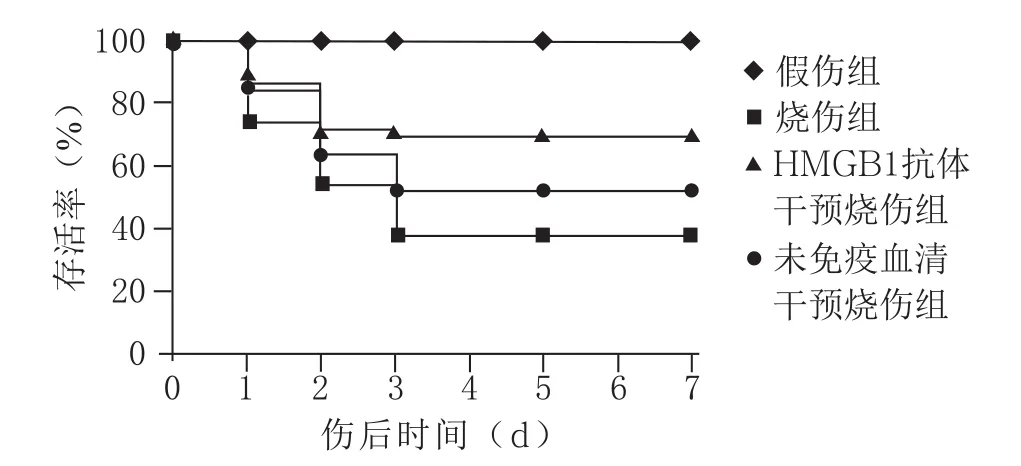
图2 抗HMGB1中和抗体干预对严重烧伤小鼠生存率的影响
2.2 HMGB1诱导烧伤小鼠脾脏DC的过度ERS反应 小鼠给予抗HMGB1中和抗体或未免疫血清干预,48 h后处死,检测脾脏DC中ERS相关分子蛋白的表达,结果显示,拮抗HMGB1可显著抑制烧伤应激引起的小鼠脾脏DC中的ERS反应,与未免疫血清干预组相比,DC中的ERS标志分子GRP78表达水平以及XBP-1的表达和活化水平(sXBP-1)均明显降低(P<0.05)。见图3。
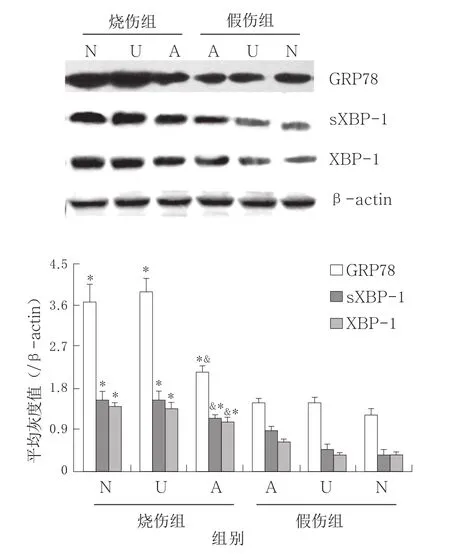
图3 HMGB1中和抗体减轻烧伤小鼠脾脏DC中ERS反应
应用重组HMGB1攻击正常小鼠,可诱导脾脏DC发生明显的ERS。不同剂量HMGB1体内注射均可诱导GRP78表达升高及XBP-1表达/活化水平的上调,且呈一定的剂量依赖性。见图4。
2.3 HMGB1对DC凋亡的直接诱导效应及其与ERS的相关性 HMGB1体外刺激可诱导小鼠脾脏DC发生凋亡,与正常对照组相比,DC经HMGB1刺激24 h,凋亡率明显增加(P<0.05),以10 ng/ml组升高最为显著(P<0.01),见图5。同时检测DC中ERS相关分子蛋白水平, 结果显示,HMGB1刺激可直接诱导DC中ERS相关蛋白表达增加(P<0.05),其中GRP78表达随HMGB1刺激浓度的增加而增加,ERS相关性细胞凋亡途径中的关键分子CHOP在10 ng/ml剂量组表达最强(P<0.01),与HMGB1诱导DC凋亡效果一致,见图6。

图4 HMGB1攻击诱导正常小鼠脾脏DC中ERS反应的发生

图5 不同浓度HMGB1刺激对DC凋亡的影响(n=3)
为探讨ERS在HMGB1诱导DC凋亡中的作用,我们进一步应用Salubrinal (可缓解ERS反应,减轻ERS所致细胞凋亡)进行干预。DC给予Sal预处理(20 μmol/L,1 h)可明显减轻不同剂量HMGB1刺激诱导的DC凋亡(P<0.01),见图7。与单独应用HMGB1刺激DC相比,给予Sal预处理的DC 其ERS相关细胞凋亡的关键分子CHOP蛋白表达水平明显降低(P<0.05),见图8。
3 讨 论
严重创(烧)伤后机体很早期即出现细胞免疫功能障碍的现象,机体免疫功能紊乱是创伤并发脓毒症的重要病生理基础[3]。目前已知DC是体内功能最强的专职抗原呈递细胞,被认为是免疫系统的启动者,处于免疫调控中心位置[7-8]。研究表明,烧(创)伤感染并发脓毒症过程中,DC的凋亡以及免疫功能异常是导致机体免疫功能障碍的关键环节。但是,对于脓毒症状态下DC凋亡的具体分子机制及可能的调控环节目前尚未阐明。进一步明确烧(创)伤后影响DC功能状态的主要因素及探索可能的调控靶点具有重要病理生理意义及临床实用价值。
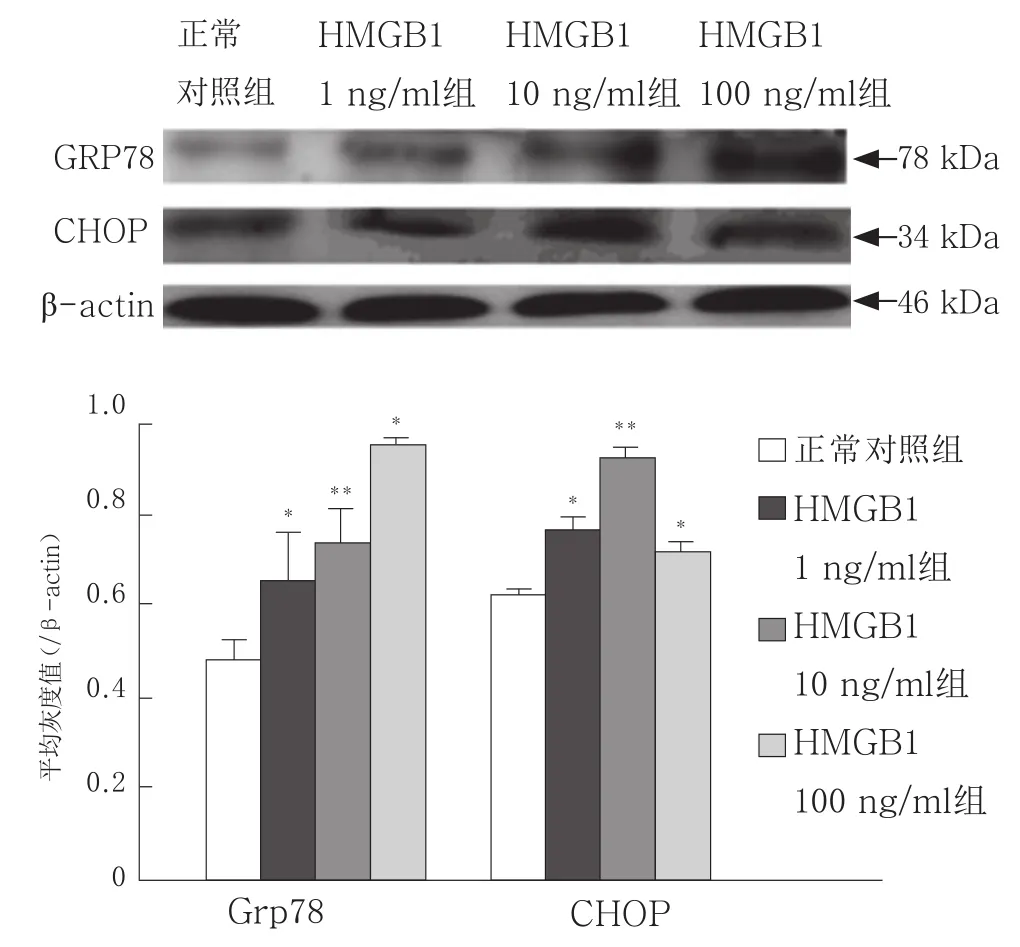
图6 不同浓度HMGB1刺激对DC ERS相关蛋白表达的影响(n=3)

图7 Sal干预对HMGB1诱导DC凋亡率的影响(n=3)
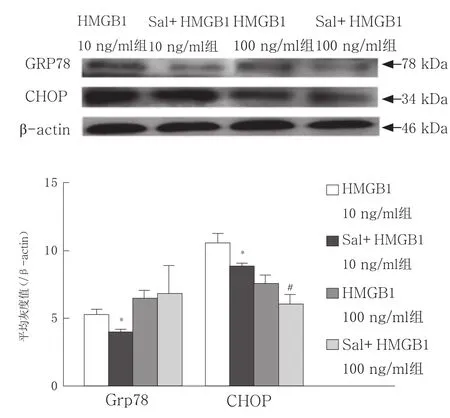
图8 Sal干预对HMGB1诱导DC中ERS相关蛋白表达的影响(n=3)
HMGB1是一种非组蛋白染色体结合蛋白,进化上高度保守,能够参与基因转录、DNA重组、修复等多种生物学过程。存在于真核细胞的细胞核中的HMGB1可分泌至细胞外,参与机体免疫反应的调控,在脓毒症发病及进展中起着重要作用。近年来研究证实,严重烧(创)伤时血清及组织中HMGB1水平升高与严重感染和休克患者的不良预后及脓毒症模型动物的高死亡率密切相关[9-10]。多项研究证实,拮抗HMGB1的生物学作用可有效保护损伤的组织细胞[11-12]。本研究中,严重烧伤小鼠血清及脾脏组织内HMGB1蛋白水平明显升高,抗HMGB1中和抗体干预可提高烧伤小鼠生存率,具有明确保护作用,与前期报道结果一致。HMGB1除作为晚期促炎因子在炎症反应过程中发挥潜在的中心作用外,还作为免疫刺激因子调控免疫细胞的功能状态及凋亡,介导机体免疫功能紊乱,对感染、休克、烧(创)伤、脓毒症等急危重症的病程进展发挥重要作用[13]。本室前期研究表明,HMGB1作为一种潜在免疫调节因子,对DC以及T淋巴细胞的功能状态具有重要调节作用,特别是对DC的成熟分化可发挥双向调控作用[14]。本研究中细胞实验结果证实,HMGB1对体外培养的正常小鼠脾脏DC的凋亡具有直接诱导效应,提示严重烧(创)伤后体内高水平HMGB1诱导DC大量凋亡可能是导致机体免疫功能发生紊乱的重要机制所在。
ERS是近年来广受关注的一种真核细胞内重要的内源性保护机制,对提高应激状态下细胞适应力和耐受力至关重要。但ERS持续存在或者反应过强时则激活ERS相关性细胞凋亡通路(ERassociated death,ERAD)[15],引发细胞大量死亡。本室前期研究结果显示,ERS在介导HMGB1对DC免疫功能调节中具有重要意义[5];而且,过度ERS诱导细胞凋亡通路活化是严重烧伤小鼠脾脏DC大量凋亡以及机体免疫功能障碍发生的重要机制[6,16]。本研究在前期工作成果的基础上,进一步探讨在烧(创)伤后体内高水平HMGB1刺激诱导DC凋亡的信号机制中ERS的地位及意义,以深入探索DC凋亡机制中的可干预环节。研究结果显示,正常小鼠进行重组HMGB1体内注射可诱导脾脏DC中ERS反应的重要生物学标志分子GRP78及ERS介导细胞凋亡的关键分子CHOP的表达水平明显上调。而且,本实验中还发现,严重烧伤小鼠给予抗HMGB1中和抗体干预可缓解脾脏DC中的ERS反应水平。上述实验结果提示,严重烧伤后体内高水平HMGB1是诱导DC内发生明显ERS反应以及ERS相关性细胞凋亡的重要因素,缓解过激的ERS反应水平可能是抗HMGB1中和抗体保护效应的重要机制所在。
进一步的体外细胞实验发现,HMGB1诱导DC凋亡过程中伴有明显的ERS反应,HMGB1刺激诱导DC中GRP78蛋白表达上调,并随刺激浓度增加而增加;CHOP蛋白表达水平明显上调,与DC凋亡趋势一致。而且,我们应用一种明确可减轻ERS相关性细胞凋亡的选择性eIF2α脱磷酸作用抑制剂Sal[17]对DC进行预处理,可明显减轻HMGB1诱导的DC凋亡的发生。这些数据提示ERS相关性细胞凋亡通路的活化在HMGB1诱导DC凋亡机制中发挥重要作用。
本研究中初步探讨了HMGB1刺激诱导DC发生ERS相关性细胞凋亡及其与严重烧伤小鼠脾脏DC功能障碍间的内在联系。拮抗严重烧伤小鼠体内高水平HMGB1作用可有效缓解脾脏DC中过激ERS反应;而且,缓解ERS反应水平的干预措施可降低HGMB1诱导的ERS相关性细胞凋亡。明确调控ERS的确切分子信号机制及可能的干预靶点,寻找控制ERS反应“适度” 的有效调控措施,将为改善脓毒症患者免疫细胞功能状态、寻找脓毒症治疗靶标、寻求脓毒症新的干预方法提供新思路。

