叠鞘石斛叶黄酮类成分的“点-线-面”质量分析*
阮沛桦,邓红,2,傅咏梅,张蜀,2,郭彩娥,林俊强,李志超
(1.广东药科大学广东省药物新剂型重点实验室,广州 510006;2.广东药科大学/广东省局部精准药物递药制剂工程技术研究中心,广州 510006;3.国药集团广东环球制药有限公司,佛山 528000;4.广东省清远市中医院/广东省鲜药和民族医药工程技术研究中心,清远 511500)
叠鞘石斛[DendrobiumaurantiacumRchb.var.Denneanum( Kerr.) Z.H.Tsi.]被收载于2010年版《四川省中药材标准》[1],是兰科植物叠鞘石斛栽培品的新鲜或干燥茎,是四川省著名道地药材嘉定石斛的主要品种,具地方特色,是我国国家地理标志产品,且在广东、广西、贵州、云南等地常作为石斛药材临床使用[2-3]。叠鞘石斛临床上有滋阴除热、养胃生津之功效,入选国家石斛林木种质资源库,但其生长环境特殊,生长缓慢,生长期长,繁育系数低,资源一旦被破坏将难以恢复[4]。近年来,随着对石斛研究的深入,发现石斛中除多糖外[5],黄酮类成分也是其另一重要活性部位,主要分布于叶内[6]。国内外研究仍主要集中在石斛茎的多糖成分上,叶的研究基础相对薄弱。文献报道石斛黄酮药理作用明显,尤其是其具有突出的抗氧化能力[7-11]。叠鞘石斛叶含黄酮类成分较高,对其进行研究开发具有广阔的前景,也有利于中药资源的综合利用与整合。笔者在本实验采用超高效液相色谱(ultra performance liquid chromatography,UPLC)-二极管阵列检测器(photo diode array,PDA)法建立10批叠鞘石斛叶指纹图谱,并进行分析比较,同时测定叶中芹菜素-6,8-二-C-葡萄苷、异夏佛塔苷、芦丁、总黄酮含量,由单成分的“点”、多成分的“线”,到指纹图谱全成分的“面”,以期为叠鞘石斛叶含量控制提供依据,为黄酮类成分的含量测定提供新思路。
1 仪器与试药
1.1仪器 AcQuity UPLC,配置PDA(美国Waters公司);BSA224S-CW型电子分析天平(赛多利斯仪器北京有限公司,感量:0.1 mg)、CP2250型电子分析天平(赛多利斯仪器北京有限公司,感量:0.01 mg);UV-1800紫外-可见分光光度仪(日本岛津公司);HK3300H超声波清洗仪(上海科导超声仪器有限公司)。
1.2试药 芹菜素-6,8-二-C-葡萄苷对照品(含量:99.9%,批号:F0940192)、异夏佛塔苷对照品(含量:98.7%,批号:F0930336)均购自中山市成诺生物科技有限公司;芦丁对照品(纯度:97.5%,批号:110842-201709)购自中国食品药品检定研究院。叠鞘石斛叶[批次S1~S10(生长年份)分别为云南181105(一年生)、云南190520(两年生)、四川19041101(一年生)、四川19041102(一年生)、四川19041103(两年生)、四川19041104(两年生)、四川19041105(两年生)、四川19041106(三年生)、四川19041107(四年生)、四川19041108(四年生)],均由云南省文山壮族苗族自治州麻栗坡态合堂野生石斛保育有限公司提供,经由广东药科大学/广东省局部精准药物递药制剂工程技术研究中心中药室何伟教授鉴定为正品。乙腈、甲醇、四氢呋喃、磷酸为色谱纯。其他试剂均为分析纯,水为蒸馏水。
2 方法与结果
2.1三种单一成分及总黄酮成分含量测定方法
2.1.1色谱条件 AcQuity UPLC HSS T3 C18色谱柱(2.1 mm×100 mm,1.8 μm);体积流量:0.3 mL·min-1;检测波长:337 nm;柱温:30 ℃;进样体积:2 μL;流动相A为四氢呋喃-乙腈-甲醇(10:22:5);流动相B为0.05%磷酸溶液,梯度洗脱(0~9 min,9%→10%A;9~10 min,10%→11%A;10~12 min,11%→11.5%A;12~13 min,11.5%→14.5%A;13~20 min,14.5%→15%A;20~25 min,15%A;25~60 min,15%→30%A;60~65 min,30%→9%A)。
2.1.2对照品溶液的制备
2.1.2.1芹菜素-6,8-二-C-葡萄苷对照品储备液 精密称取芹菜素-6,8-二-C-葡萄苷10.00 mg,置10 mL量瓶,加甲醇制成每毫升含对照品1.000 mg的溶液。
2.1.2.2异夏佛塔苷对照品储备液 精密称取异夏佛塔苷9.94 mg,置20 mL量瓶,加甲醇制成每毫升含对照品0.497 mg溶液。
2.1.2.3芦丁对照品储备液 精密称取芦丁9.96 mg,置20 mL量瓶,加甲醇制成每毫升含对照品0.498 mg溶液。
2.1.2.4混合对照品溶液 取芹菜素-6,8-二-C-葡萄苷、异夏佛塔苷、芦丁对照品储备液适量,加甲醇制成每毫升约含各对照品100 μg的溶液。
2.1.3供试品溶液的制备 精密称取叠鞘石斛叶粉末0.1 g[过三号筛,筛孔内径(355±13) μm)],置25 mL具塞锥形瓶,精密加入70%甲醇10 mL,称定质量,超声处理45 min(频率53 kHz,功率350 W),放冷,70%甲醇补足损失质量,滤过,即得。
所有患者术后72 h行颅脑增强MRI检查肿瘤切除情况,根据Simpson分级标准,达到Ⅰ级 58例,Ⅱ级13例,Ⅲ级9例。术后送病理检查均诊断为脑膜瘤,Ⅰ级良性脑膜瘤59例,Ⅱ级非典型性脑膜瘤21例。术后即时发现,8例多饮多尿者中6例症状缓解,2例无明显改善;5例并发一过性尿崩;4例嗅觉减退;4例颅内感染;1例脑脊液漏;1例出现高热、血糖升高等严重下丘脑反应而死亡;1例大量出血形成脑疝而死亡。随访2~7.5年,平均(5.4±1.4)年,56例视力不同程度的改善,21例无明显变化,3例视力减退。11例复发,复发率为13.8%,再次行手术治疗。
2.1.4叠鞘石斛叶指纹图谱的建立及黄酮色谱峰的确定 精密吸取各批次叠鞘石斛叶供试品溶液2 μL,在“2.1.1”项色谱条件下进样,记录色谱图,将图谱导入国家药典委员会中药色谱指纹图谱相似度评价软件(2012A版),见图1,发现四川产地样品成分较云南产地样品成分多。以S1样品的色谱图作为参照图谱,时间窗口设置为0.1,进行多点校正,采用平均数法生成对照图谱,共标定出29个峰,除峰2,19,21,22,23,28之外,其余23个峰为共有峰。8批四川产样品相似度为0.968~0.995,2批云南产样品相似度为0.982,10批样品与对照图谱的相似度为0.497~0.987。说明不同产地、生长年份等因素都是造成叠鞘石斛叶成分、含量之间差异性的因素。经二极管阵列检测器对全部色谱峰的光谱扫描分析(220~380 nm),除峰1,2,4,11外,其他25个色谱峰所代表的成分可定性为黄酮类物质,结果见表1。采用对照品保留时间定位结合紫外光谱信息,鉴别出2个黄酮碳苷峰(峰5为芹菜素-6,8-二-C-葡萄苷,峰9为异夏佛塔苷)和1个黄酮醇峰(峰16为芦丁)。

图1 10批叠鞘石斛叶指纹图谱
2.1.5测定法 建立UPLC-PDA法同时测定黄酮类成分的含量,以外标一点法计算芹菜素-6,8-二-C-葡萄苷、异夏佛塔苷、芦丁3种成分含量;将定性为黄酮类化合物的色谱峰峰面积加和,代入芹菜素-6,8-二-C-葡萄苷质量-峰面积线性回归方程,计算总黄酮含量。
2.1.6方法学考察
2.1.6.1专属性考察 精密吸取“2.1.2.4”项混合对照品溶液与“2.1.3”项供试品溶液各2 μL,按“2.1.1”项色谱条件进样,结果见图2。峰5为芹菜素-6,8-二-C-葡萄苷,峰9为异夏佛塔苷,峰16为芦丁。
2.1.6.2线性关系考察 取芹菜素-6,8-二-C-葡萄苷、异夏佛塔苷、芦丁对照品储备液适量,稀释成芹菜素-6,8-二-C-葡萄苷浓度为5.000,10.00,20.00,25.00,50.00,100.0,300.0 μg·mL-1、异夏佛塔苷浓度为4.970,7.455,9.940,11.93,14.91,24.85,49.70 μg·mL-1、芦丁浓度为4.980,9.960,14.94,19.92,24.90,29.88,49.80 μg·mL-1对照品溶液,按“2.1.1”项色谱条件进样,以质量浓度(μg·mL-1)为横坐标(X),以峰面积(μV·S)为纵坐标(Y)绘制标准曲线,结果见表2,可知各成分在各自范围内线性关系良好。

表1 黄酮类成分吸收峰
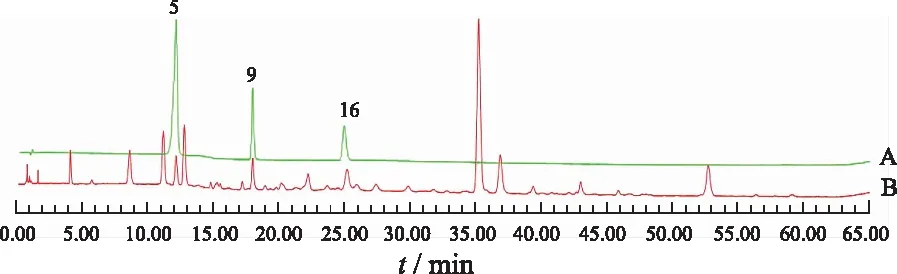
A.混合对照品;B.供试品;5.芹菜素-6,8-二-C-葡萄苷;9.异夏佛塔苷;16.芦丁。

表2 各成分线性关系
2.1.6.3精密度实验 精密吸取叠鞘石斛叶(批号:181105)供试品溶液2 μL,按“2.1.1”项色谱条件连续进样6次,测得6份样品中芹菜素-6,8-二-C-葡萄苷、异夏佛塔苷、芦丁、总黄酮峰面积RSD分别为0.45%,0.80%,1.87%,0.38%(n=6),表明仪器精密度良好。
2.1.6.5稳定性实验 精密吸取叠鞘石斛叶(批号:181105)供试品溶液2 μL,按“2.1.1”项色谱条件分别在0,1,2,3,4,6 h进样测定,测得芹菜素-6,8-二-C-葡萄苷、异夏佛塔苷、芦丁、总黄酮峰面积RSD分别为1.25%,0.32%,1.03%,0.59%(n=6),表明供试品溶液在室温下6 h内稳定性良好。
2.1.6.6加样回收率实验 精密称取芹菜素-6,8-二-C-葡萄苷、异夏佛塔苷、芦丁适量,70%甲醇稀释成芹菜素-6,8-二-C-葡萄苷浓度为5.500 μg·mL-1、异夏佛塔苷浓度为3.625 μg·mL-1、芦丁浓度为6.520 μg·mL-1的混合对照品溶液。精密称取已知含量的叠鞘石斛叶(批号:181105)粉末0.05 g,加入混合对照品溶液10 mL,其余步骤按“2.1.3”项方法平行制备6份供试品溶液,并按“2.1.1”项色谱条件进样测定,计算3种单一成分回收率;精密称取已知含量的叠鞘石斛叶(批号:181105)粉末0.05 g,加入芹菜素-6,8-二-C-葡萄苷对照品溶液(0.1308 mg·mL-1)10 mL,按“2.1.3”项方法平行制备6份供试品溶液,并按“2.1.1”项色谱条件进样测定,计算总黄酮成分回收率。芹菜素-6,8-二-C-葡萄苷、异夏佛塔苷、芦丁、总黄酮的平均回收率分别为99.15%,101.43%,96.42%,101.68%,RSD分别为2.48%,1.86%,2.29%,2.17%,结果见表3。
2.1.7样品含量测定 取样品10批,按“2.1.3”项方法制备供试品溶液,在“2.1.1”项色谱条件下测定,计算芹菜素-6,8-二-C-葡萄苷、异夏佛塔苷、芦丁、总黄酮含量(以芹菜素-6,8-二-C-葡萄苷计),结果见表4,可见产地四川的叠鞘石斛叶中芦丁和总黄酮的含量较高,产地云南的叠鞘石斛叶中芹菜素-6,8-二-C-葡萄苷较高。

表3 4种成分加样回收率实验结果
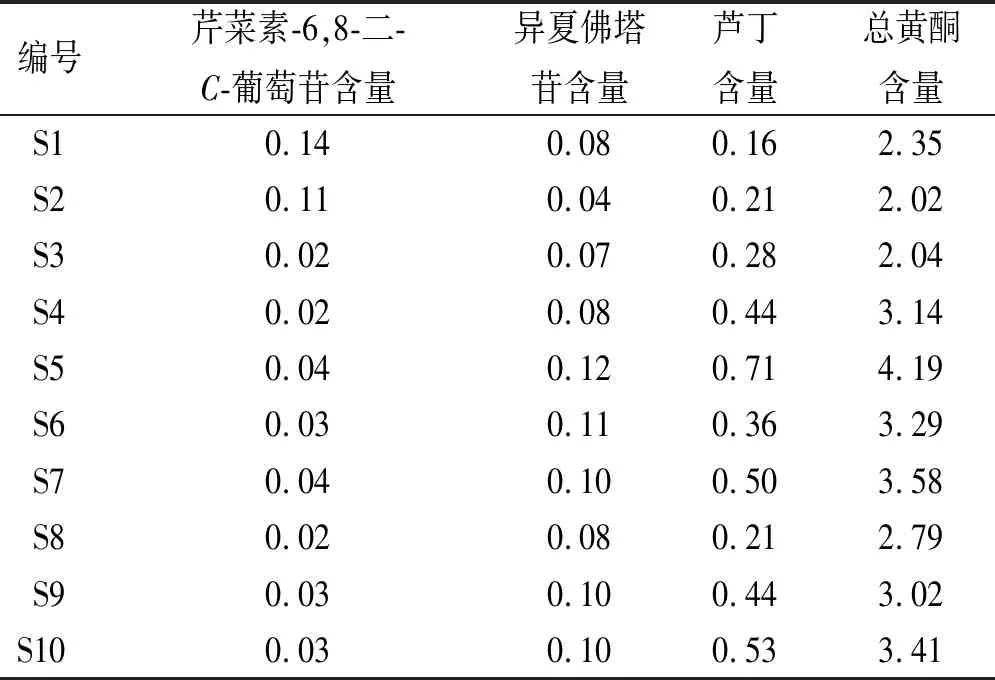
表4 4种成分含量测定结果
3 讨论
3.1总黄酮含量测定方法选择 从指纹图谱可知,黄酮类成分峰较多,但单个成分含量较低,因此有必要测定总黄酮的含量,更全方面评价石斛药材的质量。
经查阅文献可知,在中药材的黄酮含量测定方法中,NaNO2-Al(NO3)3-NaOH比色法和AlCl3比色法最常见。有研究者统计过,前者使用频率高达70%,而且多以芦丁为对照[12]。但大部分文献中黄酮含量测定方法在未进行专属性考察的情况下,直接应用上述两法进行测定,可能导致含量测定结果不准确。有研究者发现一些常见黄酮类成分(槲皮素、黄芩苷等)显色后无吸收或吸收弱,而一些非黄酮成分(阿魏酸、绿原酸)在显色后可产生最大吸收或强吸收,造成黄酮假阴性或非黄酮假阳性的错误判断[13-15]。笔者前期研究使用NaNO2-Al(NO3)3-NaOH比色法对石斛黄酮进行含量测定时发现,芦丁对照品最大吸收在510 nm附近,但供试液最大吸收波长在390 nm附近,传统比色-芦丁法无法满足专属性要求。后使用石斛黄酮的代表成分芹菜素-6,8-二-C-葡萄苷作为对照,供试液与对照液在390 nm处均有最大吸收,但阴性溶液在该波长处也有吸收,干扰测定。故使用UPLC-PDA法对石斛黄酮含量测定,将定性为黄酮类化合物的色谱峰峰面积加和,计算总黄酮含量,这为建立专属性强、准确度高的大类成分含量测定方法提供了新思路。
3.2黄酮类成分的确定 黄酮类化合物的吸收特征由桂皮酰系统引起的峰带Ⅰ(300~400 nm)及苯甲酰系统引起的带Ⅱ(220~280 nm)组成[16],本研究通过比较PDA采集的各色谱峰光谱图是否符合黄酮类物质特征,以判断该色谱峰所代表物质是否为黄酮类物质。该法较传统紫外-芦丁比色法专属性更强,准确度更高。石斛中的黄酮类成分主要是以芹菜素为苷元的多种黄酮碳苷类,最大吸收波长相近,故以芹菜素-6,8-二-C-葡萄苷作为对照计算总黄酮含量。
3.3叠鞘石斛叶选择及总黄酮的测定 石斛中黄酮类成分主要集中在叶内,实验前期采用UPLC-PAD法对不同基源石斛叶(铁皮、叠鞘、金钗石斛叶)进行筛选,发现叠鞘石斛叶分离出来的黄酮类成分最多,含量最丰富,故选取叠鞘石斛基源的叶展开黄酮类成分研究。
3.4供试品制备方法的考察 笔者在本研究分别使用回流提取法和超声提取法对样品进行提取,发现二者提取效果相当,故选择操作更为简便的后者。再对提取溶剂(60%甲醇、70%甲醇、80%甲醇、甲醇)、提取时间(15,30,45,60 min)进行考察,发现70%甲醇对待测成分的亲和力最高,提取45 min后芹菜素-6,8-二-C-葡萄苷及总黄酮含量不再增加。故提取方法选择70%甲醇超声45 min。
3.5总黄酮抗氧化活性 本研究还对10批样品的DPPH自由基抗氧化活性进行初步探究,发现总黄酮含量最高的样品S5的DPPH自由基清除率最高,抗氧化活性最强,表明叠鞘石斛叶抗氧化能力与一定浓度范围的总黄酮呈正相关。叠鞘石斛叶中各成分与抗氧化活性的关联度及其构效关系有待进一步探究。
笔者在本实验建立的“点-线-面”质量分析方法,专属性强,准确度高,符合中医传统理念的整体观,为叠鞘石斛叶及其他中药材黄酮类成分定量测定提供了参考。随着与石斛药材相关产品的进一步研究开发,以黄酮作为评价指标,将有利于更加全面地评价石斛药材质量。

