超短波对急性肺损伤大鼠炎症反应的疗效及其机制
周君 ,刘丹妮,王丽琼,王谦,李懿,屈萌艰,刘静,曾亚华,何成奇
1.四川大学华西医院康复医学科,四川成都市 610041;2.康复医学四川省重点实验室,四川成都市 610041;3.南华大学附属第一医院康复医学科,湖南衡阳市421001
急性肺损伤(acute lung injury,ALI)是指各种内、外致病因素导致的急性、弥漫性肺损伤[1]。ALI 发病机制复杂,目前尚未完全明确,但炎性递质参与的过度炎症反应被公认是ALI 发生的主要原因[2-3]。核苷酸结合寡聚化结构域样受体蛋白3 (nucleotide-binding oligomerization domain like receptor protein 3,NLRP3)炎症小体的激活在ALI 发生、发展过程中发挥重要作用[4-7]。抑制NLRP3炎症小体的激活,是控制ALI过度炎症反应的重要策略[8-11]。
超短波疗法是指利用高频振荡电流产生超高频电磁场作用于人体的高频电疗法,可促进局部血液循环,改善血管通透性,促进炎症因子的消散,发挥抗炎作用[12-15]。超短波被广泛应用于肺部炎症的对症治疗[16-19]。新型冠状病毒病(coronavirus disease 2019,COVID-19)重症患者具有ALI症状和病理表现[20]。对COVID-19患者是否使用超短波治疗,专家的意见并不完全一致[21-24]。本研究探讨超短波对ALI 的疗效及作用机制。
1 材料与方法
1.1 实验动物
3 月龄清洁级Sprague-Dawley 雄性大鼠24 只,购于湖南省斯莱克景达实验动物有限公司,实验动物合格证号SCXK(湘)2019-0004,体质量(427.0±40.7) g。饲养于南华大学实验动物中心,室温(24±2)℃,湿度(55±5)%,12 h 黑暗/光照循环交替;大鼠自由摄食、饮水。适应性饲养1周后,行后续实验。
相关操作均严格遵循我国《实验动物管理条例》和南华大学附属第一医院伦理委员会的相关规定。
1.2 主要试剂与仪器
脂多糖:北京SOLARBIO 公司。白细胞介素(interleukin,IL)-1β ELISA 试剂盒:美国PROTEINTECH公司。IL-18 ELISA 试剂盒:武汉华美生物工程有限公司。荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪、荧光PCR 板、Trizol 试剂:美国THERMO 公司。Tris 试剂:美国SIGMA 公司。引物合成及探针修饰:上海生物工程有限公司。NLRP3 一抗、IL-1β 一抗、山羊抗小鼠IgG (HRP):美国PROTEINTECH公司。caspase-1 一抗:美国CST 公司。台式冷冻离心机:中国湖南湘仪公司。光学显微镜:日本奥林巴斯株式会社。切片机:德国LEICA公司。CDB-1超短波电疗机:上海医疗器械高技术公司。
1.3 方法
随机数字表法将大鼠随机分为对照组、ALI 组和超短波组,每组8 只。后两组参照本课题组前期造模方法[8],10%水合氯醛3 ml/kg 腹腔注射麻醉,颈部正中切口,暴露气管,1 ml注射器刺入气管,缓慢滴注5 mg/ml 脂多糖5 mg/kg。对照组同法滴注等体积生理盐水。
超短波组在造模后即刻、4 h、8 h,分别予超短波干预15 min:工作频率40.68 MHz,强度50 mA,两个29×20 cm 电极板对置于塑料盒(28×20×11 cm)的上面和下面。干预时,每次取2只大鼠置于塑料盒里,大鼠可以自由活动。
对照组、ALI组不做任何干预。
造模后24 h,同法麻醉,眼眶取血4 ml,脱颈断头处死动物。取右上肺测量计算肺组织湿/干重比(wet/dry mass ratio,W/D);取左下肺行HE 染色;取右下肺液氮罐中低温保存,用于逆转录PCR (reverse transcription PCR,RT-PCR)和Western blotting检测。
1.3.1 W/D
取右上肺组织约1 cm3,干净滤纸吸干表面水分后称湿质量;肺组织锡箔包裹,60 ℃恒温箱烘烤48 h,至质量不再减少时,再次称量干质量,计算W/D。
1.3.2 HE染色
左下肺组织常规HE 染色,观察肺组织形态,参照相关评分标准[25-27]行肺组织损伤评分。分4 项:肺泡充血、出血、肺泡腔或血管壁中性粒细胞浸润或聚集、肺泡壁增厚和/或透明膜形成。依病变轻重分别评0~4 分:0 分,无病变或非常轻微病变;1 分,轻度病变;2 分,中度病变;3 分,重度病变;4 分,极重度病变。计算4项评分总和。
1.3.3 血清IL-1β和IL-18
血液标本25 ℃放置2 h,冰冻离心机3000 r/min离心30 min,取上清液600 μl,-80 ℃冰箱保存。ELISA 试剂盒测定血清IL-1β、IL-18 水平,严格按照说明书操作。
1.3.4 NLRP3、caspase-1和IL-1β mRNA表达
Trizol 提取肺组织总RNA,以样品总mRNA 为模板,行逆转录cDNA,以cDNA为模板,加入NLRP3、caspase-1 和IL-1β 上下游引物进行扩增。以β-actin 为内参。
NLRP3 引物:上游5'-CAC CTC TTC TCT GCC TAC CTG-3';下游5'-AGC TGT AAA ATC TCT CGC AGT-3'。引物间片段长181 bp。
caspase-1 引物:上游5'-CTA GAC TAC AGA TGC CAA CCA C-3';下游:5'-GGC TTC TTA TTG GCA TGA TTC CC-3'。引物间片段长128 bp。
IL-1β 引 物:上 游5'-CAG CAG CAT CTC GAC AAG AG-3';下游5'-AAA GAA GGT GCT TGG GTC CT-3'。引物间片段长123 bp。
根据动力学曲线确定样品管中荧光强度增加到特定阈值时的扩增循环数(Ct),计算2-ΔΔCt。
1.3.5 NLRP3、caspase-1和IL-1β蛋白表达
肺组织清洗、研磨、裂解,4 ℃冷冻离心机12000 r/min 离心15 min,取上清400 μl;经电泳,转膜,封闭,加NLRP3、caspase-1和IL-1β一抗、二抗孵育,显色、曝光。底片扫描,采用QuantityOne 软件进行灰度分析。
1.4 统计学分析
2 结果
2.1 W/D
ALI 组W/D 较对照组升高(P< 0.05);超短波组W/D 较ALI 组有降低趋势,但无显著性差异(P>0.05)。见表1。
2.2 HE染色
对照组肺泡结构大致正常;ALI 组肺泡壁增厚,肺间质可见大量炎性细胞浸润,肺泡可见红细胞渗出;与ALI 组比较,超短波组肺损伤程度明显减轻。见图1。
ALI 组肺损伤评分比对照组增高(P<0.05);超短波组较ALI组降低(P<0.05)。见表1。
2.3 血清IL-1β和IL-18
ALI 组血清IL-1β 和IL-18 水平较对照组升高(P<0.05);超短波组较ALI组降低(P<0.05)。见表1。
2.4 NLRP3、caspase-1和IL-1β mRNA表达
ALI 组NLRP3、caspase-1 和IL-1β mRNA 较对照组增高(P< 0.05);超短波组较ALI 组降低(P< 0.05)。见表2。
2.5 NLRP3、caspase-1和IL-1β蛋白表达
ALI 组NLRP3、caspase-1 和IL-1β 蛋白表达较对照组增高(P< 0.05);超短波组较ALI 组降低(P<0.05)。蛋白表达水平变化趋势与mRNA表达一致。见图2、表3。
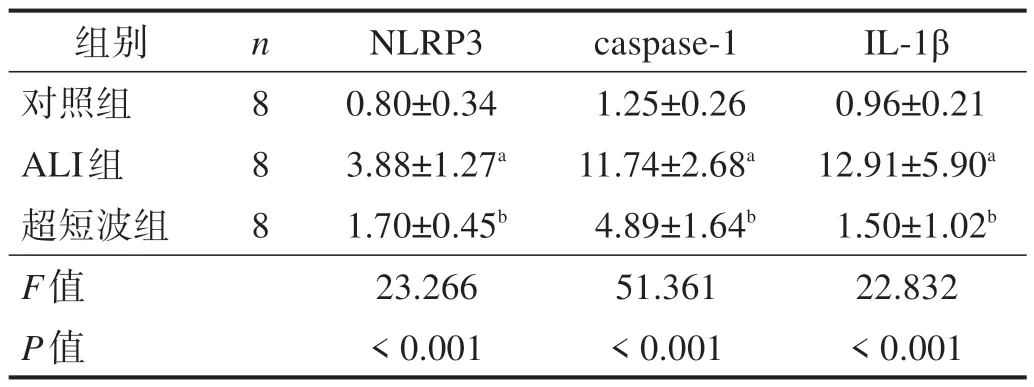
表2 各组NLRP3、caspase-1和IL-1β mRNA表达(2-ΔΔCt)

图2 各组NLRP3、caspase-1和IL-1β蛋白表达(Western blotting)
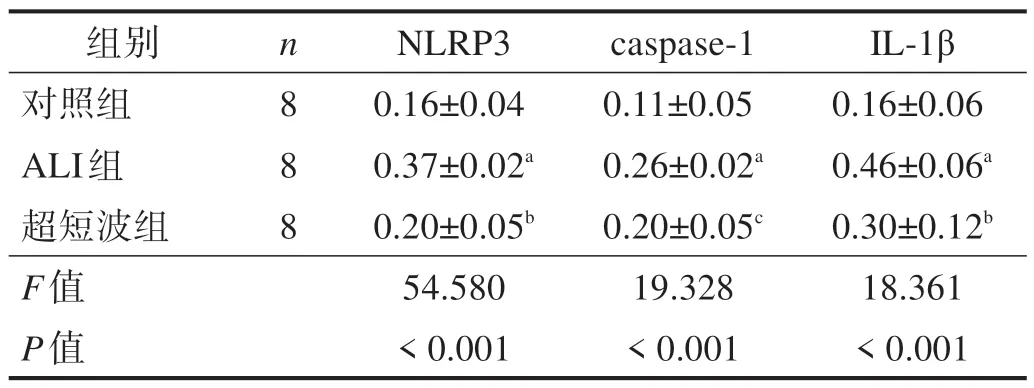
表3 各组NLRP3、caspase-1和IL-1β蛋白表达(/β-actin)
3 讨论
ALI 发病率高,病死率高,临床颇为棘手,肺内因素(重症肺炎等)和肺外因素(严重创伤、脓毒血症等)均可导致发病。病理表现为急性弥漫性毛细血管、肺泡损伤,进而引起肺不张、肺水肿,临床表现为顽固性低氧、呼吸窘迫和急性呼吸衰竭等[28-30]。目前ALI 尚缺乏特效治疗方法[31]。失控、过度的炎症反应是ALI 的根本因素[32]。超短波常用于肺部感染的对症治疗,可缩短发热时间,缓解咳嗽、咯痰症状[33]。本研究显示,超短波能抑制ALI 炎症反应,降低血清炎症因子水平,抑制ALI 后NLRP3/caspase-1/IL-1β 信号通路。
脂多糖是革兰氏阴性细菌的主要致病成分,常被用来复制ALI动物模型[34-35]。ALI后,肺毛细血管通透性增加,炎性递质、蛋白进入肺泡和肺间质,引起肺水肿;炎症因子损伤肺泡上皮细胞,导致肺泡表面活性物质生成减少,肺泡表面张力增大,肺泡毛细血管中液体向肺泡内滤出增多,加重肺水肿。本研究显示,ALI 后,肺组织W/D 升高,出现严重肺水肿;超短波治疗可能有降低肺水肿的作用,但尚不明确。有的研究中,肺组织干重于80 ℃烘干48 h 后测量[36-37],本研究只60 ℃烘烤48 h,烘烤不足可能对结果有影响。
过度炎症反应是本病发生的重要原因[38]。本研究显示,ALI 大鼠炎性损伤严重,超短波治疗能减轻肺损伤程度,抑制炎症因子释放。ALI 的病理特征为进行性炎症失控,肺巨噬细胞焦亡可能是部分原因。巨噬细胞焦亡会释放促炎症因子IL-1β 和IL-18[39],IL-1β和IL-18 是NLRP3 炎症小体激活的产物,也可在支气管肺泡灌洗液(bronchoalveolar lavage fluids,BALF)中检测到。在脂多糖诱导的ALI 小鼠模型中,BALF 中出现中性粒细胞来源的细胞外组蛋白,直接激活NLRP3炎症小体[40]。
众多炎性递质通过不同信号通路作用于巨噬细胞、中性粒细胞等效应细胞,介导ALI 的炎症反应,其中NLRP3/caspase-1/IL-1β 信号通路在ALI 炎症反应中起重要作用。NLRP3 炎性小体是一种多蛋白复合体,包括NLRP3、接头蛋白凋亡相关斑点样蛋白和前体caspase-1。当肺组织受到相应刺激后,炎症小体将caspase-1 前体裂解成具有活性的caspase-1,进而促进IL-1β 和IL-18 前体生成有活性的成熟IL-1β 和IL-18,诱发其他炎性细胞因子合成和释放,放大局部和全身炎症反应,导致肺泡上皮通透性增加,肺泡屏障功能障碍,加重疾病进展[41]。本研究显示,ALI 大鼠肺组织NLRP3、caspase-1 和IL-1β mRNA 和蛋白表达增高,超短波干预可显著降低NLRP3、caspase-1 和IL-1β表达。
综上所述,超短波疗法能减轻脂多糖诱导的大鼠ALI 炎症反应,可能与抑制NLRP3/caspase-1/IL-1β 信号通路有关。NLRP3/caspase-1/IL-1β 信号也是调控肺巨噬细胞焦亡的重要信号通路,细胞焦亡过程会释放促炎因子IL-1β 和IL-18,肺巨噬细胞焦亡也是肺组织过度炎症反应的重要原因[39]。本研究显示,超短波治疗后,随着肺组织NLRP3/caspase-1/IL-1β 信号被抑制,血清炎症因子IL-1β 和IL-18水平也降低。超短波是否通过抑制肺巨噬细胞焦亡,发挥抗炎、抑制肺损伤作用,有待进一步研究。鉴于超短波能抑制ALI 的炎症反应,有可能对COVID-19 重症患者有益,值得进一步探索。
利益冲突声明:所有作者声明不存在利益冲突。

