急性脑梗死病人血清对氧磷酶1活性与颈动脉粥样硬化斑块的关系
姚 峰
动脉粥样硬化已被确认是缺血性脑血管病的主要病因之一,是脑梗死病人的重要发病因素。颈动脉粥样硬化斑块从某种意义上可反映全身动脉粥样硬化程度。研究表明,多种因素参与动脉粥样硬化斑块的形成,如年龄、性别、低密度脂蛋白胆固醇(LDL-C)、血压、血糖、吸烟史等[1-3]。近年来研究证实,在动脉粥样硬化的发生和发展过程中,血清对氧磷酶1(PON1)活性的降低是诱发动脉粥样硬化的一个重要因素[4]。本研究对急性脑梗死病人PON1 活性、血脂等指标与颈动脉粥样硬化斑块的大小及性质等方面进行相关性分析,探讨脑梗死病人血清PON1 活性对动脉粥样硬化斑块的影响。
1 资料与方法
1.1 研究对象 选择2017年1 月—2018年 4 月武汉市第六医院神经内科脑梗死住院病人295 例,男169 例,女126 例; 年龄44~88(61.44±8.74)岁。诊断均符合全国第四届脑血管病学术会议修订的诊断标准,发病<48 h,并经头颅CT 或核磁共振(MRI)检查证实。所有病人根据颈动脉超声检查结果分为无斑块组(81例)、稳定斑块组(92例)与不稳定斑块组(122例)。排除标准:非动脉粥样硬化斑块引起的急性脑梗死、梗死后出血和脑出血;有自身免疫性疾病或恶性肿瘤;有严重的肝肾疾病;颅脑外伤、动静脉畸形或动脉瘤;周围血管疾病或周围血管栓塞性疾病;意识异常者;近3 个月有感染史者;因各种原因不能完成试验者。
1.2 方法
1.2.1 颈动脉超声检查 采用Philips IE33彩色多普勒超声诊断仪,探头L11-3,探头频率7~12 MHz。检测颈动脉内膜中层厚度(IMT)。按照《2015中国健康体检人群颈动脉超声检查规范》定义:当IMT≥1.5 mm,凸出于血管腔内,或局限性内膜增厚高于周边IMT 的50%为斑块形成。多个斑块的IMT值取最大厚度斑块进行统计。根据斑块的病理学、超声回声及形态学特征,斑块分型为:稳定斑块即超声呈强回声或均匀的低回声,包括硬斑和扁平斑;不稳定斑块即超声呈混合回声、均匀回声或形状不规则,包括软斑和溃疡斑。
1.2.2 临床特征资料 ①一般情况: 包括年龄、性别和体质指数(BMI)等,昼夜平均收缩压(24 hSBP)与昼夜平均舒张压(24 hDBP)。②病史:高血压定义为有该病既往病史,或住院时符合《中国高血压基层管理指南》(2014年修订版)的诊断标准。糖尿病定义为有该病既往病史,或住院时符合《中国2型糖尿病防治指南》(2013年版)糖尿病的诊断标准。③个人习惯:吸烟定义为每天吸烟量≥1支,并且持续时间超过1年。饮酒定义为平均每周饮酒次数≥3次,按纯酒精折算每次饮酒量≥50 mL,并且持续时间超过1年。④生化指标包括总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、LDL-C、糖化血红蛋白(HbA1c)。
1.2.3 PON1检测 取病人空腹静脉血3 mL,置于抗凝管中,4 ℃环境下3 000 r/min离心15 min后,收集血清于-20 ℃冻存。取反应缓冲液1.3 mL(0.1 mmol/L Tris-HCL缓冲液,2.0 mmol/L CaCl2,pH=8),加入5 mmol/L乙酸苯酯150 μL,于25 ℃预温20 min后,加入血清样本反应2 min后用0.5 mol/L的EDTA终止反应,然后用岛津UV-2501分光光度仪于270 nm处进行测定血清中PON1活性。

2 结 果
2.1 不同动脉粥样硬化斑块组间基本特征比较 无斑块组、稳定斑块组和不稳定斑块组在年龄、PON1及TG等方面比较差异有统计学意义(P<0.05),两两比较发现,不稳定斑块组的年龄大于无斑块组与稳定斑块组(P<0.05);3组的PON1水平比较差异有统计学意义(P<0.05);稳定斑块组与不稳定斑块组的TG均大于无斑块组(P<0.05)。而3组在性别、BMI、TC、HDL-C、LDL-C、空腹血糖、24 hSBP、24 hDBP、HbA1c、吸烟、饮酒、高血压、糖尿病等方面比较,差异无统计学意义(P>0.05)。详见表1。

表1 不同动脉粥样硬化斑块状态组间基本特征比较

(续表)
2.2 PON1水平与颈动脉IMT的相关性 295例病人PON1活性的均值为(116.58±33.99)U/mL,颈动脉IMT为(1.34±0.33)mm,相关分析显示:PON1活性与颈动脉IMT呈负相关(r=-0.411,P<0.001)。
2.3 动脉粥样硬化斑块的危险因素分析
2.3.1 单因素分析 以是否有动脉粥样硬化斑块为因变量,病例的基本特征为自变量(各变量赋值见表2),采用非条件Logistic回归分析法探讨斑块形成的危险因素,结果发现年龄[OR=1.034,95%CI(1.003,1.067)]、TG[OR=2.770,95%CI(1.574,4.876)]、HDL-C[OR=0.410,95%CI(0.186,0.902)]为动脉粥样硬化斑块形成的危险因素。PON1[OR=0.960,95%CI(0.949,0.972)]为斑块形成的保护性因素。详见表3。

表2 动脉粥样硬化斑块危险因素的Logistic回归变量与赋值
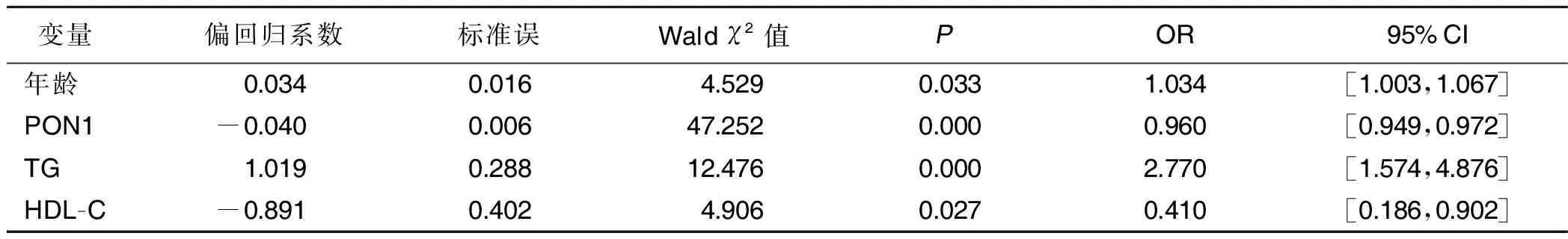
表3 动脉粥样硬化斑块危险因素的Logistic单因素回归分析
2.3.2 多因素分析 将单因素分析有意义的因素纳入Logistic多因素回归模型,采用逐步后退法(似然比)筛选危险因素,纳入和剔除标准分别为0.05和0.10。多因素分析发现,PON1[OR=0.960,95%CI(0.948,0.972)]为动脉粥样硬化斑块的独立保护因素。TG[OR=2.652,95%CI(1.346,5.227)]为动脉粥样硬化斑块的独立危险因素。详见表4。

表4 动脉粥样硬化斑块危险因素的Logistic多因素回归分析
3 讨 论
颈动脉粥样硬化是全身动脉粥样硬化的局部表现,是脑梗死重要的危险因素之一。颈动脉粥样硬化斑块引起的血管狭窄可导致血流动力学异常。同时不稳定斑块形成的微栓子因血液冲击脱落,栓塞了远端管径较细的血管,当体位突然变化、血压下降或心源性因素导致心搏量突然下降时,引起狭窄血管远端的血流灌注不足,若局部侧支循环不良,即可形成脑梗死[5]。
近年来发现,PON1在动脉粥样硬化发生和发展过程中充当重要角色。PON1为对氧磷酶基因家族中成员之一,是近年来发现的一种与高浓度胎蛋白(HDL)相关的钙依赖性蛋白酶,广泛分布于肝脏、血液、脾脏及脑组织等部位。PON1的活性成分与HDL 结合可降低血浆及组织中的氧化应激水平,同时PON1能清除人冠状动脉和颈动脉粥样硬化损伤灶中的脂质过氧化物,降低氧化型脂质的致动脉粥样硬化作用[6]。研究发现,在冠心病、高血脂和糖尿病病人血清中PON1活性有所下降[7-9]。对于PON1活性与颈动脉粥样硬化斑块状态之间的关系,本研究发现,与无斑块组相比,稳定斑块组和不稳定斑块组血清PON1活性均降低,不稳定斑块组降低程度最明显。同时发现PON1活性与颈动脉IMT呈负相关。既往研究也发现软斑块组与硬斑块组相比PON1的活性较低,而临床上倾向于认为软斑块是较为不稳定的斑块,硬斑块是较为稳定的斑块。从而证实PON1活性降低与粥样硬化斑块的不稳定性有关[10],这也与本研究结果一致。PON1减轻动脉粥样硬化斑块的机制可能与氧化型低密度脂蛋白(ox-LDL)有关。研究发现ox-LDL不但可以直接损伤内皮细胞,而且还能促进单核细胞与内皮细胞的黏附以及向内膜下迁移,进入内膜下的单核细胞受到ox-LDL 的进一步作用,分化成巨噬细胞,巨噬细胞通过清道夫受体及非特异性吞噬等多种途径摄取ox-LDL,形成所谓的“脂质核心”,逐渐形成动脉壁的粥样斑块[11]。PON1通过水解ox-LDL中的氧化脂质以及水解动脉壁细胞脂质过氧化物以达到抑制粥样斑块形成的作用[12]。
本研究通过对颈动脉粥样硬化斑块形成的危险因素单因素分析发现,年龄、TG是斑块形成的危险因素,HDL-C及PON1水平是斑块形成的保护性因素。多因素分析发现,TG和PON1水平分别是斑块形成的独立危险因素及保护因素,年龄与HDL-C水平未进入最后方程,可能与斑块形成的混杂因素有关。有研究也证实TG 在与动脉粥样硬化的发生发展过程中也起到一定作用。在敲除小鼠脂蛋白脂肪酶后,小鼠血浆TG 明显增高,主动脉根部即出现富含泡沫细胞的动脉粥样硬化斑块[7]。TG主要存在于乳糜微粒(CM)和极低密度脂蛋白(VLDL)中,形成高水平CM 残粒及VLDL 残粒透入血管内膜,滞留于血管内皮下层组织基质,被巨噬细胞摄取后形成泡沫细胞,为早期动脉粥样硬化斑块形成的基础[4]。
综上所述,在急性脑梗死病人颈动脉粥样硬化斑块的发生、发展中,PON1起了非常重要的作用。PON1与颈动脉内膜中层厚度具有相关性,同时与颈动脉粥样硬化斑块的稳定性有关,PON1可能在急性脑梗死发病的病理过程中发挥重要保护作用。

