骨保护蛋白/核因子-κβ受体活化因子/核因子-κβ受体活化因子配体轴与心脏瓣膜病合并持续性心房颤动患者改良迷宫术后心房颤动复发的关系及其作用机制研究
王健,戴婷,蒋国军,曹海龙
心房颤动(简称房颤)可严重影响心脏瓣膜病患者的治疗效果,其病死率是未合并房颤患者的2倍,瓣膜性房颤患者脑卒中发病率约是窦性心律(简称窦律)人群的18倍[1]。目前,临床常采用改良迷宫术治疗需行开胸手术的心脏瓣膜病合并房颤患者,但部分患者术后短期内出现复发,可能与心房结构重构有关。此外,有研究表明,房颤发生风险可随心房间质纤维化程度加重而增加,且患者窦律维持也与之相关[2]。心房间质纤维化是心房结构重构的重要特征性表现。
基质金属蛋白酶(matix metalloproteinase,MMP)是一组钙锌依赖的蛋白水解酶,主要作用为组织重塑及调节细胞外基质的代谢。研究证实,基质金属蛋白酶9(MMP-9)在房颤患者心房组织中呈高表达,而房颤患者心房间质纤维化可能与MMP-9异常表达有关[3]。但由于心肌组织标本获取难度大,因此寻找一种可反映心房结构重构的血清标志物十分重要。既往研究表明,骨保护蛋白(OPG)/核因子-κβ受体活化因子(RANK)/核因子-κβ受体活化因子配体(RANKL)轴可通过调控NF-κB系统负向调节纤维化相关基因如MMP、基质金属蛋白水解酶组织抑制因子(tissu inhibitor of metalloproteinase,TIMP)表达作用于胶原的合成及降解,最终影响纤维化程度[4]。本研究旨在探讨OPG/RANK/RANKL轴与心脏瓣膜病合并持续性房颤患者改良迷宫术后房颤复发的关系,并探讨其作用机制。
1 资料与方法
1.1 一般资料 选取2016年7月—2019年6月因心脏瓣膜病合并持续性房颤于宜兴市人民医院和南京鼓楼医院行改良迷宫术后转复为窦律患者64例,患者术前均明确诊断为持续性房颤(房颤维持时间>7 d且药物治疗不能转复)。排除标准:(1)术前合并其他类型心律失常者;(2)需同时行冠状动脉旁路移植术或先天性心脏病矫治术等其他手术者;(3)二次心脏手术者;(4)术前已植入永久性心脏起搏器或埋藏式复律除颤器者;(5)术后发生严重并发症或死亡者;(6)合并恶性肿瘤或近期发生骨折者;(7)合并感染性心内膜炎、结缔组织病或自身免疫性疾病者。根据术后3个月房颤复发情况将所有患者分为房颤复发组(AF组)27例和窦律维持组(SR组)37例。两组患者性别、年龄、心脏瓣膜病病程、心脏瓣膜病类型、心功能分级、左心室舒张末期内径、左心室收缩末期内径、左心室射血分数、右心房内径、肺动脉收缩压比较,差异无统计学意义(P>0.05);但AF组患者房颤病程长于SR组,左心房内径大于SR组,差异有统计学意义(P<0.05,见表1)。本研究经宜兴市人民医院、南京鼓楼医院医学伦理委员会批准同意,且患者对本研究知情并均签订知情同意书。
本研究价值:
本研究能紧密联系临床实际,通过分析骨保护蛋白(OPG)、基质金属蛋白酶(MMP)等指标研究心脏瓣膜病合并持续性心房颤动(简称房颤)患者改良迷宫术后房颤复发的可能机制,最终论证了心房结构重构对该类患者改良迷宫术后房颤复发的影响,为指导筛选适合行改良迷宫术的患者或预防术后房颤复发的新干预靶点提供了一定依据,具有潜在的经济效益和社会效益。
1.2 方法 患者均于术前抽取桡动脉血2 ml,3 000 r/min离心5 min(离心半径10 cm)后取上清液,置于-70 ℃冰箱中保存待测。采用酶联免疫吸附试验(ELISA)检测两组患者术前血清OPG、可溶性RANKL(sRANKL)水平,并计算sRANKL/OPG,ELISA试剂盒购自promega公司,具体操作严格按照试剂盒说明进行。在患者术中建立体外循环前收集左心耳组织约100 mg,采用无菌0.9%氯化钠溶液冲洗后立即装入冻存管,并置入液氮储存备用。采用Western blotting法检测两组患者左心耳组织中MMP-9、基质金属蛋白水解酶组织抑制因子1(TIMP-1)水平,并计算MMP-9/TIMP-1。术后,密切监测患者心律,出院后继续电话或门诊随访。房颤复发标准:心电监护或遥测记录房颤持续时间>15 min。
1.3 统计学方法 采用SPSS 22.0统计学软件进行数据分析。计数资料以相对数表示,组间比较采用χ2检验;计量资料以(±s)表示,组间比较采用两独立样本t检验;心脏瓣膜病合并持续性房颤患者sRANKL/OPG与左心耳组织MMP-9、TIMP-1水平及MMP-9/TIMP-1的相关性分析采用Pearson相关分析。以P<0.05为差异有统计学意义。

表1 两组患者一般资料比较Table 1 Comparison of general information between the two groups
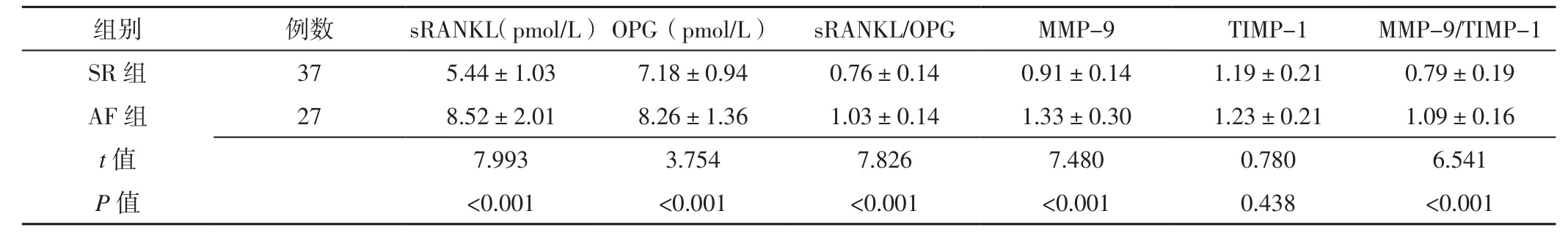
表2 两组患者术前血清sRANKL水平、OPG水平、sRANKL/OPG及左心耳组织中MMP-9水平、TIMP-1水平、MMP-9/TIMP-1比较(x± s)Table 2 Comparison of serum levels of sRANKL,OPG,sRANKL/OPG ratio and levels of MMP-9,TIMP-1 and MMP-9/TIMP-1 ratio in the left atrial appendage between the two groups before operation
2 结果
2.1 术前血清sRANKL水平、OPG水平、sRANKL/OPG及左心耳组织中MMP-9水平、TIMP-1水平、MMP-9/TIMP-1 AF组患者术前血清sRANKL、OPG水平及左心耳组织中MMP-9水平高于SR组,血清sRANKL/OPG、左心耳组织中MMP-9/TIMP-1大于SR组,差异有统计学意义(P<0.05);两组患者左心耳组织中TIMP-1水平比较,差异无统计学意义(P>0.05,见表2)。
2.2 相关性分析 Pearson相关分析结果显示,AF组患者血清sRANKL/OPG与左心耳组织中MMP-9/TIMP-1呈正相关(r=0.757,P<0.001),与左心耳组织中MMP-9(r=0.341)、TIMP-1(r=0.190)水平无相关性(P>0.05);SR组患者血清sRANKL/OPG与左心耳组织中MMP-9(r=0.193)、TIMP-1(r=0.107)水平和MMP-9/TIMP-1(r=0.180)均无相关性(P>0.05,见图1)。
3 讨论
房颤的发生和窦律的维持与以心房间质纤维化为主要特点的心房结构重构密切相关。改良迷宫术可通过纠正心房结构重构使房颤患者术后转复为窦律,因此该手术是房颤的首选治疗[5],但心脏瓣膜病合并持续性房颤患者改良迷宫术后近、远期窦律维持率并不理想[6],因此阐明心房间质纤维化在房颤中的具体机制对于寻找预测改良迷宫术后房颤复发风险的指标及提高患者生活质量具有重要意义。
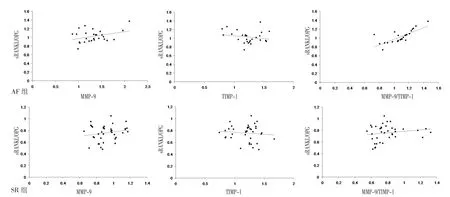
图1 AF组和SR组患者血清sRANKL/OPG与左心耳组织中MMP-9、TIMP-1水平及MMP-9/TIMP-1关系的散点图Figure 1 Scatter plot of correlation of serum sRANKL/OPG ratio with levels of MMP-9,TIMP-1 and ratio of MMP-9/TIMP-1 in the left atrial appendage of AF group and SR group
心房间质纤维化是一个动态的过程,主要表现为胶原被降解,取而代之的是纤维性细胞外基质异常沉积,而MMP与其内源性特异性抑制剂TIMP是调节细胞外基质代谢的重要酶。因此,某些细胞因子介导的MMP/TIMP表达失衡导致心肌细胞外基质纤维化和结构重构,这可能是房颤复发和窦律维持的重要机制之一[3]。MMP-9是MMP中分子量最大的酶,其大量表达于心内膜、间质组织及心肌细胞。NAKANO等[7]研究表明,房颤患者心肌组织中MMP-9水平高于窦律患者,可能与房颤患者心房扩大、心房结构重构有关。XU等[8]研究表明,房颤患者心房组织中MMP-9及Ⅰ型胶原纤维的mRNA表达均较高,且与左心房内径呈正相关,推测该指标可能是房颤患者发生心房结构重构的分子基础。本研究结果显示,AF组患者左心耳组织中MMP-9水平及MMP-9/TIMP-1较SR组患者高,但两组患者左心耳组织中TIMP-1水平比较差异无统计学意义,分析原因为:心肌组织中MMP-9水平较高的心脏瓣膜病合并持续性房颤患者术前心房结构重构较严重,而发生纤维化的心房间质已无法逆转,因此改良迷宫术后房颤暂时转复的窦律难以维持;而心肌组织中MMP-9/TIMP-1可能通过作用于心肌细胞外基质的合成与降解而参与心脏瓣膜病合并持续性房颤患者改良迷宫术后房颤复发的发生、发展,进一步推测检测或调节MMP及MMP/TIMP表达可预防或减缓心房间质纤维化和结构重构,进而降低患者改良迷宫术后房颤复发风险。但心肌组织标本术前较难取得,临床中寻找与MMP相关的能反映心房间质纤维化和结构重构的血清标志物尤为重要。
OPG、RANK、RANKL属于肿瘤坏死因子超家族成员,OPG作为诱饵受体与RANKL结合可阻断RANKLRANK结合引起的级联反应,因此RANKL/OPG可反映该通路的活性。研究表明,OPG/RANK/RANKL轴可通过调节心房间质胶原含量和比例来缓解间质纤维化程度,而心房间质纤维化是心房结构重构最突出的特点[5,9]。本课题组既往研究发现,心脏瓣膜病合并持续性房颤患者在同期行改良迷宫术中,AF组术前血清中sRANKL、OPG水平及sRANKL/OPG均高于SR组[10],推测OPG/RANK/RANKL轴活性高低可能与患者术前心房间质纤维化和结构重构程度有关。而UELAND等[11]关于心力衰竭的研究表明,RANKL高表达可降低MMP-9活性及TIMP-1表达,而后两者之间的动态失衡会促进心房基质退化及纤维化组织在心房内沉积,加速心房结构重构进程,促进房颤复发[12-13]。推测OPG/RANK/RANKL轴可能是心脏瓣膜病合并持续性房颤患者改良迷宫术后房颤复发和窦律维持的机制之一。
本研究结果还显示,AF组患者血清sRANKL/OPG与左心耳组织中MMP-9/TIMP-1呈正相关,与左心耳组织中MMP-9、TIMP-1水平无相关性;SR组患者血清sRANKL/OPG与左心耳组织中MMP-9、TIMP-1水平和MMP-9/TIMP-1均无相关性,推测OPG/RANK/RANKL轴活性增加可通过调控MMP-9/TIMP-1而使心肌间质纤维化,促进心脏瓣膜病合并持续性房颤患者术后房颤复发,但对于改良迷宫术后房颤复发者,术前心肌纤维化和结构重构可能较严重,两者间的相关性也表现的更明显。可见控制MMP及TIMP表达并调节MMP/TIMP平衡可能有助于预防和阻止患者病理条件下的心房扩大和心肌纤维化,进而延缓房颤的发生并维持窦律。
综上所述,OPG/RANK/RANKL轴活性增加可能通过调控MMP/TIMP系统影响心房间质纤维化,促进心房结构重构,从而增加心脏瓣膜病合并持续性房颤患者改良迷宫术后房颤复发风险,不利于窦律维持。已有研究证实,左心房内径与房颤病程密切相关,且可反映心房结构重构程度[14],而本研究关于左心房内径与OPG、MMP-9的关系及其是否对心脏瓣膜病合并持续性房颤患者改良迷宫术后房颤复发造成影响并未进一步探讨,且本研究纳入样本量较少、随访时间较短,因此今后还需进一步研究以验证本研究结论。
作者贡献:王健进行文章的构思与设计,数据的收集、整理、分析,结果的分析与解释,撰写论文;戴婷、曹海龙进行研究的实施与可行性分析;戴婷进行论文的修订;曹海龙负责文章的质量控制及审校;蒋国军对文章整体负责、监督管理。
本文无利益冲突。

