保活运输河蟹品质感知生物信号检测与建模
王 想 高乾钟 肖新清 傅泽田 张小栓
(1.中国农业大学工学院, 北京 100083; 2.中国农业大学食品质量与安全北京实验室, 北京 100083;3.广安市前锋区农业农村局, 广安 638019)
0 引言
河蟹是一种重要的水产品,含有丰富的甲壳质,具有降低胆固醇、调节肠内代谢等优点,也是重要的工业原料来源[1-5]。在保活运输过程中,振动、细菌、微生物等应激源使河蟹产生强烈的应激反应,导致品质快速下降[6-7]。因此,需要对河蟹品质进行监测,以便及时进行调控。
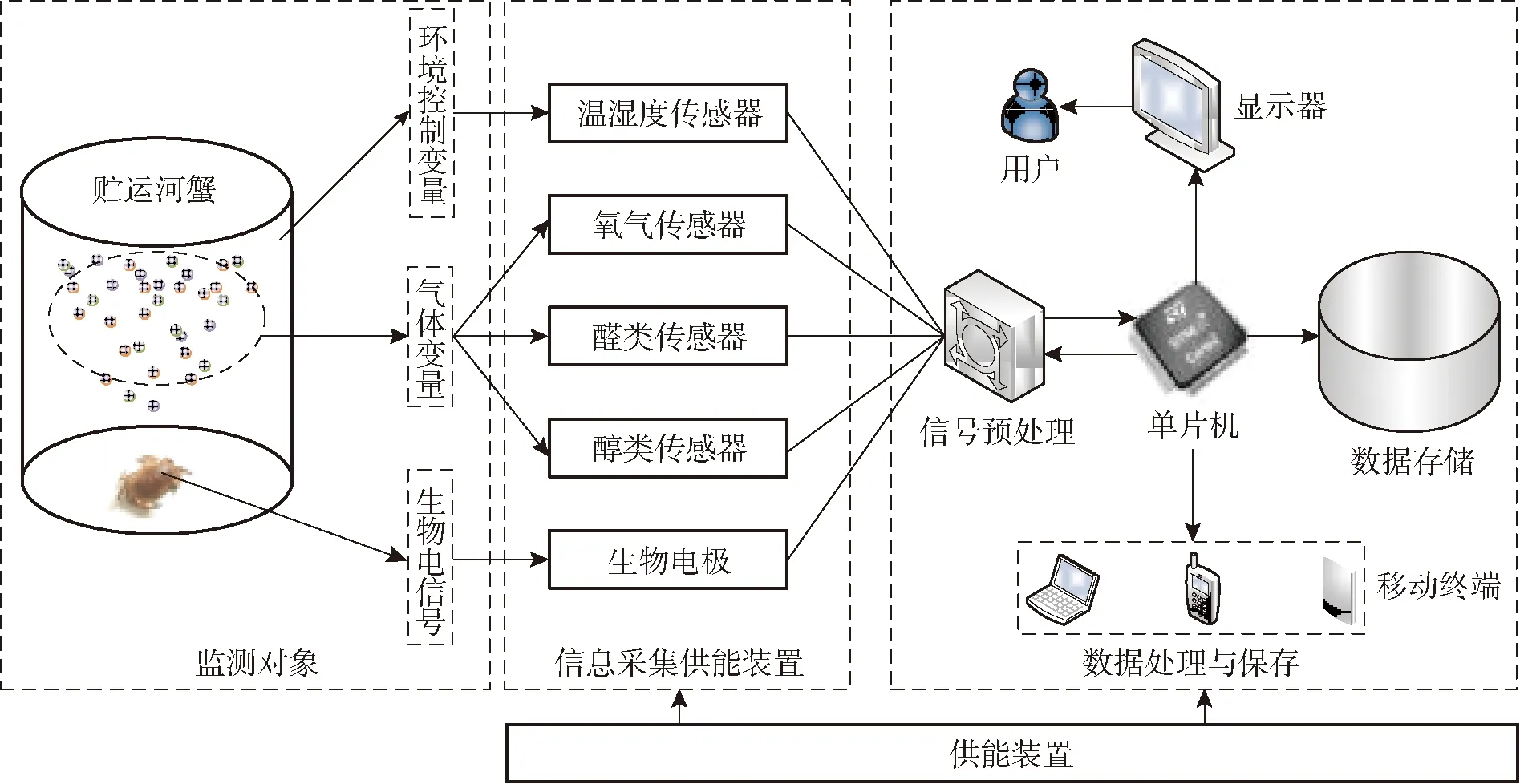
图1 河蟹检测装置总体设计图Fig.1 Conceptual diagram of overall design of crab detection device
水产品品质是一个抽象的指标,而生物信号(如感官评价、物理化学信号、电信号等)可直观反映生物体的生命活动状态,常被用作品质变化的指示指标[8-10]。如文献[11]将感官评价、pH值、挥发性盐基氮(TVB-N)含量作为缢蛏、文蛤品质变化的指示指标,文献[12-13]分别对海湾扇贝和南极磷虾进行了类似的研究。传统上利用的化学指标(如挥发性盐基氮含量、微生物菌落总数等)和某些物理指标(如感官评价、硬度等)来表征品质变化的方法已被广泛接受,并运用在实际生活中。而利用微环境和生物电信号反映品质变化的理念也逐渐被认可,并进行了一些尝试。如文献[14-16]利用电子鼻系统分析了南美白对虾、三疣、中华绒螯蟹的新鲜度;文献[17]使用电容方法与传统平板计数法进行对比,检测虾中微生物数量;文献[18]利用生物阻抗技术对猪肉的新鲜度进行检测。在有关河蟹品质的研究中,以电子鼻[5,16]、气相色谱-质谱联用法(GC-MS)[1-2,19]等无损检测的方式居多,而从保活运输中微环境和生物阻抗角度进行河蟹品质变化的研究较少。
从无损检测的角度获取品质变化规律需要建立品质耦合模型来实现[20-22],包括基于温度变化的模型[23-26]、微生物预测模型[27-28]、化学反应动力学预测模型[29-30]、智能算法的品质预测模型[31-32]等。河蟹品质耦合模型是通过选取基于智能算法的预测模型,建立无损检测指标与传统化学指标之间的拟合模型,通过微环境和电信号的变化评估河蟹品质的变化,进而证明微环境和生物电信号指示品质变化的可行性和实用性。
本文基于STM32芯片设计河蟹生物信号的检测装置,实时获取河蟹微环境中的气体含量、阻抗信息和河蟹品质变化过程中的挥发性盐基氮(TVB-N)含量,分析和探讨气体、阻抗信号与挥发性盐基氮(TVB-N)之间的变化关系,利用遗传算法(GA)优化后的BP神经网络(GA-BP)建立气体、阻抗信息与挥发性盐基氮(TVB-N)之间的耦合模型,以期实现河蟹保活运输中品质感知的生物信号检测与建模。
1 总体设计
图1是河蟹检测装置总体设计图。河蟹的生物信号检测装置用来对运输中的河蟹进行连续生物信号监测。从环境控制变量、气体变量和生物电信号3方面对河蟹运输过程进行检测,利用STM32单片机作为核心,搭载不同传感器实现氧气、醛类、醇类气体含量测量,结合AD5933和生物电极构成生物阻抗采集模块连接在单片机上,最后单片机将数据存储在外设SD卡中。
其中AD5933是ADI公司生产的一款针对阻抗分析的核心芯片,原理是使用AD5933中的频率发生器产生一定频率的激励信号,利用生物电极的信号输出端进行输出,激励信号经过河蟹后,响应信号通过信号接收电极进行接收,由AD5933中的ADC进行采样,片上DSP对数据进行离散傅里叶变换,STM32进行读取。本文从微环境和电信号两个角度获取河蟹品质变化。
1.1 微环境传感器选择
微环境包括温湿度和氧气、醇类、醛类等气体含量。传感器选型如表1所示。
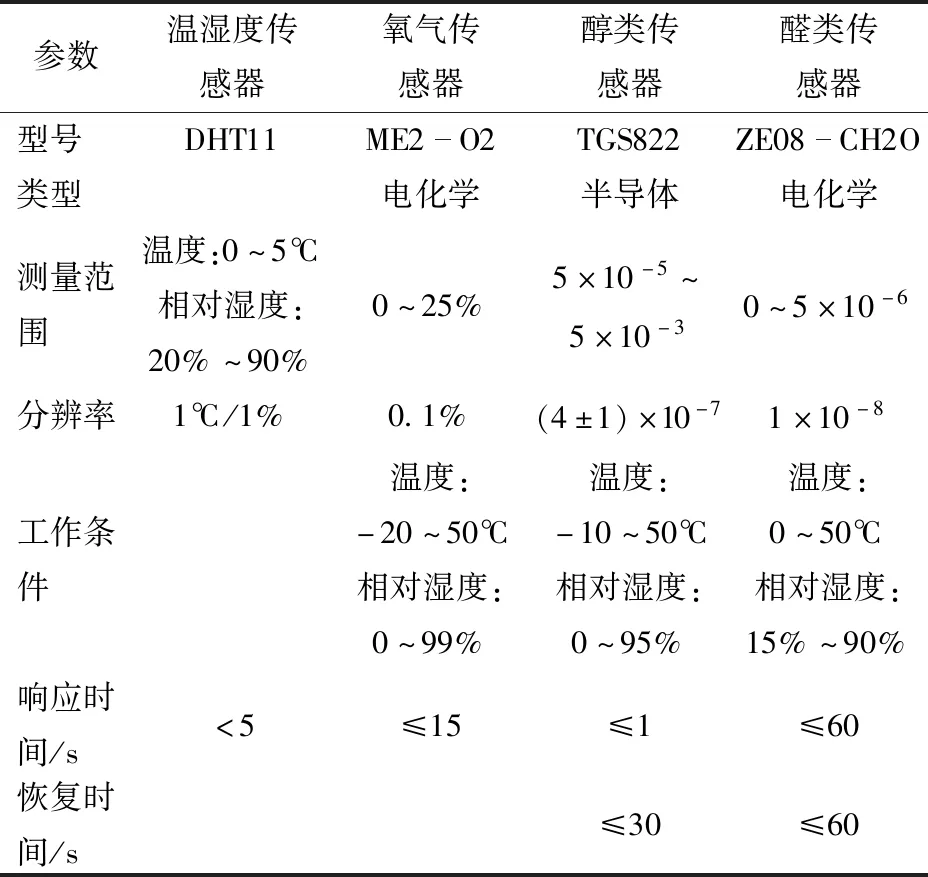
表1 传感器型号及部分参数Tab.1 Sensor model and partial parameters
1.2 生物电极设计
在生物电信号测量中,使用实验室设计的电极来测量河蟹阻抗。电极的设计参照文献[33-37],从3个主要的部分设计了河蟹阻抗检测电极,包括微针前端、胶黏层以及电极封装。电极实物见图2。

图2 生物电极实物图Fig.2 Bioelectrode physical picture
2 实验方案
2.1 生物检测装置
从苏州阳澄湖挑选质量(150±5) g,肥硕、肢体无残缺、新鲜及生命力旺盛的河蟹12只作为实验样本,捆绑加冰后迅速运往苏州大学进行实验,路程约1 h,保证河蟹的生命体征基本未变。在实验室中,松开河蟹进行暂养,打开生物信号检测装置进行预热。30 min后,挑选出蟹盖较宽、生命力强的河蟹9只作为实验样本。将河蟹均分为A、B、C 3组,每组用3只河蟹作平行实验,对每只河蟹样本进行如下操作:擦拭干净河蟹表面,不要留有杂质和过多的水分,将生物电极分别贴于河蟹的胸甲和背甲上,胸甲电极做输出,背甲电极做阻抗信息采集接收端;再次捆绑好之后,将河蟹及电极放入2 000 mL的容量瓶中,传感器安装在容器的上半部,并进行密封;将A、B、C 3组分别保存在4、15、25℃下,持续进行5 d的数据采集,每天进行电池的更换。重复多次该方案测量后以稳定的结果作为最终实验结果进行分析。实验装置见图3。

图3 河蟹检测装置实物图Fig.3 Detection device of crab1.核心板 2.传感器 3.河蟹 4.生物电极 5.电源
2.2 挥发性盐基氮含量检测
与2.1节中河蟹来源及处理方式一致,在实验室中,对河蟹进行如下处理:
(1)挑选生命力强、适应性好和无损伤的45只河蟹作为实验样本。
(2)按质量将河蟹均分为3组,分别标号为A1、A2、A3,放入自封袋中进行封存,减小其与外界的空气交换,模拟运输的封闭环境。
(3)将标号为A1、A2、A3的河蟹分别保存在4、15、25℃下,每天分别从A1、A2、A3中各取出3只河蟹作为当天的实验样本,共持续5 d。
(4)对每天的实验对象取出蟹膏、蟹肉等可食部分,进行挥发性盐基氮含量的测量,测量方法按照国标GB 5009.228—2016中的自动凯氏定氮仪法要求进行,对测量结果取均值后作为当天的挥发性盐基氮结果。
3 品质模型构建
3.1 模型选择
本文构建的河蟹品质模型是对一定运输环境中的河蟹,通过测量生物信号来反映其品质变化的方法。在模型构建中,作为输入量的生物信号包括气敏传感器信息和阻抗信息2部分,输出量则是与河蟹新鲜度密切相关的挥发性盐基氮含量,其可以作为可靠的品质指示指标。因此本文的河蟹品质模型实质上是研究河蟹在新鲜度发生变化时的气体变化规律、阻抗变化规律与挥发性盐基氮之间的变化关系。利用气体信息和阻抗信息来反映和预测挥发性盐基氮含量的变化是河蟹品质模型需要达到的目的。
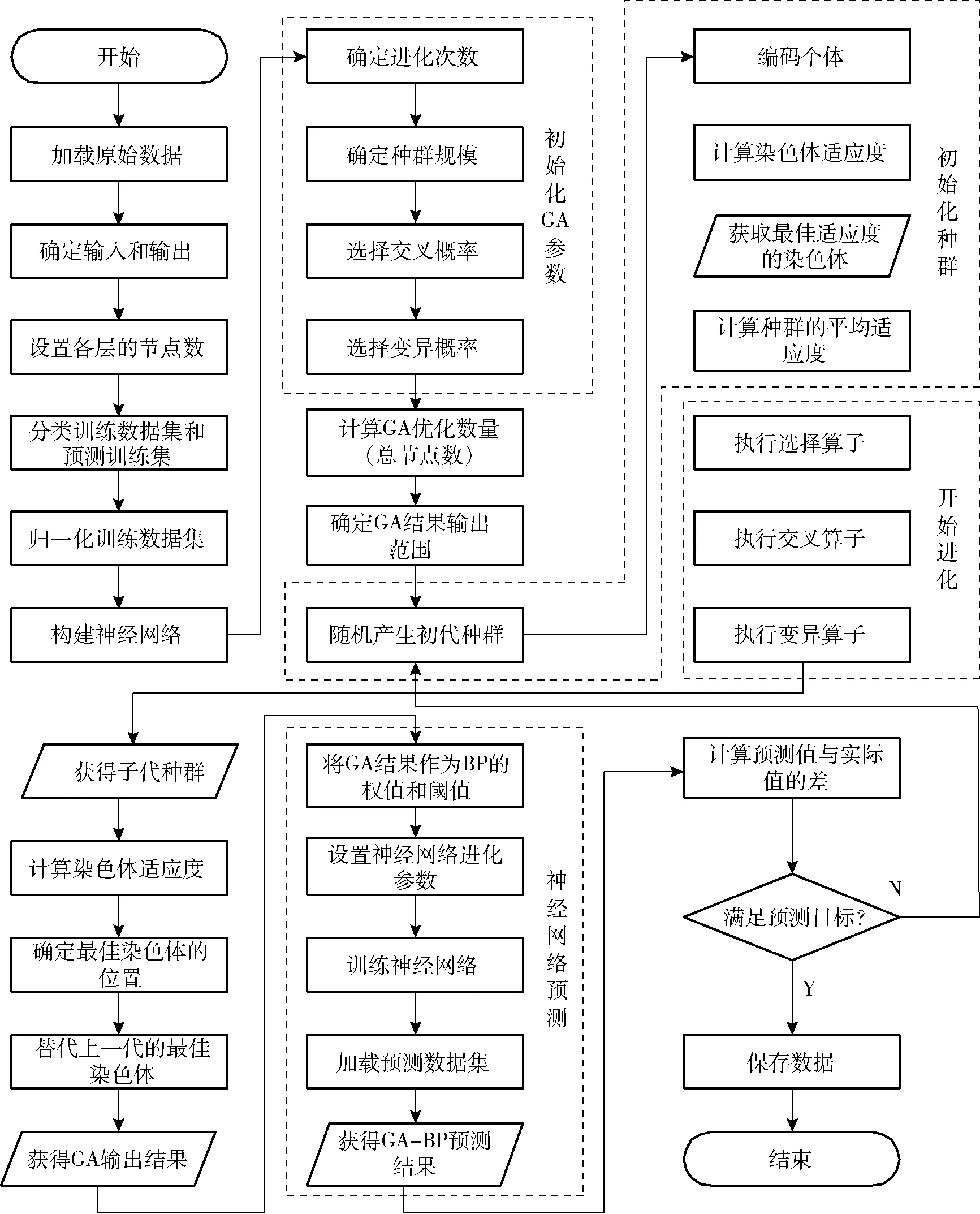
图4 河蟹品质模型构建流程图Fig.4 Flow chart of crab quality model construction
品质建模的方法很多,通常水产品品质模型根据不同因素对品质变化的影响进行分类,在运用过程中,因为温度测量的便利性和可控性,在进行品质建模时基于温度的模型运用较多,常用的模型包括化学动力学方程、Arrhenius模型;微生物对水产品品质变化有直接的影响,因此基于微生物建立的品质预测模型可靠性较高,但是微生物的测量对实验人员要求较高,设备更专业,成本高,在运用中受到一定的限制;而基于统计学的模型主要是数据的统计学分析,常与其他模型结合来实施,且威布尔危害分析的缺陷十分明显,需依靠可靠的感官评价结果,而感官评价主观性较强,因此其使用也受限[23-30]。
人工神经网络建模时不局限于温度、微生物等种类不同的生物信号,而是直接对多种数据进行并行处理和不断地学习,具有较强的适应性和精度。文献[38]综述了神经网络在生鲜农产品供应链管理中的特点、优势和未来发展的必然趋势;文献[39]利用小波变换和BP神经网络对水稻冠层4种重金属含量构建反演模型,具有良好的效果。因此,本文选用人工神经网络的建模方法,研究气体传感信息、阻抗信息与品质的关系。BP神经网络研究河蟹阻抗信息对品质的反映情况,建立阻抗和挥发性盐基氮含量之间的拟合关系,实现阻抗对品质变化的预测。利用Matlab实现GA-BP的算法仿真,在建立中需要对算法中的一些主要参数进行设置,通过不断调试获得预期结果。
3.2 模型构建流程
河蟹品质模型构建流程如图4所示。BP神经网络模型可以很好地表达非线性关系,构建预测模型。但是BP模型的关键在于神经元阈值的选取,本文利用遗传算法(GA)进行优化。
3.3 模型训练
根据模型构建流程设置模型训练参数:学习速率为0.1,最大训练次数为100,训练精度为0.000 1,其他保持默认设置,使用train函数训练网络,sim网络仿真,交叉概率0.6,变异概率0.3,采用Newff作为训练函数,MSE作为网络的性能函数。种群规模、进化次数和隐含层数在本文不进行确定性设计,参数不同对迭代时间和迭代结果影响不同,表2是训练过程中的部分结果。初代种群随机产生,导致每次获得的结果有所差异。在训练时种群规模在100~200间调节,进化次数在10~13间调节,隐含层数在10~32间调节来获得结果。本文为获取和检验模型的拟合和预测能力,针对不同温度采用不同的训练和检验方案:4℃下将河蟹的576组数据作为训练样本进行模型的训练,144组数据作为模型的检验样本;15、25℃下按照品质阶段性变化的时间节点S1、S2、S3进行训练和检验,每个阶段训练和检验数据样本均等。15、25℃下S1阶段分别是216组和144组数据作训练和检验,S2阶段分别是108组和72组数据作训练和检验,S3阶段分别是36组和144组数据作训练和检验。
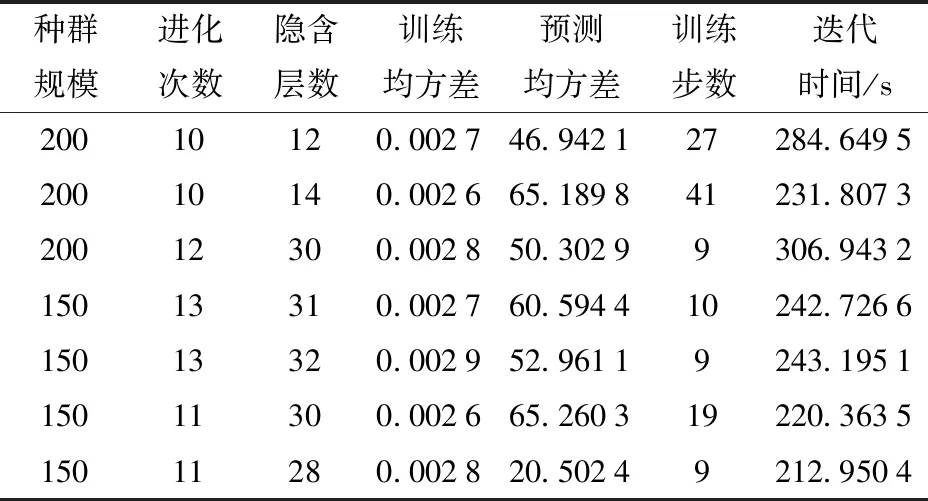
表2 部分训练结果Tab.2 Partial training results
4 结果与分析
4.1 不同温度下河蟹生物信号和挥发性盐基氮含量的变化
河蟹品质变化基本过程如图5所示。大致可分为新鲜→濒死(S1)、濒死→死亡(S2)、死亡→腐败(S3)3个阶段。新鲜的河蟹生命力强、对环境具有较强的适应能力、新陈代谢快,同时河蟹带有自身独有的香气,蟹壳带有明显光泽;随着实验时间的延长,河蟹未得到能量的补充,且体内自身能量物质被大量消耗,使河蟹生命力下降,抵抗力减弱,进入濒死阶段,在微生物等因素的影响下,河蟹体内蛋白质分解、脂质氧化等反应的发生使河蟹香气发生变化,随着该过程不断加剧,河蟹死亡;同时由于病菌等微生物的作用,河蟹中蛋白水解、组织自溶等现象加剧,自身特有香气完全消失,产生腐败类刺激性气体。

图5 河蟹品质变化基本过程图Fig.5 Basic process diagram of crab quality change
4.1.1不同温度下河蟹气体变化
图6是醇类气体含量的采集结果。结果中醇类气体含量持续上升,但是其变化速率并不相同。温度越高,上升速度越快,采集终值越高,可见温度对其的影响明显。对不同变化区间进行分类,粗略将其分为平滑段、突变段和快速上升段。在0~2 000 min内,各温度下醇类都未有明显的变化,在该阶段认为处于新鲜阶段,河蟹气味变化较小;在2 000~3 500 min内,不同温度下产生不同的变化,醇类气体含量发生速率突变,其中25℃直接出现了快速上升,并一直持续,这与感官分析的死亡阶段的变化相对应,而15℃和4℃变化较小,但是也开始出现了不同速率的变化,温度作用明显;在大于3 500 min后,不同温度下的醇类气体均开始上升,上升速度受温度影响,其中25℃最为明显,4℃较为平缓。该时间节点位于发生明显腐败阶段之前,实际上分析认为4℃下的河蟹未进入腐败,甚至死亡阶段,其气体的变化是新鲜到死亡阶段的正常变化,相当于25℃下的0~3 500 min内的变化,从气体的上升终点也可以看出结果。15℃下也有类似的分析。因此,25℃下的气体变化3个阶段更接近河蟹新鲜到腐败的3个阶段,15℃和4℃下分析的品质终点与25℃下存在差异。

图6 醇类气体采集结果Fig.6 Alcohols acquisition result
图7是CH2O的采集结果。类似醇类气体的分析过程,也可将其分为3个变化阶段,但时间节点分别变为2 000 min和4 000 min。在突变段CH2O的变化更为明显,明显看出了不同温度的差异。4℃的上升速度高于15℃的速度,25℃的CH2O在突变段的后部分快速上升,分析认为是气体扩散速度、传感器自身和河蟹个体差异带来的影响。

图7 CH2O采集结果Fig.7 CH2O acquisition result
图8是O2的采集结果。O2的变化与CH2O、醇类气体的变化结果相反,也将其对应分为3个阶段(快速下降段、区分段和平滑段)进行分析,对应的时间节点分别为2 500、5 000 min,低于2 500 min的时间里,河蟹处于新鲜阶段,代谢旺盛,对O2需求量大,温度越高,河蟹的活动越剧烈,O2消耗也越严重;在2 500~5 000 min内,河蟹对环境产生适应或缺少能量降低其生命活动,O2消耗减弱,结合图5的分析,河蟹将经过濒死阶段,发生死亡,进入腐败阶段;在5 000 min后,河蟹开始腐败,氧气的消耗主要用于微生物的腐败反应。4℃下的河蟹O2下降速度较为恒定,认为是河蟹未完全进入濒死和腐败阶段。

图8 O2采集结果Fig.8 O2 acquisition results
综上分析,河蟹品质变化的3个阶段可粗略对应气体变化的3个阶段,该结果在25℃表现最为明显。新鲜阶段的气体变化较稳定,主要是自身香气的影响;新鲜阶段到濒死阶段的变化是气体变化的主要分界区间,该过程河蟹自身香气逐渐消失,异味气体开始产生;死亡到腐败阶段,臭味气体产生速度加快。O2作为一种消耗气体,参与河蟹的有氧呼吸作用和腐败的生化反应,随河蟹生命力的变化而变化。温度作为一个重要环境变量对河蟹品质变化的速度有重要影响。
4.1.2不同温度下河蟹阻抗响应结果
图9是4、15、25℃下河蟹阻抗随时间变化结果。阻抗变化中,未出现气体变化时的3个明显的阶段,4℃的阻抗变化较小,15、25℃测量的阻抗变化各出现了一个变化节点,分别对应2 000 min和4 000 min,节点之前阻抗变化较小,节点之后的阻抗出现了快速下降。结合感官评价分析时间节点,25℃的2 000 min和15℃的4 000 min都发生在河蟹濒死阶段,下降阶段出现在死亡之后过程,结合4.1.1节的分析结果,4℃的河蟹未明显进入死亡阶段,因此阻抗未出现明显的下降。该结果说明该阻抗测量方法对河蟹死亡及以后的阻抗变化测量效果较好,对新鲜的河蟹阻抗测量效果较差。而生物阻抗产生是由于细胞内外的浓度差异导致,生物体可以看作是一个巨大的细胞模型,因此随着河蟹的品质下降会导致其组织发生腐败、溶解,导致细胞之间的浓度差减小,使得测量的阻抗减小,利于测量。而未发生组织变化时,对河蟹个体的测量受到蟹壳和环境因素的影响,效果较差。

图9 4、15、25℃下河蟹阻抗变化结果Fig.9 Resistance changes of crabs at 4℃, 15℃ and 25℃
综上,在阻抗结果的分析中,认为温度对河蟹品质变化有重要的影响;在正常生理情况下,河蟹的阻抗基本保持不变,从新鲜到死亡阻抗出现缓慢下降,直至出现明显腐败过程时会产生快速下降阶段。阻抗结果中没有明显体现出河蟹品质变化的3个阶段,对死亡及以后的河蟹有较强的指示作用,可以与气敏传感器获取的信息相互补充。
4.1.3不同温度下河蟹挥发性盐基氮含量变化

图10 4、15、25℃下挥发性盐基氮含量变化结果Fig.10 Results of volatile base nitrogen changes at 4℃, 15℃ and 25℃
图10是挥发性盐基氮含量变化结果。国标上认定蟹肉的挥发性盐基氮含量的标准为低于20 mg/(100 g)。从结果看,25℃远超上限,临界点A出现在约1.75 d的位置,该节点河蟹处于新鲜到濒死阶段(S1),即将进入濒死到死亡阶段(S2),在该温度,河蟹品质变化较快,对品质指示不十分明显。从河蟹在不同温度下挥发性盐基氮分析结果中,15、4℃中品质变化较稳定,对死亡前的河蟹品质变化具有更明显的指示作用;对15、4℃的结果进行分析,4℃下河蟹挥发性盐基氮含量在5 d内未超标,但在第5天已十分接近,该情况下,从感官分析上河蟹生命力减弱,无明显香气,该阶段河蟹已不再适合食用;而15℃下河蟹在第5天挥发性盐基氮含量超标,根据品质分阶段分析,河蟹进入濒死到死亡阶段,品质下降加速,挥发性盐基氮也加速产生。分析认为河蟹虽然未进入濒死到死亡阶段,但是在新鲜到濒死的后期,河蟹也不能食用。从拟合效果看,25、15、4℃下挥发性盐基氮线性相关结果分别是0.978 7、0.899 4、0.968 5,对河蟹品质有明显的指示作用。
4.2 耦合模型结果与分析
4.2.1基于GA-BP的阻抗信息与品质耦合结果
图11a是4℃下的模型检验结果,计算出最大相对误差是3.07%,平均相对误差是1.007%,最低预测精度是96.93%,从第106个采集点后误差值超过平均误差,并快速增加,在短期预测内效果明显,可以满足预测的需要。

图11 基于阻抗信息的4、15、25℃下河蟹品质模型预测结果Fig.11 Prediction results of crab quality model at 4℃, 15℃ and 25℃ based on impedance information
图11b是15℃下的模型检验结果,计算出模型对S1的预测相对误差最大值为13.68%,预测精度最低为86.32%;S2预测相对误差最大为12.96%,预测精度最低为87.04%;S3预测相对误差最大为7.72%,预测精度最低为92.28%。对S1、S2和S3阶段的预测精度逐渐提升,与阻抗变化基本一致。
图11c是25℃下的模型检验结果,计算出模型对S1的预测相对误差最大值为11.14%,预测精度最低为88.86%;S2预测相对误差最大为13.68%,预测精度最低为86.32%;S3预测相对误差最大为10.19%,预测精度最低为89.81%。从效果上看,对S1段预测波动较小,S3段波动较大,这与阻抗和河蟹品质的变化规律相关,当河蟹腐败后,个体差异等因素对结果影响较大,未知因素较多,预测结果波动较大。
综上,基于阻抗信息的模型对4、15、25℃下的挥发性盐基氮含量预测结果基本满足需要,说明阻抗对品质具有较好的指示作用。
4.2.2基于GA-BP的气体信息与品质耦合结果
将河蟹气敏传感信息作为输入变量,挥发性盐基氮含量作为输出变量,对模型参数设置和训练方法如3.3节中所述。图12a是4℃下的模型检验结果。计算出最大相对误差是13.68%,平均相对误差是1.811%,最低预测精度是86.32%,低于阻抗的预测效果,但是从相对误差变化值看,在前100个数据点预测效果理想,预测的数据点越多对网络的要求越高,且气体需要分析的变量数多于阻抗。
图12b是15℃下的模型检验结果,模型对S1的预测相对误差最大值为8.77%,预测精度最低为86.32%;S2预测相对误差最大为11.14%,预测精度最低为88.86%;S3预测相对误差最大为3.80%,预测精度最低为96.20%。对S1、S2和S3阶段的预测精度逐渐提升,与阻抗预测结果变化一致。
图12c是25℃下的模型检验结果。模型对S1的预测相对误差最大值为12.96%,预测精度最低为87.04%;S2预测相对误差最大为12.28%,预测精度最低为87.72%;S3预测相对误差最大为10.65%,预测精度最低为89.35%。对S1、S2和S3阶段的预测精度逐渐提升。
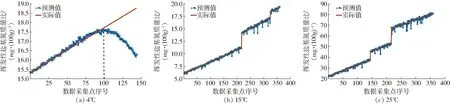
图12 基于气体传感信息的河蟹品质模型预测结果Fig.12 Prediction results of crab quality model based on gas sensing information
综上,对S1、S2和S3阶段的预测精度逐渐提升,说明气体的3个变化阶段与河蟹的3个品质变化阶段对应效果明显,对品质具有较好的指示作用。
4.2.3基于GA-BP的阻抗结合气体信息与品质耦合结果
将阻抗和气敏传感器采集的数据作为输入变量,挥发性盐基氮含量作为输出。对模型参数设置和训练方法如3.3节中所述。图13a是4℃下的模型检验结果。计算出最大相对误差是1.23%,平均相对误差是0.28%,最低预测精度是98.77%,高于只使用阻抗或单独使用气敏信息进行预测时的预测精度,说明阻抗和气体在对品质变化的反映上实现了相互补充,与上述分析结果一致。
图13b是15℃下的模型检验结果,模型对S1的预测相对误差最大值为12.96%,预测精度最低为87.04%;S2预测相对误差最大为10.19%,预测精度最低为89.81%;S3预测相对误差最大为6.21%,预测精度最低为93.79%。对S1、S2和S3阶段的预测精度逐渐提升,与4.2.1、4.2.2节的预测结果变化一致。
图13c是25℃下的模型检验结果,模型对S1的预测相对误差最大值为8.77%,预测精度最低为91.23%;S2预测相对误差最大为6.21%,预测精度最低为93.79%;S3预测相对误差最大为13.68%,预测精度最低为86.32%。对S1、S2的预测精度逐步升高,而S3的预测精度较低,原因可能与基于阻抗信息建立的预测模型相同,S3阶段过多的输入变量反而会增加对挥发性盐基氮含量变化规律的分析难度,使模型产生过度学习或学习不够的问题,从而导致预测精度下降。

图13 基于阻抗与气体传感信息的河蟹品质模型预测结果Fig.13 Prediction result of crab quality model based on impedance and gas sensing information
综上,阻抗和气体结合后对挥发性盐基氮含量的预测结果会有一定程度的提升,说明气体和阻抗信息可以实现互补。通过对3种情形下的模型预测结果进行分析,说明气体信息和阻抗信息能有效反映河蟹品质的变化,对品质具有明显的指示作用,所构建的模型能用于河蟹品质变化的预测。
5 结论
(1)针对河蟹保活运输过程存在的问题设计了一套河蟹生物信号检测装置,实现了对河蟹贮藏环境中的气体含量和河蟹阻抗信息进行数据实时获取。利用GA-BP方法将挥发性盐基氮含量作为主要品质指示指标,分别建立了气体含量、生物电信号与河蟹品质之间的耦合模型。
(2)获取了4、15、25℃下的河蟹阻抗和环境气体信息,结果分析表明:温度对采集结果有明显的影响;河蟹气体变化存在与品质变化相关的3个阶段,即平滑段、突变段和快速上升段;阻抗对河蟹死亡及之后的品质有较强的指示作用,与气体信息可以相互补充。
(3)利用遗传算法(GA)对BP神经网络进行了参数优化,分别建立了阻抗-挥发性盐基氮含量、气体-挥发性盐基氮含量、阻抗-气体-挥发性盐基氮含量的耦合模型,并检验了模型的预测精度。结果表明,4℃下预测精度分别为96.93%、86.32%、98.77%;15℃下S1的预测精度分别为86.32%、86.32%、87.04%,S2的预测精度为87.04%、88.86%、89.81%,S3的预测精度最低为92.28%、96.20%、93.79%;25℃下S1的预测精度最低为88.86%、87.04%、91.23%,S2的预测精度最低为86.32%、87.72%、93.79%,S3的预测精度最低为89.81%、89.35%、86.32%。说明该模型基本满足基于生物阻抗和气体信息对品质预测的需求,阻抗、气体信息对品质都有较强的指示作用,结合后其预测精度都有所提高。

