人造海水中不同的多孔介质内甲烷水合物生成特性研究
尹斯文 靳远 夏彬 马贵阳 潘振
辽宁石油化工大学石油天然气工程学院
自然界中的水合物大多生成在海底沉积物形成的毫米级多孔介质的孔隙中[1]。海底水合物富集区甲烷微生物含量很高,它们不仅会产生甲烷,还会产生类似于表面活性剂一样的催化酶,这些催化会促进水合物的生成[2-3]。张光学等[4]和梁金强等[5]发现海底沉积物以SiO2和CaCO3为主,而且沉积物的孔隙度改变了其毛细作用和渗透速率,使得水合物富集程度也会不同。
多孔介质的孔径和表面性质会改变水合物的生成速率和储气效果[6]。海洋沉积物的主要成分CaCO3和SiO2在沉积物中的分布和溶解会影响水合物的形成[7-8]。海水的盐含量也会对水合物的生成和储气效果造成影响[9]。有研究表明,低浓度盐类会促进水合物生成,高浓度会抑制水合物生成[10-12]。但目前关于海水对水合物生成的特性研究较少。因此,实验中主要研究的是人造海水与十二烷基硫酸钠(sodium dodecyl sulfate, SDS)混合体系下,多孔介质对水合物生成速率及其储气效果的影响。由于海底催化酶有促进水合物生成的作用,因此体系中加入了表面活性剂SDS,以充当催化酶促进水合物生成[2]。选择了CaCO3和SiO2具有不同表面特性的多孔介质,选择人造海水的目的是探究水合物在海底沉积物中大量存在的原因,以及海水盐浓度对水合物生成的影响,为考察海底天然气水合物的成因以及今后的开采和储运提供参考。
1 实验
1.1 实验仪器
本实验中采用的是KDSC-Ⅲ型天然气水合物多功能模拟实验装置,通过调节水合物生成的初始温压条件,从而模拟水合物生成和分解过程。该装置主要包括高压反应釜、进排气系统、恒温箱、气体增压系统和数据采集控制系统等,其设备及流程如图1所示。
1.2 实验材料及实验方案
十二烷基硫酸钠(SDS),纯度≥86%(w),由广东省精细化学品工程技术研究开发中心研制;天然气(CH4体积分数99.9%),由沈阳科瑞特种气有限公司制造;去离子水;人造海水组成如表1所列[13],实验室自制;多孔介质为CaCO3和SiO2;规格为200 mL的圆柱体塑料容器。实验方案如表2所列。

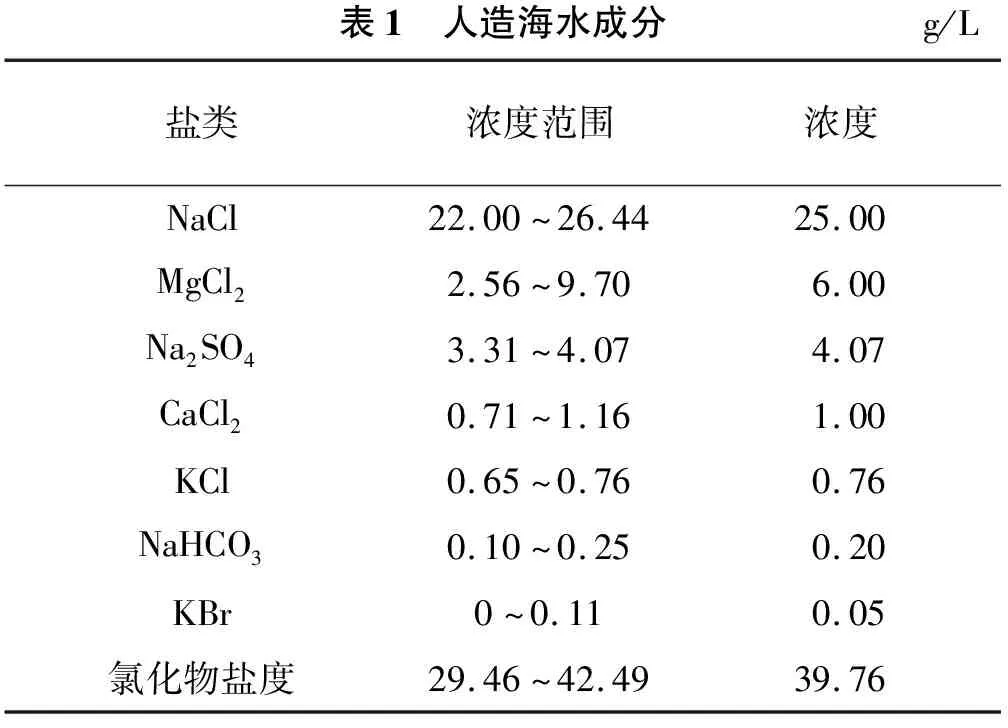
表1 人造海水成分g/L盐类浓度范围浓度NaCl22.00~26.4425.00MgCl22.56~9.706.00Na2SO43.31~4.074.07CaCl20.71~1.161.00KCl0.65~0.760.76NaHCO30.10~0.250.20KBr0~0.110.05氯化物盐度29.46~42.4939.76
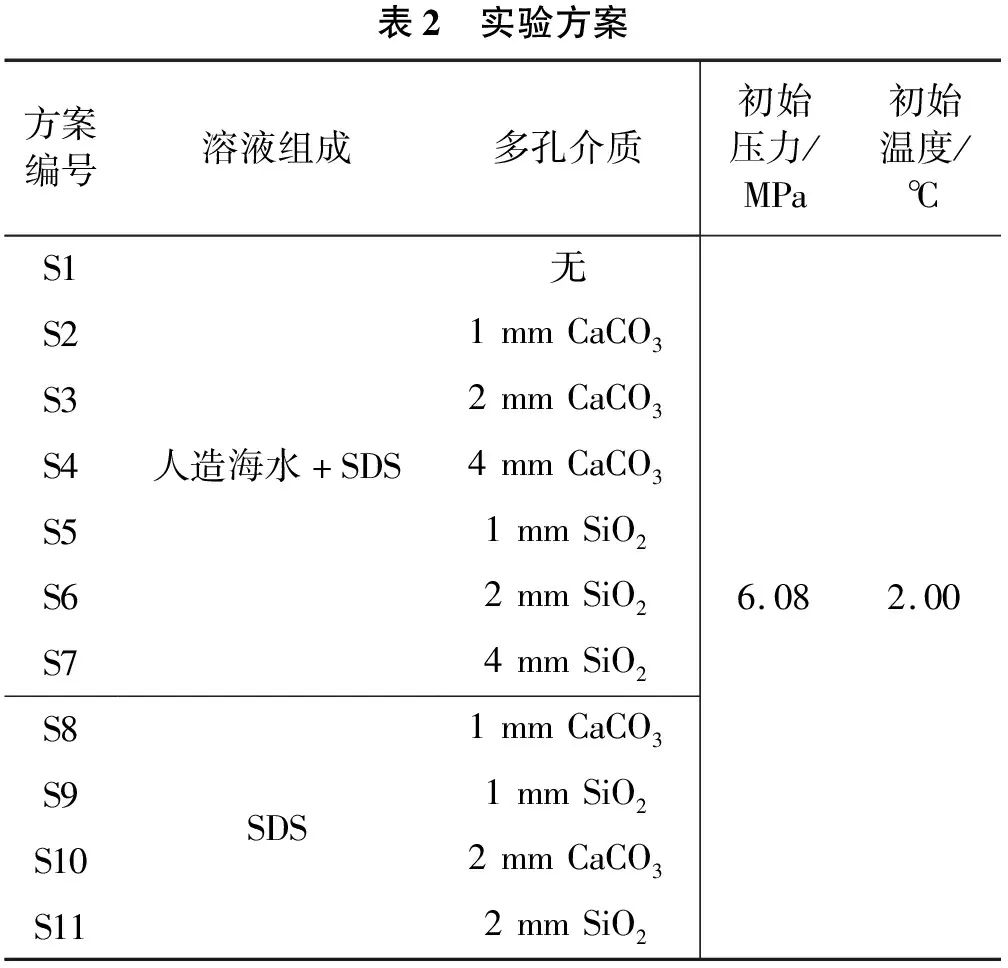
表2 实验方案方案编号溶液组成多孔介质初始压力/MPa初始温度/℃S1S2S3S4S5S6S7S8S9S10S11人造海水+SDSSDS无1mmCaCO32mmCaCO34mmCaCO31mmSiO22mmSiO24mmSiO21mmCaCO31mmSiO22mmCaCO32mmSiO26.082.00
1.3 实验步骤
(1)配置实验溶液,用去离子水对反应釜进行反复清洗、干燥。
(2)加入体积50 mL的多孔介质(CaCO3或SiO2),待气密性检验之后,通入100 mL实验溶液。
(3)待反应釜中温度降到实验设定温度。向反应釜内充入甲烷气体至设定压力后停止进气,待压力稳定后开始实验。
(4)记录实验数据和温压变化曲线图。当压力在2 h之内保持稳定或基本不变时,关闭恒温箱,保存数据并结束实验。
1.4 数据处理
气耗量和储气密度是评判甲烷水合物生成效果的重要标准。天然气水合物的储气能力一般以一定条件下的储气密度或含气率(Vmg/Vmw)表示。实验中采用的是99.9%(φ)的甲烷气体,通常情况下只会生成I型天然水合物,其计算公式见式(1)~式(2)。
(1)气耗量计算式:
(1)
(2)储气密度计算式:
(2)
(3)储气速率
储气速率可以用水合物在单位时间内实现的体积储气量来表示,其公式见式(3)。
(3)
2 实验结果分析与讨论
2.1 在人造海水中不同多孔介质内水合物生成情况
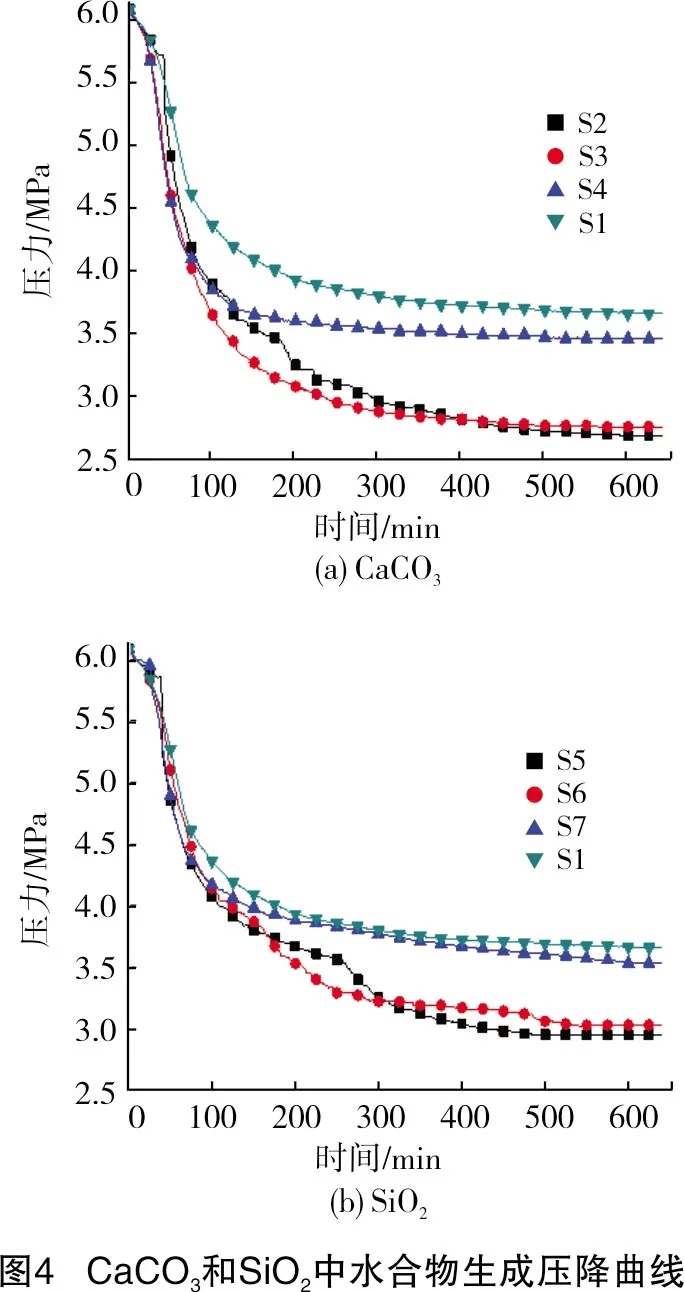
水合物一般是在异相非均质环境中生成。从图2可以看出,在4 mm的SiO2实验中,由于羟基的存在,对水合物生成的促进效果较小。但在水合物快速生成的阶段中,相同时间内CaCO3和SiO2压降曲线的斜率高于无多孔介质体系,这表明水合物在多孔介质体系中的生成速率明显高于无多孔介质体系,而且结束后的剩余压力更低,表明多孔介质中水合物储气效果更好。

从图2还可以看出,在3组对比实验中,相同粒径下水合物在CaCO3中的压降速率较快,这说明在水合物晶核的生长阶段,CaCO3对其促进作用要优于SiO2。根据zeta电位和晶体结构,CaCO3作为多孔介质在溶液中显正电性,会吸附大量SDS电离出的阴离子活性基团。而SiO2的表面会羟基化,羟基会与水中的氢键结合,提高孔隙间的压力,导致气体分子无法侵占水合物中的空腔,抑制后续晶核的生长和生成。因此,CaCO3对晶核生长的促进效果更加明显[14-15]。Nesterov等[16]发现颗粒的表面特性决定了其对水合物生成的促进效果,这与本研究结论一致。
气耗量和储气密度是评价对天然气水合物生成影响的重要指标。从图3可以看出,前100 min两参数均快速上升,表明此时水合物快速生成。直到生成接近结束后,气耗量和储气密度由于介质表面特性和粒径的不同产生了差异。CaCO3的参数均大于相同粒径的SiO2中生成的水合物,且1 mm CaCO3的气耗量和储气密度最大,其储气速率也最大。这表明CaCO3中生成的水合物储气效果更好。

2.2 在人造海水中相同多孔介质的不同粒径对水合物生成的影响
有研究指出,介质粒径大小会对水合物生成产生影响[17-18]。从图4可以看出,粒径大小对水合物生成的压降过程并无太大影响。但在水合物吸附气体阶段出现了差异,从而导致了剩余压力的不同。两组实验表明,随着粒径逐渐减小,实验结束后的剩余压力也逐渐减小。这说明多孔介质改变了溶液的空间结构,从而对水合物气耗量和储气密度等参数产生了影响,改变了实验的剩余压力[19-21]。
2.3 人造海水和SDS的混合溶液对水合物生成的影响
海水中盐类的存在对水合物的生成也有很大的影响。Ngoc等[22]发现,低浓度盐类会促进水合物快速生成,但高浓度盐类则会抑制水合物的生成。靳远等[23]通过改变溶液酸碱度从而改变溶液中H+和Cl-的浓度也得到了相同的结论。
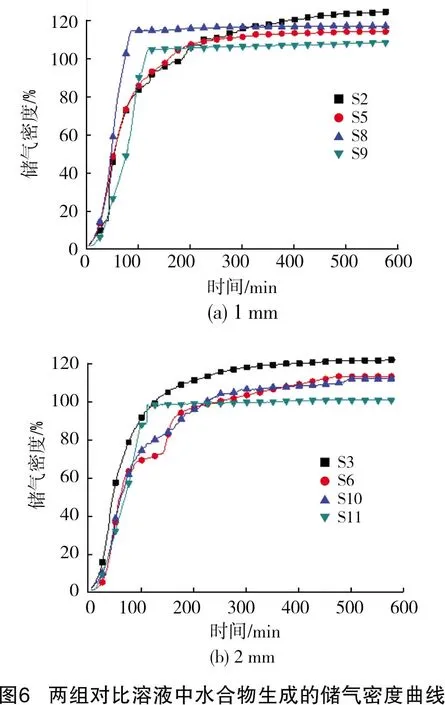
从图5可以看出,人造海水的加入使得实验结束后的剩余压力更低。从图6则可以看出,海水的加入提高了实验的气耗量和储气密度,对储气速率也有所提升。这是由于少量盐类会降低SDS的临界胶束浓度(critical micellar concentration, CMC),从而提高其促进效果[24]。而且,在SDS溶液中加入人造海水,会打破水中的氢键结合,降低溶液的表面张力,同时还会减少水合物形成团簇覆盖在介质颗粒表面,阻碍气液接触的可能。

2.4 诱导时间
一般认为,水合物易在异相非均质环境下成核,晶核需要一段时间的生长,这需要一个持续的诱导期,在诱导期内只有少量的水合物生成[25]。由于实验条件的不同,诱导期的长短会有很大差异,所以诱导时间也被认为是判断水合物生成速率大小的一个重要参数。
从图2和图5可知,11组实验均未产生明显的诱导期,釜内的压力从实验开始立即下降,表明此时水合物快速地大量生成,直到实验结束,压力维持不变为止。由此可以看出,多孔介质和盐类的加入有效地缩短了水合物的诱导期,减少了生成时间。这与Du等[10]和刘志明等[26]的文献报告一致。因此,这说明三者的混合体系有效地缩短了诱导时间,提高了晶核生成速度,促进了水合物快速生成。
3 人造海水中多孔介质与 SDS 复配对水合物生成影响的机理分析
(1)SDS的促进效果。SDS会在气-液界面富集,使界面两侧的离子相互作用,从而会降低气-液界面的表面张力,增大气体的溶解度,加快水合物的生成[27]。
(2)多孔介质的表面特性和吸附效果。多孔介质为水合物提供了更多的成核位置,水合物会优先在多孔介质表面生成[28]。CaCO3在溶液中会使活性基团更多地聚集在其表面,而SiO2表面由硅氧醇基和硅羟基所覆盖,会阻碍部分水合物的生成。因而,CaCO3中水合物的生成量更多,气体占笼率更高。
(3)盐类的离子交换效果。低浓度盐类会促进水合物生成[10,29]。混合溶液提高了水合物的储气密度和速率。盐类的加入打破了电离平衡,降低了相电势、界面张力和水合物形成团簇的可能性。
4 结论
(1)多孔介质的加入促进了水合物的生成,实验的剩余压力比无多孔介质的体系低,同时也提高了气耗量和储气密度,增大了水合物的储气速率。同种粒径条件下,CaCO3的促进效果优于SiO2。
(2)多孔介质的粒径变化改变了水合物的储气量。同种多孔介质的粒径越小,实验的剩余压力越低,气耗量、储气密度和储气速率越大。
(3)混合溶液较单纯的SDS溶液对水合物生成的促进效果更明显。储气密度和储气速率均有所提高。盐类的加入打破了溶液内的胶束基团,破坏了电离平衡,从而促进了水合物的生成。
(4)多孔介质、SDS和人造海水中的盐类三者协同作用有效地缩短了水合物的诱导时间,为水合物提供了更多的成核位置,提高了成核速率,有效地阻止了水合物的聚集。
符号说明
R:气体常数,当其他条件为标准条件时,R=8.314;
M:水合数,本实验为M= 6.1;
p0:实验初始压强,Pa;
Pt:t时刻压强,Pa;
V0:初始时刻气体体积;
T:温度,T=275.15 K,即2 ℃;
z0:初始气体压缩因子;
zt:时刻的气体压缩因子;
Vmw:水的摩尔体积,m3/mol;
Vmg:气体的摩尔体积,m3/mol;
Vw:生成水合物水的体积,m3;
ΔV:水合物相与液相中水的摩尔体积差,m3/mol,本次实验取ΔV=4.6 m3/mol;
n:气耗量,mol/mol 水;
Cs:储气密度(Vmg/Vmv);
v:储气速率,m3/(m3·min)。

