原花青素与维生素B1对酒精致小鼠大脑β淀粉样蛋白过量产生的影响
龚玉石,侯方丽,郭 娟,卢丹妍,王 凤
(广东药科大学食品科学学院,广东 广州 510006)
β淀粉样蛋白(β-amyloid peptide,Aβ)是由β-和γ-分泌酶水解β淀粉样前体蛋白(β-amyloid precursor protein,β-APP)而产生的40~42个氨基酸长度的多肽[1],它是构成阿尔茨海默症(Alzheimer′s disease,AD)患者脑内的特征性沉积物老年斑的核心成分[2],是AD关键的致病因素之一[3]。研究表明,在AD小鼠模型中,硫胺素(vitamin B1,VB1)的缺乏可以诱导氧化应激和增强Aβ的积累[4-5],而长期饮酒会导致VB1的缺乏[6-8]。所以酒精中毒时补充VB1有望能改善其症状。
我们前期的研究结果发现,长期摄入一定剂量的酒精可诱发脑Aβ含量的增加和氧化损伤[8],所以抗氧化剂的干预对于酒精中毒引起的脑损伤可能具有积极的作用。原花青素(proanthocyanidins,PC)是一类由多羟基黄烷-3-醇单元构成的天然多酚类化合物的总称,有超强的抗氧化活性及清除自由基的功能,具有多种生物学功能,如抗炎、抗肿瘤、保护心血管等作用[9]。前期研究发现,长期摄入一定剂量的酒精可导致脑Aβ含量的增加,且VB1的缺乏能加剧此过程,那么不同剂量酒精的摄入对大脑Aβ的影响是否不一样,原花青素与VB1对酒精中毒致大脑中Aβ的过量产生是否有改善作用,目前还不清楚。本研究主要探讨摄入不同剂量的酒精对C57BL/6小鼠大脑Aβ的影响,从而阐明酒精的摄入与AD之间的关系,是预防还是促进AD的发生与发展,为控制每天酒精的摄入量,预防老年痴呆提供新的实验依据。同时,研究原花青素与VB1对酒精中毒引起的脑Aβ过量产生的影响,为研制与开发拮抗酒精性脑损伤的保健食品提供理论参考。
1 材料与方法
1.1 主要试剂无水乙醇(国药集团化学试剂有限公司);酒精液体饲料及其对照液体饲料、VB1(南通特洛菲饲料科技有限公司);葡萄籽原花青素(天津尖峰天然产物研究开发有限公司,纯度>95%);β淀粉样蛋白1-42(β-amyloid peptide 1-42,Aβ1-42)、β淀粉样蛋白1-40(β-amyloid peptide 1-40,Aβ1-40)、β-APP 酶联免疫吸附测定试剂盒(南京建成生物工程研究所);链霉亲和素-生物素复合物(strept avidin-biotin complex,SABC)免疫组化试剂盒、3,3′-二氨基联苯胺(3,3′-Diaminobenzidine,DAB)显色试剂盒(博士德生物技术有限公司,批号:13H07L19G2321、13G10C22);Aβ1-42、Aβ1-40抗体(北京博奥森生物技术有限公司,批号:AG05112943、OH09023656)。
1.2 主要仪器SC-3610离心机(安徽中科中佳科学仪器有限公司);Synergy H1酶标仪(美国BioTek公司);CU-420电热恒温水浴箱(上海一恒科技有限公司);MC-1180显微镜(广州粤显光学仪器有限责任公司);TS-8转移脱色摇床(江苏海门市其林贝尔仪器制造有限公司)。
1.3 动物分组及处理健康7周龄SPF级C57BL/6雌性小鼠90只,体质量(18±2)g,购自广东省实验动物中心,许可证号为SCXK(粤)2013-0002。购入小鼠在本实验室动物房适应1 w后,随机分为9组:对照组、0.5%酒精组、1%酒精组、2%酒精组、3%酒精组、4%酒精组、PC+4%酒精组、VB1+4%酒精组、PC+VB1+4%酒精组,酒精浓度单位为wt/vol,0.5%、1%、2%、3%、4%酒精组小鼠每天摄入酒精的量分别为2.2、4.5、9、13、18 g·kg-1。每组10只,每笼5只。
配对喂养:每天计算前一天每组小鼠平均每只的进食量,以正常水平内摄入的液体饲料的体积数最少的为配对基础,其他配对组配制的液体饲料的体积数与前一天体积数最少的那组摄入的液体饲料体积数一样。
每天现配液体饲料,选用无水乙醇(分析纯,含量不低于99.99%),根据不同的酒精浓度以及液体饲料的配方计算相应的乙醇添加量,配制成不同酒精浓度梯度的酒精液体饲料配对喂养小鼠,对照组给予对照液体饲料。PC+4%酒精组、VB1+4%酒精组、PC+VB1+4%酒精组的酒精液体饲料中还分别添加0.2 g· L-1的PC、0.02 mg· g-1的VB1、0.2 g· L-1PC+0.02 mg·g-1的VB1。小鼠每天摄入的酒精、PC与VB1的量分别为18 g·kg-1、90 mg·kg-1与1.7 mg·kg-1。
每天下午6~7点换上新鲜配制的液体饲料,以液体饲料作为唯一食物及饮水来源配对喂养小鼠,连续10周,每周称体重1次。
1.4 Aβ1-42、Aβ1-40、β-APP含量的测定采用颈椎脱臼法处死小鼠,迅速取大脑,用相应比例的生理盐水制成10%匀浆,4 000 r·min-1离心10~15 min,取上清液测定。按照酶联免疫吸附测定试剂盒的操作步骤与说明,用酶标仪分别测定Aβ1-42、Aβ1-40、β-APP的含量。
1.5 免疫组化测定 Aβ1-42、Aβ1-40的表达所取小鼠脑组织用4%多聚甲醛固定,常规石蜡包埋,切片,裱于干净载玻片上,60 ℃烤片机上烤片2 h,二甲苯脱蜡2次,每次20 min,依次用无水乙醇,95%乙醇,80%乙醇,蒸馏水处理至透明。
处理好的切片按SABC免疫组化试剂盒提供的方法操作(Aβ1-42抗体稀释100倍,Aβ1-40抗体稀释50倍),DAB显色、脱水、透明、封片。显微镜下观察与拍照,阳性表达呈棕黄色或棕褐色。采用Imaga-ProPlus 6.0病理图像分析软件测定单个视野中累积光密度和其分布面积,计算平均积分光密度值(integral optical density,IOD)。
2 结果
2.1 摄食量本实验采用的是配对喂养,由Tab 1、2可见,各组小鼠之间摄入的液体饲料量差异无显著性(P>0.05)。
2.2 体重Fig 1显示,第4周,4%酒精组的小鼠体重明显高于2%酒精组,差异有统计学意义(P<0.05)。第6周,4%酒精组的小鼠体重明显高于0.5%、1%、2%酒精组,差异均有统计学意义(P<0.05)。第7周,4%酒精组的小鼠体重明显高于对照组,差异有统计学意义(P<0.05)。Fig 2显示,第7周与第9周,酒精组的小鼠体重均明显高于对照组,差异有统计学意义(P<0.01)。

Fig 1 Effect of ethanol on body weight
2.3 酒精摄入对脑Aβ1-42含量的影响由Tab 3可见,3%、4%酒精组Aβ1-42含量明显高于对照组,差异有统计学意义(分别P<0.01,P<0.01)。0.5%、1%、2%酒精组与对照组之间差异无统计学意义(P>0.05)。4%酒精组Aβ1-42含量明显高于0.5%、1%酒精组,差异有统计学意义(分别P<0.01,P<0.05)。3%酒精组Aβ1-42含量明显高于0.5%、1%酒精组,差异有统计学意义(分别P<0.01,P<0.01)。

Fi`g 2 Effect of PC and VB1 on body weight of C57BL/6 mice administered with 4%
2.4 酒精摄入对脑Aβ1-40含量的影响由Tab 3显示,2%、3%、4%酒精组Aβ1-40含量明显高于对照组,差异有统计学意义(分别P<0.05,P<0.05,P<0.01)。0.5%、1%酒精组与对照组之间差异无统计学意义(P>0.05)。4%酒精组Aβ1-40含量与0.5%、1%、3%酒精组之间相比,差异有统计学意义(分别P<0.01,P<0.01,P<0.01)。3%酒精组Aβ1-40含量明显高于0.5%、1%、2%酒精组,差异有统计学意义(分别P<0.01,P<0.01,P<0.01)。2%酒精组Aβ1-40含量明显高于0.5%、1%酒精组,差异有统计学意义(分别P<0.01,P<0.01)。
2.5 酒精摄入对脑β-APP含量的影响由Tab 3可知,脑β-APP的含量,3%、4%酒精组明显高于对照组,差异有统计学意义(分别P<0.01,P<0.01)。0.5%、1%、2%酒精组与对照组之间差异无统计学意义(P>0.05)。0.5%、1%酒精组脑β-APP的含量与4%酒精组相比,差异有统计学意义(分别P<0.05,P<0.05)。0.5%、1%、2%酒精组脑β-APP的含量与3%酒精组相比,差异有统计学意义(分别P<0.01,P<0.01,P<0.05)。
Tab 1 Liquid diet volume of C57BL/6 mice administered with

Tab 2 Liquid diet volume of C57BL/6 mice supplemented with PC and

Tab 3 Effect of ethanol on Aβ1-42, Aβ1-40,β-APP level from brain of C57BL/6
Tab 4 Effect of PC and VB1 on Aβ1-42, Aβ1-40, β-APP level in brain of C57BL/6 mice administered with 4%
2.6 PC与VB1对慢性酒精中毒小鼠脑中Aβ1-42含量的影响Tab 4显示,脑Aβ1-42的含量,酒精组明显高于对照组,差异有统计学意义(P<0.01)。PC+酒精组、PC+VB1+酒精组Aβ1-42的含量明显低于酒精组,均有统计学意义(分别P<0.01,P<0.01)。与PC+VB1+酒精组相比,PC+酒精组、VB1+酒精组Aβ1-42的含量差异有统计学意义(分别P<0.01,P<0.01)。PC+酒精组与VB1+酒精组之间Aβ1-42的含量差异有统计学意义(P<0.05)。
2.7 PC与VB1对慢性酒精中毒小鼠脑中Aβ1-40含量的影响由Tab 4可知,脑Aβ1-40的含量,与对照组比较,酒精组差异有统计学意义(P<0.05)。PC+VB1+酒精组脑Aβ1-40的含量明显低于酒精组,差异有统计学意义(P<0.01)。PC+VB1+酒精组与PC+酒精组、VB1+酒精组比较,差异有统计学意义(分别P<0.05,P<0.01)。
2.8 PC与VB1对慢性酒精中毒小鼠脑中β-APP含量的影响Tab 4显示,脑β-APP的含量,酒精组明显高于对照组,差异有统计学意义(P<0.05),PC+酒精组、PC+VB1+酒精组β-APP的含量明显低于酒精组,差异有统计学意义(分别P<0.05,P<0.01)。
2.9 PC与VB1对慢性酒精中毒小鼠脑中Aβ1-42、Aβ1-40、β-APP含量的交互作用Tab 5显示,脑Aβ1-42与β-APP的含量,PC×VB1不明显,PC与VB1对脑Aβ1-42与β-APP含量的影响没有交互作用。脑Aβ1-40含量,PC×VB1明显,PC与VB1对脑Aβ1-40含量的影响有交互作用(P<0.01)。

Tab 5 Two-way ANOVA for effect of PC and VB1 on Aβ1-42, Aβ1-40 and β-APP levels in brain of C57BL/6 mice administered with 4% ethanol
2.10 酒精摄入对Aβ1-42、Aβ1-40在大脑皮层表达的影响Tab 6、Fig 3显示,2%、3%、4%酒精组Aβ1-42的表达明显高于对照组(分别P<0.05,P<0.01,P<0.01)。0.5%、1%、2%酒精组Aβ1-42的表达明显低于3%与4%酒精组(分别P<0.01,P<0.01,P<0.01;P<0.01,P<0.01,P<0.05)。

Tab 6 Effect of ethanol on Aβ1-42, Aβ1-40expression in cortex of C57BL/6
Tab 6、Fig 4显示,与对照组相比,2%、3%、4%酒精组Aβ1-40的表达明显增加(分别P<0.01,P<0.01,P<0.01)。与4%酒精组相比,0.5%、1%酒精组Aβ1-40的表达明显减少(分别P<0.01,P<0.01)。0.5%、1%、2%、4%酒精组Aβ1-40的表达明显低于3%酒精组(分别P<0.01,P<0.01,P<0.01,P<0.01)。与2%酒精组相比,0.5%、1%酒精组Aβ1-40的表达明显减少(分别P<0.01,P<0.01)。

Fig 3 Effect of ethanol on Aβ1-42 expression in cortex of C57BL/6 mice(×400)

Fig 4 Effect of ethanol on Aβ1-40 expression in cortex of C57BL/6 mice(×400)
2.11 PC与VB1对慢性酒精中毒小鼠大脑皮层Aβ1-42、Aβ1-40表达的影响Tab 7、Fig 5显示,酒精组Aβ1-42的表达明显高于对照组(P<0.01)。PC与VB1共同干预组、VB1干预组、PC干预组Aβ1-42的表达明显低于酒精组(分别P<0.01,P<0.05,P<0.01)。PC与VB1共同干预组Aβ1-42的表达明显低于PC干预组、VB1干预组(分别P<0.01,P<0.01)。PC干预组Aβ1-42的表达明显低于VB1干预组(P<0.01)。
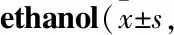
Tab 7 Effect of PC and VB1 on Aβ1-42, Aβ1-40 expression in cortex of C57BL/6 mice administered with 4% n=3)

Fig 5 Effect of PC and VB1 on Aβ1-42 expression in cortex of C57BL/6 mice administered with 4% ethanol(×400) A:Control; B:4%-EtOH; C:PC+4%-EtOH; D:VB1+4%-EtOH; E:PC+VB1+4%-EtOH
Tab 7、Fig 6显示,与对照组相比,酒精组Aβ1-40的表达明显增多(P<0.01)。与酒精组相比,PC与VB1共同干预组Aβ1-40的表达明显减少(P<0.01)。PC与VB1共同干预组Aβ1-40的表达明显低于PC干预组、VB1干预组(分别P<0.01,P<0.01)。
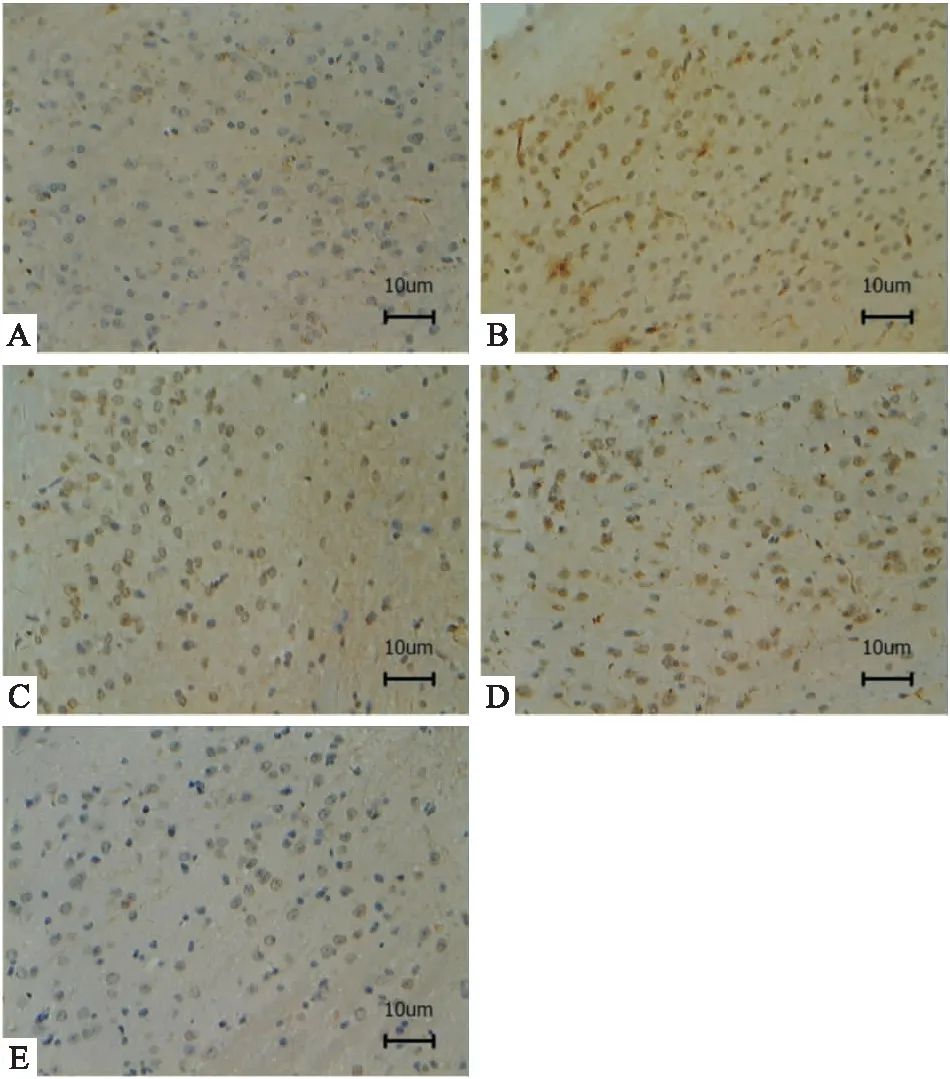
Fig 6 Effect of PC and VB1 on Aβ1-40 expression in cortex of C57BL/6 mice administered with 4% ethanol(×400) A:Control; B:4%-EtOH; C:PC+4%-EtOH; D:VB1+4%-EtOH; E:PC+VB1+4%-EtOH
3 结论与讨论
饮食摄入量的不同会影响脑Aβ的生成,Schafer等[10]研究表明,饮食限制能明显减少AD转基因小鼠Tg2576小鼠海马Aβ的沉积,故此实验采用配对喂养,可以排除摄食量的不同对小鼠Aβ的影响。
Aβ主要有Aβ1-40及Aβ1-42两种形式,适宜剂量与高浓度酒精的摄入对神经细胞与Aβ的影响不同。体外研究表明,低浓度的乙醇能防止Aβ1-42诱导的海马神经细胞的突触毒性[1];适量乙醇预处理能防止Aβ诱导的海马神经毒性和细胞凋亡[11];乙醇降低Aβ体外聚集,防止对PC12细胞的毒性[12]。但长期过度饮酒会造成慢性酒精中毒,严重损害大脑,引起神经退行性病变从而痴呆[13]。本实验选择的是健康的C57BL/6小鼠为研究对象,设计摄入低浓度到高浓度的酒精,在体内研究其对大脑Aβ的影响。研究结果提示高剂量酒精的摄入能促进健康小鼠大脑Aβ的生成,低剂量的酒精无影响。APP被分泌酶切割而产生Aβ[1],任何一种引起APP代谢异常的原因均可导致Aβ产生过多,使大量Aβ聚集。Kim等[14]报道,酒精暴露的神经毒理学效应会增加β-APP的含量。本次实验结果与前人报道相符,高浓度酒精的摄入能使小鼠大脑β-APP过量产生,低浓度酒精的摄入对β-APP无影响。
关于PC对酒精性脑损伤的研究,仅在国内有可数的几篇文献报道。PC可以抑制乙醇引起的脑细胞DNA损伤[15],葡多酚可减轻慢性酒精中毒引起的大鼠营养障碍、脑组织氧化和病理损伤和神经元坏死[16]。最新研究发现,PC白藜芦醇能通过对抗并清除自由基,提高SOD、GSH-Px和Ca2+-Mg2+-ATP酶活性,降低大鼠血清 MDA和脑MDA、Ca2+含量,减轻精神、行为障碍,对52°白酒酒精性脑损伤起到预防性保护作用[17]。PC及其与VB1合用是否可以抑制酒精中毒导致的Aβ在大脑中过量产生与积累值得研究。在本研究中,我们发现PC与VB1合用能明显降低酒精中毒小鼠脑中Aβ1-42、Aβ1-40、β-APP的水平,明显减少酒精中毒小鼠大脑皮层Aβ1-42、Aβ1-40的表达;PC干预能明显抑制酒精中毒小鼠脑中Aβ1-42与β-APP的过量生成;VB1干预能明显降低Aβ1-42在酒精中毒小鼠大脑皮层的表达;但PC与VB1合用比其单独使用对Aβ1-42与Aβ1-40过量产生的抑制效果更好一些。
虽然已有实验证实慢性酒精中毒可以增加 APP 的含量、影响β-分泌酶的活性[14],但是在此之后Aβ蛋白的产生能否增加、慢性酒精中毒在 Aβ 蛋白的产生中发挥的作用还不甚明确。总之,本研究结果发现,高浓度酒精的摄入(13~18 g·kg-1)能使Aβ在健康小鼠大脑中过量产生与积累,PC与VB1合用对此有很好的拮抗作用,且效果要比PC、VB1单独使用更好。由此可见,慢性酒精中毒可能是诱发AD发病的有关因素之一,而PC与VB1合用对酒精中毒引起的脑损伤具有很好的保护作用,此研究为AD的预防和大脑的保护作用提供了新的见解和方法。PC与VB1合用是否对AD症转基因小鼠也有很好的营养干预作用有待研究。