尿石素A通过促进线粒体自噬保护糖尿病小鼠心脏损伤的作用研究
周 友,朱小艳,黄建荣,高智敏,吴晓倩
(1. 广州医科大学药学院药理教研室,广东 广州 511436; 2. 湖北省第三人民医院药学部,湖北 武汉 430033)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是由糖尿病引起的一种心肌结构和功能异常的疾病,它独立于高血压或冠心病等其它心脏疾病而存在,是糖尿病主要致死性并发疾病[1]。因此,寻找新的药物或靶点对糖尿病患者的心肌病变进行预防和治疗具有重要临床意义。线粒体是一个参与多种细胞活动的重要细胞器,正常状态下处于持续分裂、融合、生成、降解的动态平衡。这种动态平衡的维持保证了细胞对复杂的生长环境和不同应激的适应和抵抗[2]。研究表明,糖尿病心脏心肌细胞中存在线粒体功能紊乱,而调控线粒体自噬可以对DCM发挥积极作用[3]。
尿石素A(urolithin A,UA)是石榴、草莓、坚果等富含鞣花单宁的食物在肠道内的主要代谢产物,具有抗炎、抗氧化、抗肿瘤等药理作用[4]。有研究表明,UA通过调控线粒体的生成和降解维持了生物体内线粒体的平衡和健康,这种调节作用能使衰老机体的肌肉功能提高[5,6]。课题组前期发现,UA可以调节心肌细胞自噬并对糖尿病小鼠心脏具有保护作用[7]。然而,UA改善DCM心肌细胞线粒体自噬尚不清楚。本研究旨在通过观察UA在糖尿病小鼠心脏和高糖处理的心肌成纤维细胞中的作用,探讨UA对糖尿病心脏病的改善作用是否依赖于线粒体自噬。
1 材料与方法
1.1 材料
1.1.1实验动物 健康SPF 级 ♂ C57BL/6小鼠32只,体质量(20~25) g;健康SPF级♂SD大鼠5只,体质量(180~220) g,均购于广州中医药大学实验动物中心,动物准字号:SYXK粤2016-0168。每4只小鼠为一笼,饲养过程自由摄食饮水。动物实验参照中国动物福利法案,经广州医科大学实验动物伦理委员会批准后进行。
1.1.2试剂 DMEM低糖培养基、胎牛血清、胰蛋白酶,购于美国Gibco公司;UA、链脲佐菌素(streptozotocin,STZ)、D-(+)-葡萄糖,购于Sigma公司;Mito-Tracker(C1048)、Lyso-Tracker(C1046)、JC-1荧光探针(C2005)、线粒体分离试剂盒(C3601)购自碧云天公司;Mdivi-1(HY-15886)购自Medchemexpress公司;β-actin一抗(TA-09)、抗兔或抗鼠IgG购自北京中杉金桥公司;LC3一抗(2775),p62一抗(39749)购自美国 Cell Signal Technology公司;Collagen Ⅰ一抗(ab34710)购自 Abcam公司;Fibronectin(FN)一抗(15613-1-AP)、VDAC1/2一抗(10866-1-AP)购自Proteintech公司。其余试剂均为国产分析纯。
1.1.3仪器 Vevo2100高分辨小动物超声成像系统(加拿大Visual Sonics公司);低温高速离心机(德国Eppendorf公司);垂直电泳槽(上海天能公司);多功能酶标仪(德国Berthold公司);倒置荧光显微镜、激光共聚焦显微镜(日本Nikon公司)。
1.2 方法
1.2.1动物实验分组及处理 6~8周龄的 ♂ C57BL/6小鼠随机分为正常对照组(CTL组)、UA组(UA50组)、DCM模型组(DCM组)、DCM加UA灌胃组(DCM+UA50组),各组8只。动物购买适应性喂养1周后,小鼠连续6 d腹腔注射50 mg·kg-1的链脲佐菌素(STZ,溶解于柠檬酸缓冲液)构建糖尿病模型。造模6周后,UA50组和DCM+UA50组按50 mg·kg-1(溶解于质量分数为0.9%羧甲基纤维素钠)UA连续灌胃11周,DCM组灌胃等体积的溶剂液体。所有小鼠每2周测定1次体质量和随机血糖。
1.2.2超声测量心功能 持续吸入异氟烷麻醉小鼠,仰卧固定至37 ℃恒温板。小鼠四肢与电极相连监测心率。胸部脱毛并涂抹超声波耦合剂,分别在短轴和在四腔面检测小鼠心脏的舒缩和血流变化。选取连续5个心动周期测量计算左室射血分数(left ventricular ejection fraction,LVEF)、左室短轴缩短率(fractional shortening,FS)、收缩末期左室前壁厚度(systolic left ventricular anterior wall,LVAWs)、舒张期左室前壁厚度(diastolic left ventricular anterior wall,LVAWd)、收缩末期左室后壁厚度(systolic left ventricular posterior wall,LVPWs)、舒张期左室后壁厚度(diastolic left ventricular posterior wall,LVPWd)、左室舒张早期最大血流/二尖瓣心房收缩期最大血流(ratio of E/A),数据取平均值。
1.2.3成年鼠心肌成纤维细胞分离培养 将大鼠麻醉处死并在酒精洗浴灭菌后移入在超净台内。沿肋骨剪开胸腔取出心脏,放入装有预冷PBS的大皿中洗净血液,并修剪去除残余的心耳及动脉组织。将剩余心脏组织剪碎成均匀的1~2 mm小块置于50 mL离心管,加入约5 mL含0.1% Ⅱ型胶原酶和0.25%胰酶的DMEM溶液。密封离心管于37 ℃水浴锅轻摇25 min后除去消化液。用3 mL胰酶溶液继续消化25 min,吸取上清液与等体积的完全培养基混合终止消化,重复3次。剩余组织小块换用0.1% Ⅱ型胶原酶溶液重复3次消化过程。合并上清液并离心,以完全培基重悬沉淀并种植至培养皿内正常培养进行差速贴壁1 h后,换液去除未贴壁细胞。取1~4代细胞用于后续实验。
1.2.4细胞实验分组 为探索UA的最优使用浓度,心肌成纤维细胞随机分为:正常对照组(DMEM培养基含葡萄糖量5.5 mmol·L-1)、UA处理组(UA 40 μmol·L-1处理24 h)、高糖组(HG,DMEM培养基含葡萄糖量33.3 mmol·L-1刺激48 h)、高糖加UA处理组(DMEM培养基含葡萄糖量33.3 mmol·L-1刺激48 h,分别使用10、20、40 μmol·L-1的UA处理24 h)。为探索UA对线粒体自噬的影响,心肌成纤维细胞随机分为: CTL组(DMEM培养基含葡萄糖量5.5 mmol·L-1)、UA组(20 μmol·L-1的UA处理24 h)、HG组(DMEM培养基含葡萄糖量33.3 mmol·L-1刺激48 h)、HG加UA处理组(DMEM培养基含葡萄糖量33.3 mmol·L-1刺激48 h,20 μmol·L-1的UA处理24 h)、HG加Mdivi-1处理组(DMEM培养基含葡萄糖量33.3 mmol·L-1刺激48 h,10 μmol·L-1的Mdivi-1处理3 h)、HG加UA加Mdivi-1处理组(DMEM培养基含葡萄糖量33.3 mmol·L-1刺激48 h,20 μmol·L-1的UA处理24 h,10 μmol·L-1的Mdivi-1处理3 h)。
1.2.5Western blot检测及线粒体分离 各组取20 μg蛋白样品于聚丙烯酰胺凝胶泳道内,在恒压100 V条件下电泳分离,并以250 mA将蛋白用恒流湿转至PVDF膜。质量分数5%的脱脂奶粉室温封闭1 h,一抗于4 ℃摇床孵育过夜,二抗室温孵育1 h。显影成像后采用Image J进行分析灰度。线粒体分离按试剂盒说明书操作,得到线粒体组分裂解液后用于Western blot分析。
1.2.6Mito-Tracker、Lyso-Tracker、JC-1荧光探针的检测 依试剂盒说明书所示,避光条件下,Mito-Tracker和Lyso-Tracker稀释入培养基内,终浓度分别为50 nmol·L-1、100 nmol·L-1。细胞在高糖及UA处理结束之后换入溶有探针的培养基,在培养箱内孵育45 min后取出换回正常培养基,采用共聚焦显微镜拍摄荧光图像。避光条件下,依试剂盒说明书配置好JC-1工作液。黑色96孔板内细胞处理结束后吸去原来培养液,加入JC-1工作液孵育30 min,孵育结束后吸去工作液换入PBS。采用多功能酶标仪分别检测绿色荧光(激发波长514 nm,发射波长529 nm)强度和红色荧光(激发波长585 nm,发射波长590 nm)强度,采用倒置荧光显微镜拍摄图像。
Tab 1 Cardiac dysfunction alleviated by urolithin A in diabetic
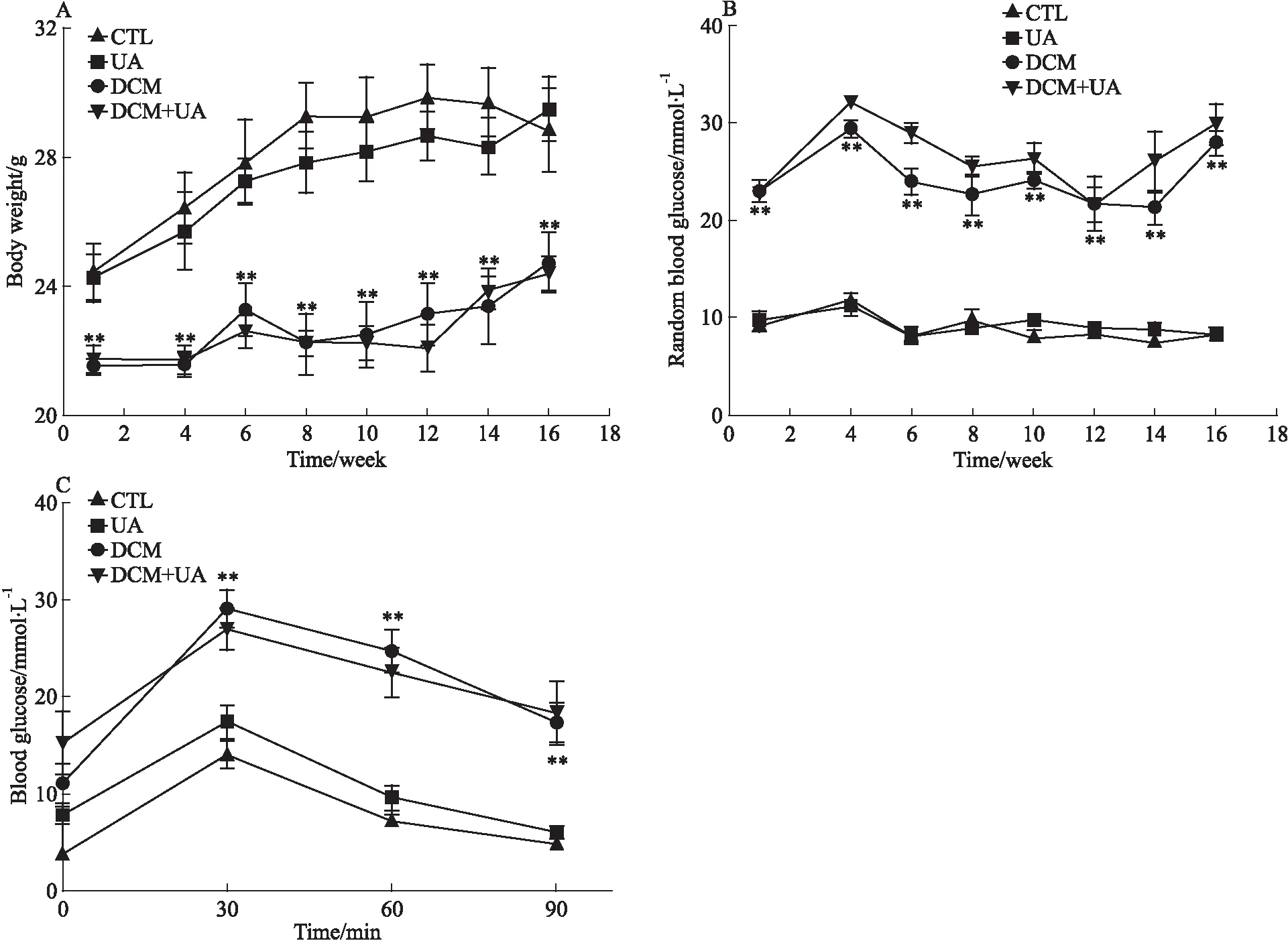
Fig 1 Effect of urolithin A on body weight and blood glucose in normal and STZ-induced diabetic mice(n=8) A: Body weight in each group; B: Random blood glucose in each group; C: Glucose tolerance in each group.**P<0.01 vs CTL group.
2 结果
2.1 UA对小鼠的体质量和血糖的影响如Fig 1所示,注射STZ后,DCM组与CTL组相比随机血糖升高、体质量减轻,在第17周检测发现DCM组小鼠糖耐量受损,差异均具统计学意义(P<0.01);而UA干预对正常小鼠和糖尿病小鼠的随机血糖、体质量及糖耐量均无明显影响。
2.2 UA改善糖尿病小鼠心脏功能如Tab 1超声结果所示,UA对正常小鼠各项参数均无明显影响;与CTL组比较,DCM组心脏收缩功能参数LVEF、LVFS、LVPWs无明显变化;其舒张功能参数E/A、LVAWd、LVPWd和收缩功能参数LVAWs值降低(P<0.05);而DCM+UA组的E/A、LVAWs、LVAWd、LVPWd值比DCM组均明显升高(P<0.05)。结果提示糖尿病小鼠心脏出现舒张功能障碍并伴有心室壁变薄,而UA可以改善糖尿病小鼠的心脏病变。
2.3 UA降低糖尿病小鼠心脏和心肌成纤维细胞内间质胶原蛋白的表达Western blot结果如Fig 2A所示,与CTL组相比,DCM组小鼠心脏内FN、Collagen Ⅰ蛋白的表达上调(P<0.01);而UA干预能降低DCM小鼠心脏内FN、Collagen Ⅰ的表达(P<0.01)。体外采用33.3 mmol·L-1高糖和不同浓度的UA处理心肌成纤维细胞,结果如Fig 2B,高糖诱导成纤维细胞内FN、Collagen Ⅰ的表达升高(P<0.01),而20 μmol·L-1和40 μmol·L-1的UA能明显降低FN、Collagen Ⅰ的表达(P<0.01)。结果提示UA可减轻高糖导致的间质胶原蛋白增加。
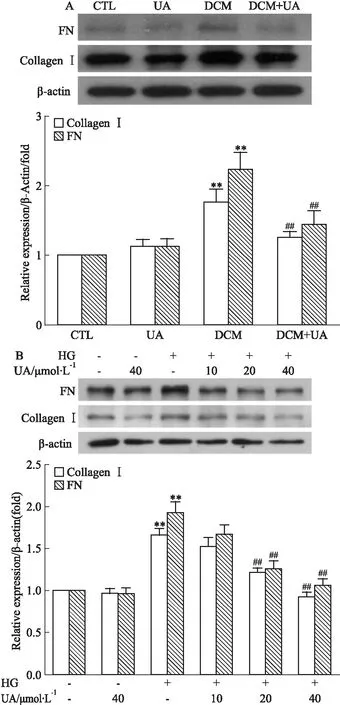
Fig 2 Effect of urolithin A on cardiac extracellular matrix protein expression
2.4 线粒体自噬介导UA的改善作用细胞采用20 μmol·L-1的UA处理进行实验。Mito-tracker和Lyso-tracker双标的结果如Fig 3A所示,HG组线粒体与溶酶体共定位水平降低,而UA处理可提高二者的共定位水平。Western blot检测结果表明(Fig 3B),高糖抑制了线粒体组分内LC3 Ⅱ的表达(P<0.05),而UA明显提高了线粒体组分内LC3 Ⅱ和p62的表达(P<0.01)。如Fig 3C-D的JC-1荧光检测结果表明,UA降低了高糖导致的极性受损线粒体含量,而此效果被线粒体自噬抑制剂Mdivi-1逆转,差异均具有统计学意义(P<0.05)。以上结果提示UA抗糖尿病心脏损伤的作用可能与线粒体自噬有关。
3 讨论
糖尿病心肌病是以舒张功能障碍和心肌间质胶原堆积为起始,在代谢紊乱、氧化应激、线粒体损伤等过程的持续作用下,最终发展成不可逆心力衰竭的心脏疾病[1]。文献报道UA具有提高肥胖小鼠的胰岛素敏感性、减少血管内皮细胞功能紊乱、减轻心肌缺血再灌注损伤等一系列药物活性[8-10]。本研究发现,持续摄入UA对STZ诱导的糖尿病小鼠的体质量、血糖、糖耐量无明显影响,但对小鼠的心脏损伤具有改善作用。UA能提高小鼠心脏的舒张功能,这与Savi等[11]报道UA能减轻糖尿病大鼠心脏功能障碍的研究结果一致。同时UA还能抑制糖尿病小鼠心脏组织内胶原纤维蛋白堆积、减轻心室壁变薄,抑制其向心力衰竭的进一步发展。这表明了UA对糖尿病小鼠心脏损伤良好的保护作用。
心肌成纤维细胞是心脏组织的主要细胞类型,它们的生命活动对心脏功能发挥着重要作用[12]。高糖环境被认为是造成糖尿病心肌病变的一个主要诱因,因此高糖也常被用于诱导糖尿病心肌病的体外模型[13]。本研究中,UA在高糖刺激的心肌成纤维细胞中具有抑制FN、Collagen Ⅰ蛋白表达的作用,与在小鼠心脏中的抑制效果相同。因此我们在高糖刺激的心肌成纤维细胞中展开研究,从体外明确UA改善糖尿病心肌病心肌损伤的机制。
糖尿病心肌病被证实和心肌肥大、心肌缺血再灌注损伤、心力衰竭等心脏疾病一样与线粒体自噬有关[2]。线粒体自噬起始时,极性受损的线粒体募集受体蛋白p62与其结合。另一方面,p62能被自噬体膜上的LC3 Ⅱ蛋白识别,由此使线粒体被自噬体包裹并被运输至溶酶体而降解[2]。有研究证实褪黑素能通过促进线粒体自噬抑制糖尿病小鼠的心脏病变[14]。本研究发现,高糖下细胞内线粒体结合的LC3 Ⅱ含量下降,极性受损线粒体含量增多。提示线粒体自噬受到抑制,清除受损线粒体能力下降。而UA治疗可明显提高线粒体结合的p62及LC3 Ⅱ含量、促进线粒体与溶酶体融合,使细胞内受损线粒体含量降低。在使用线粒体自噬抑制剂Mdivi-1后,UA降低受损线粒体含量的效果被逆转,表明线粒体自噬介导了UA的保护作用。

Fig 3 Effect of urolithin A on mitophagy in normal and high glucose treated cardiac fibroblasts A: Mito-tracker and Lyso-tracker staining(×600, scale bar:5 μm,n=4); B: Representative immunoblot images and analysis of p62 and LC3 Ⅱ expression in mitochondrial fraction(n=3); C: Fluorescence analysis of JC-1 staining(n=5); D: Representative images of JC-1 staining(×200, scale bar:25 μm, n=5);*P<0.05 vs CTL group;**P<0.01 vs CTL group;#P<0.05 vs HG group;##P<0.01 vs HG group;▲P<0.05 vs HG+UA group.
综上所述,UA能保护糖尿病心脏的心肌损伤,其机制与促进心肌内线粒体自噬有关。本研究为寻找针对糖尿病心肌病中线粒体调控的相关药物提供了理论基础。