125I粒子抑制裸鼠T24移形细胞癌效果
焦德超,许凯豪,韩新巍,张全会,李宗明,王艳丽
(郑州大学第一附属医院介入科,河南 郑州 450052)
目前125I粒子链(将125I放射性粒子逐粒串成链状结构)已用于近距离放射治疗(简称放疗)胆管癌、食管癌、门静脉癌栓[1-2]。输尿管为细管条状结构,体积较小肿瘤(直径5~10 mm)即可引起梗阻症状,而在狭小的输尿管内125I粒子更易发挥近距离放疗效果[3]。输尿管和膀胱上皮均由移形上皮细胞组成。本研究观察不同活度125I粒子对裸鼠T24移形细胞癌的抑制效果,以期为临床应用125I粒子链治疗输尿管移形细胞癌提供依据。
1 材料与方法
1.1 材料 实验动物为BABL/c裸鼠40只,雄性,4~6周龄,体质量18~24 g,购自九睿生物技术有限公司[SCXK(京)2016-2008号]。实验瘤株为T24人膀胱移行细胞癌,购自中国科学院细胞库(SCSP-536)。125I粒子购自天津赛德生物制药有限公司,规格0.8 mm×4.5 mm;125I吸附银棒,其外壁为0.05 mm厚钛壳。放射性粒子源能量27~35 MeV,半衰期59.6天。治疗计划系统(treatment plan system, TPS)为北京航空航天大学研制。
1.2 动物分组及处理 将对数生长期T24移行细胞悬液(浓度5×107/ml)接种于裸鼠靠近前肢皮下。10~15天后,待荷瘤裸鼠瘤径达5~7 mm时,将裸鼠随机分为高(0.9 mCi、33.3 MBq)、中(0.6 mCi、22.2 MBq)、低(0.3 mCi、11.1 MBq)活度组和对照组,每组10只。于无菌条件下以10%水合氯醛40 mg/kg体质量腹腔麻醉荷瘤鼠后,以碘伏消毒移植瘤处3 cm范围内皮肤,于DSA(Sienmens Artis Zeego DSA机)引导下将18G穿刺针刺入肿瘤中心并植入1枚粒子(必要时使用Siemens虚拟导航),对照组植入不含核素的空白粒子。见图1。
1.3 相关指标观察
1.3.1 90%肿瘤体积吸收剂量(D90) 采用Siemens 3.0T verio高场强MR扫描仪和裸鼠专用线圈,于粒子植入即刻及植入后10、20天分别进行轴位和冠状位 T1W及T2W序列扫描。T1W扫描参数:TR 604.0 ms, TE 13.0 ms, 层厚1 mm,空间分辨力0.4 mm×0.4 mm×1.0 mm;T2W扫描参数:TR 4 260.0 ms, TE 73.0 ms, 层厚1 mm, 空间分辨力0.3 mm×0.3 mm×1.0 mm;视野100 mm×100 mm,翻转角15°,矩阵256×256。将MR图像输入TPS,分别计算高、中、低活度组D90。见图2。
1.3.2 抑瘤率(inhibitory rate, IR) 计算高、中、低活度组植入粒子后10、20天的IR。IR=(对照组肿瘤体积—实验组肿瘤体积)/对照组肿瘤体积×100%。于MRI上测量肿瘤横断面最大径a及垂直径b,计算肿瘤体积,肿瘤体积=(a×b2)/2(mm3)。
1.3.3 病理检查 粒子植入后10、20天,完成MR扫描后每组处死5只动物,取距粒子3~10 mm范围内肿瘤组织,部分以甲醛固定进行HE染色,部分保存于液氮内待检凋亡和免疫指标,并妥善处理粒子。
观察常规HE染色片时,采用放疗反应分级(radiation reaction grade, RRG)标准评价结果:3分,肿瘤细胞完全消退或仅剩少量癌灶;2分,肿瘤组织明显纤维化,仍可见肿瘤细胞存在;1分,可见大量肿瘤细胞,少量或无纤维化。以TUNEL法观察细胞凋亡情况,荧光显微镜下随机观察5~10个视野,计数每个高倍(×400)视野中平均凋亡细胞数量,获得凋亡细胞数百分比即凋亡指数。采用免疫印迹法检测B淋巴细胞瘤-2(B-cell lymphoma-2, Bcl-2)蛋白表达,200倍视野下观察染色强度和染色阳性细胞数量,以胞浆见黄色颗粒为阳性,根据染色强度及阳性细胞百分比计算表达量[4]。
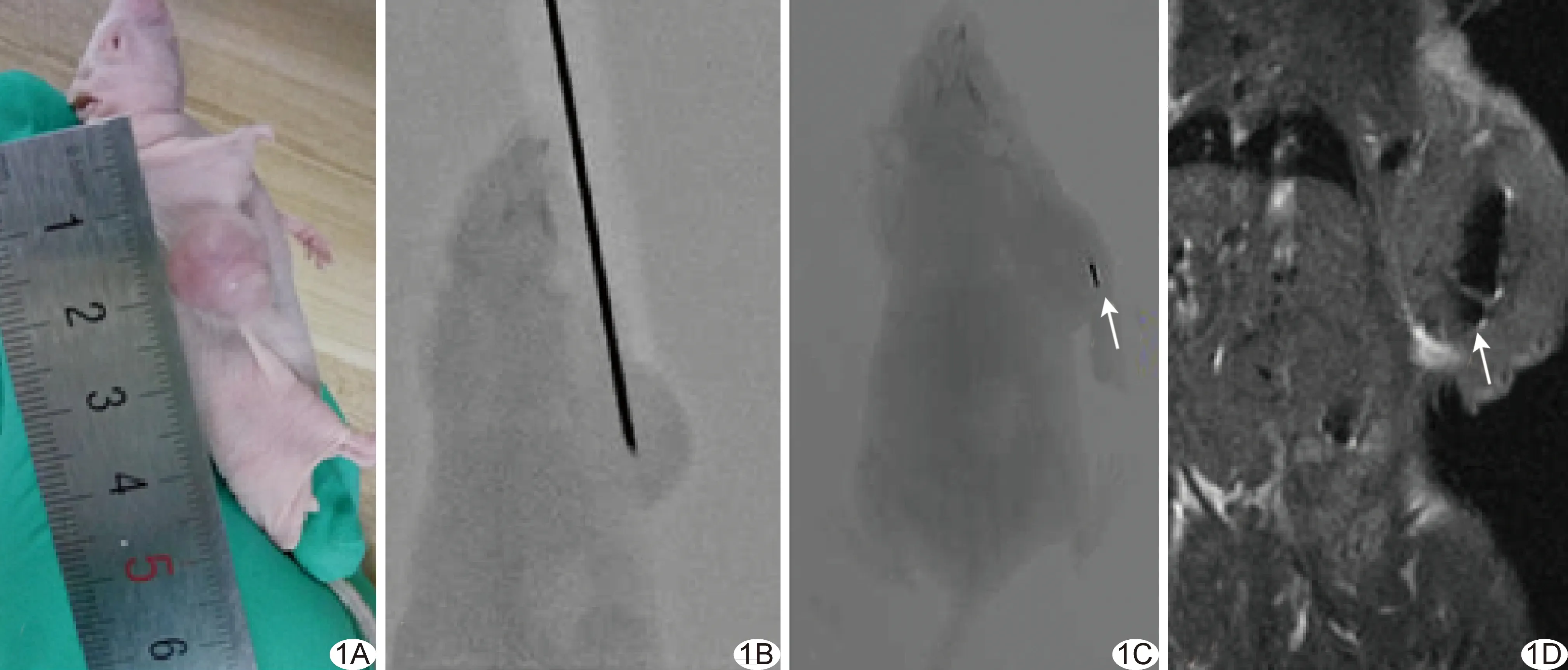
图1 裸鼠移植瘤内125I粒子植入 A.麻醉状态下的荷瘤裸鼠; B.DSA透视下穿刺入肿瘤中心; C.于肿瘤中心植入1枚125I粒子(箭); D.植入粒子(箭)后MRI
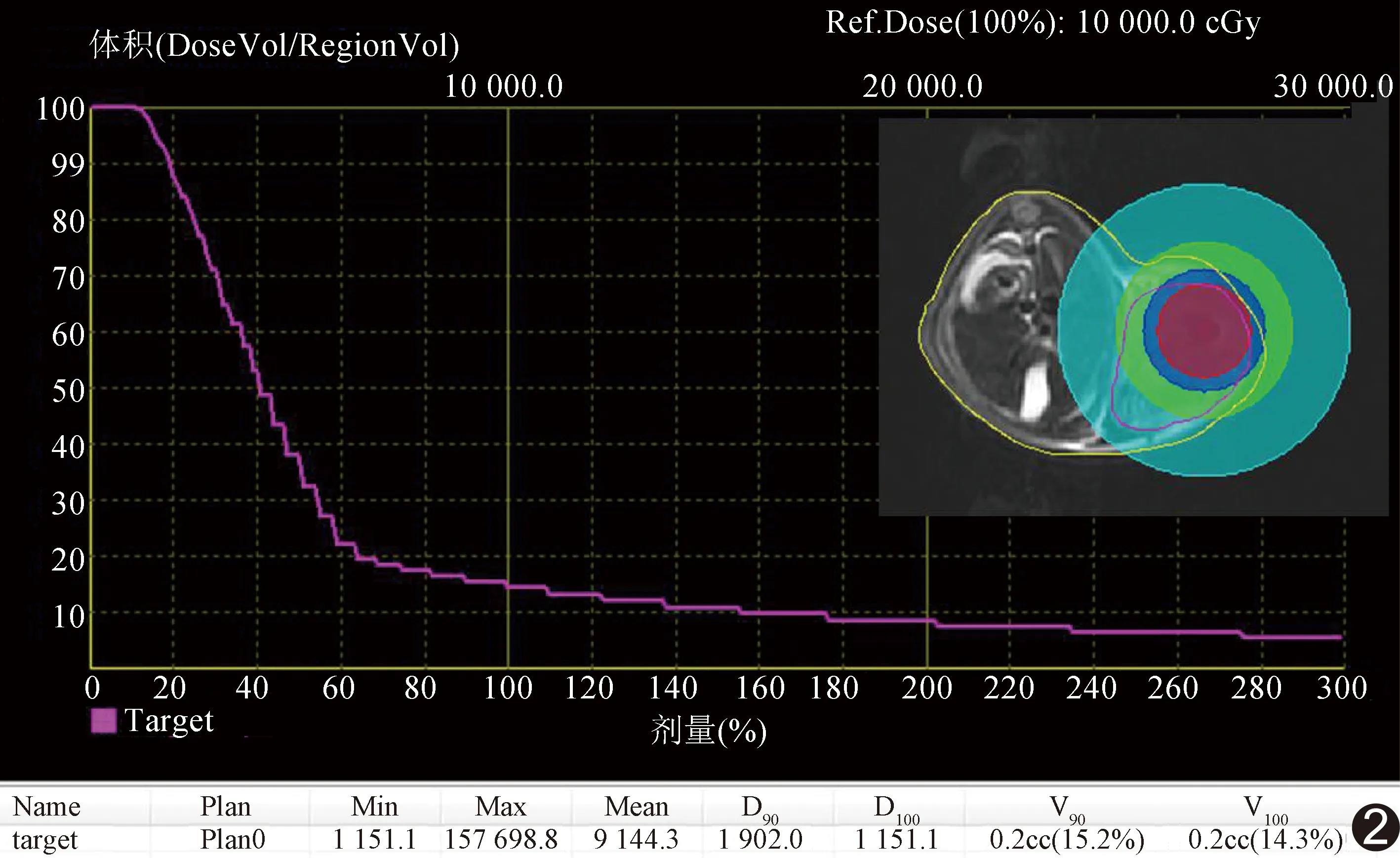
图2 高活度组粒子植入后10天剂量体积直方图,D90为19.02 Gy,红色为100%处方剂量覆盖区域,蓝色为60%处方剂量覆盖区域
1.4 统计学分析 采用SPSS 17.0统计分析软件。计量资料均符合正态分布,以±s表示,多组间比较采用方差分析,两两比较采用LSD-t检验;计数资料比较采用Mann-Whitney检验;相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 D90及IR125I粒子植入后10、20天,高、中、低活度组裸鼠D90及IR均逐渐降低(P均<0.05),各组植入后20天均较植入后10天升高(P均<0.05),见表1、图3。植入后10天(r=0.96)、20天(r=0.93)肿瘤D90与IR均呈正相关(P均<0.05)。
表1 植入125I粒子后10、20天各组裸鼠D90及IR比较(±s)
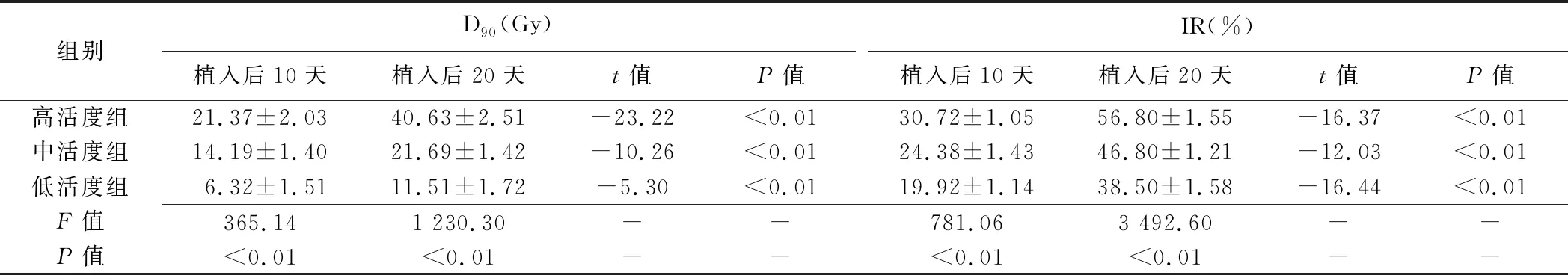
表1 植入125I粒子后10、20天各组裸鼠D90及IR比较(±s)
组别D90(Gy)植入后10天植入后20天t值P值IR(%)植入后10天植入后20天t值P值高活度组21.37±2.0340.63±2.51-23.22<0.0130.72±1.0556.80±1.55-16.37<0.01中活度组14.19±1.4021.69±1.42-10.26<0.0124.38±1.4346.80±1.21-12.03<0.01低活度组6.32±1.5111.51±1.72-5.30<0.0119.92±1.1438.50±1.58-16.44<0.01F值365.141 230.30--781.063 492.60--P值<0.01<0.01--<0.01<0.01--
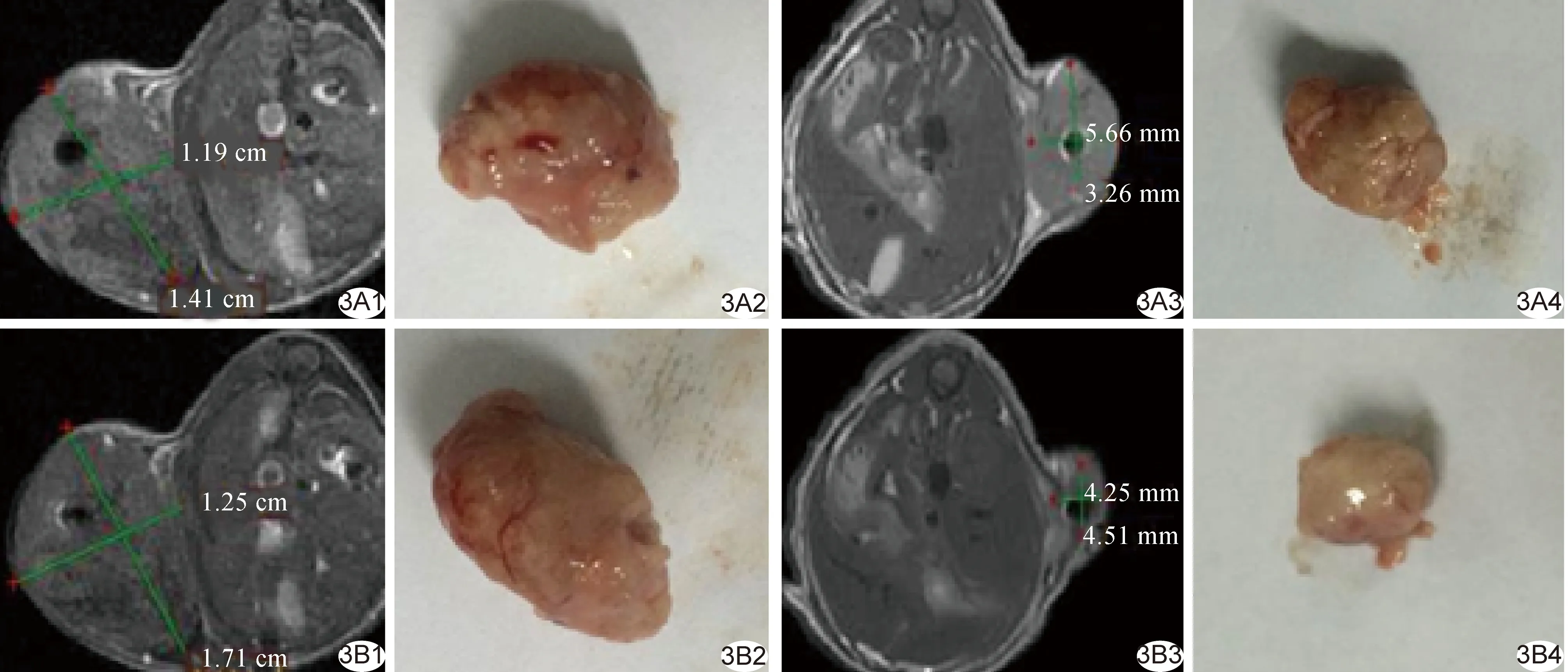
图3 粒子植入后10、20天MRI测量瘤体大小及分离实体瘤所见 A1、A2.分别为对照组术后10天MRI及分离实体瘤; A3、A4.分别为高活度组术后10天MRI及分离实体瘤; B1、B2.分别为对照组术后20天MRI及分离实体瘤; B3、B4.分别为高活度组术后20天MRI及分离实体瘤
2.2 各组HE染色RRG、凋亡指数及Bcl-2蛋白表达 植入125I粒子后10、20天,高、中、低活度组粒子周围5 mm以内肿瘤组织均见明显坏死,粒子活度越大、时间越长,坏死范围越大。各组裸鼠125I粒子植入后10、20天RRG、凋亡指数及Bcl-2蛋白表达差异均有统计学意义(P均<0.01)。高、中、低活度组粒子植入后10、20天RRG分级及凋亡指数逐渐降低,且均高于对照组(P均<0.05);植入后20天RRG、凋亡指数均高于植入后10天(P均<0.05),见表2、图4。高、中、低活度组Bcl-2蛋白表达逐渐增加,且均低于对照组(P均<0.05);3组粒子植入后20天Bcl-2蛋白表达均低于植入后10天(P均<0.05);见表2、图5。
表2 各组HE染色RRG、凋亡指数及Bcl-2蛋白表达比较(±s)
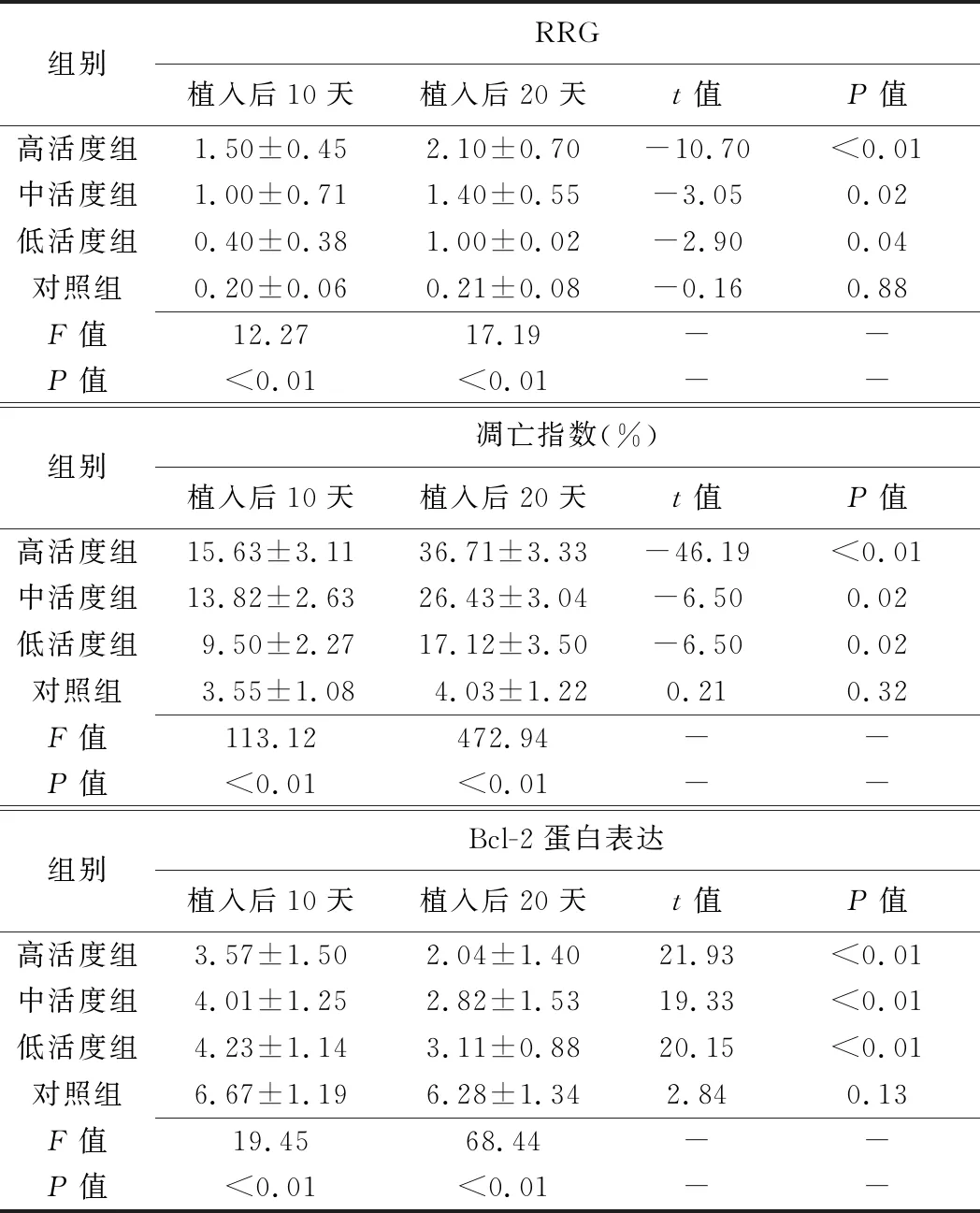
表2 各组HE染色RRG、凋亡指数及Bcl-2蛋白表达比较(±s)
组别RRG 植入后10天植入后20天t值P值高活度组1.50±0.452.10±0.70-10.70<0.01中活度组1.00±0.711.40±0.55-3.050.02低活度组0.40±0.381.00±0.02-2.900.04对照组0.20±0.060.21±0.08-0.160.88F值12.2717.19--P值<0.01<0.01--组别凋亡指数(%)植入后10天植入后20天t值P值高活度组15.63±3.1136.71±3.33-46.19<0.01中活度组13.82±2.6326.43±3.04-6.500.02低活度组 9.50±2.2717.12±3.50-6.500.02对照组 3.55±1.08 4.03±1.220.210.32F值113.12472.94--P值<0.01<0.01--组别Bcl-2蛋白表达植入后10天植入后20天t值P值高活度组3.57±1.502.04±1.4021.93<0.01中活度组4.01±1.252.82±1.5319.33<0.01低活度组4.23±1.143.11±0.8820.15<0.01对照组6.67±1.196.28±1.342.840.13F值19.4568.44--P值<0.01<0.01--
3 讨论
125I辐射可损伤DNA,造成DNA双键断裂或错误复制,破坏肿瘤细胞基因稳定性[5]。既往研究[6-8]分别将放射性粒子植入多种肿瘤模型(胰腺癌、直肠癌及肝癌等)进行IR分析,发现125I局部累积剂量是IR的主要影响因素。本研究结果显示,植入不同活度粒子后,移形细胞瘤裸鼠IR与累积剂量D90之间呈高度正相关,即伴随局部累积剂量增高,肿瘤明显消退,表明125I放射性粒子对于裸鼠人移行细胞癌抑制效果明确,且同期内高活度组较低活度组抑制效率更高。杜明华等[9]以近距离125I照射T739近交系小鼠膀胱低分化移行细胞癌(采用盲穿法在肿瘤内植入1枚125I粒子),植入粒子后20天IR为13.24%;本研究中各组IR均远高于此,差异产生的原因可能为所用细胞系及粒子活度不同,且肿瘤体积测量方法亦不同。
既往多于盲穿下完成粒子植入裸鼠移植瘤。本研究采用DSA引导下植入粒子,尽管透视增加了手术操作时间及X线照射剂量,但粒子分布于肿瘤中心可使剂量学分布更加科学。既往采用游标卡尺测量肿瘤大小,但皮下脂肪、皮肤会影响游标卡尺测量准确性,使用游标卡尺测量时,皮肤与肿瘤的相对位置可能发生变化,导致测量误差。本研究以MRI评价粒子植入后肿瘤体积变化,测量瘤径相对精确,采用(a×b2)/2计算肿瘤体积接近于真实,但操作稍复杂,且费用较高。
本研究IR、HE染色剂及凋亡指数检测结果均显示0.9 mCi125I粒子抑制荷瘤裸鼠肿瘤生长效果最佳,结合既往粒子链剂量学研究[10-11]结果,可以认为高活度粒子能在狭小的阻塞输尿管内发挥更好的近距离放疗作用,且伴随肿瘤回缩,肿瘤与粒子贴合更紧密,局部粒子活度可能高于TPS模拟计算剂量,弥补单粒子链剂量相对较低的缺陷。王娟等[12]则认为尽管高活度粒子能较低活度粒子获得更高的IR,但其剂量落差相对较大,剂量分布不均匀可导致靶区内平均剂量降低。
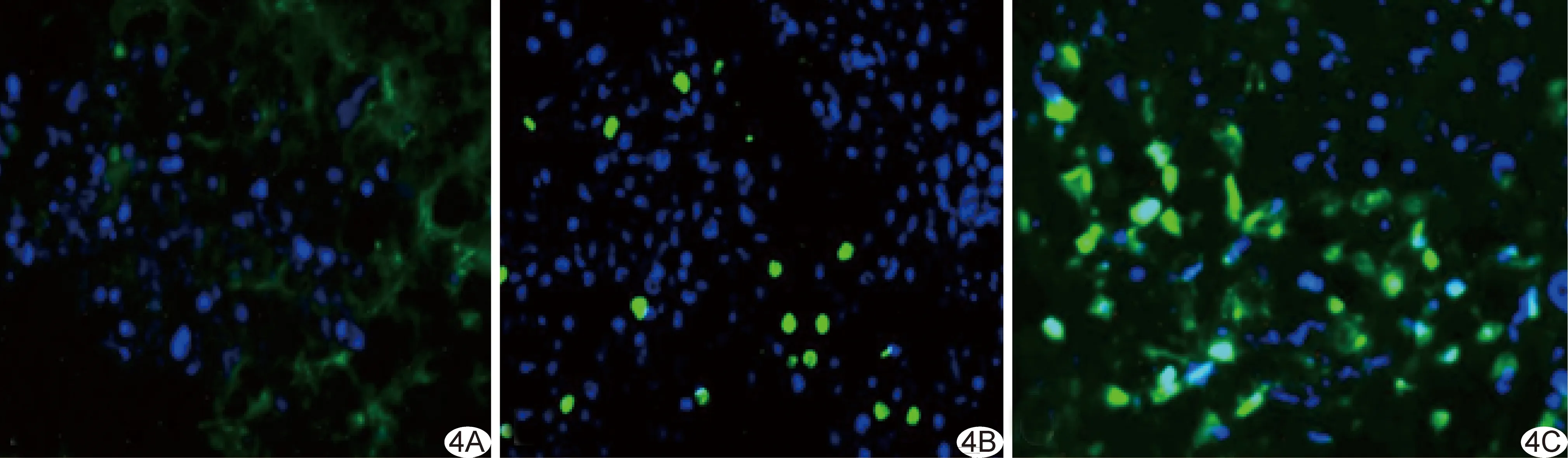
图4 荧光显微镜下所示细胞凋亡情况(TUNEL,×400) A.对照组粒子植入后10天; B、C.中活度组粒子植入后10天(B)、20天(C)
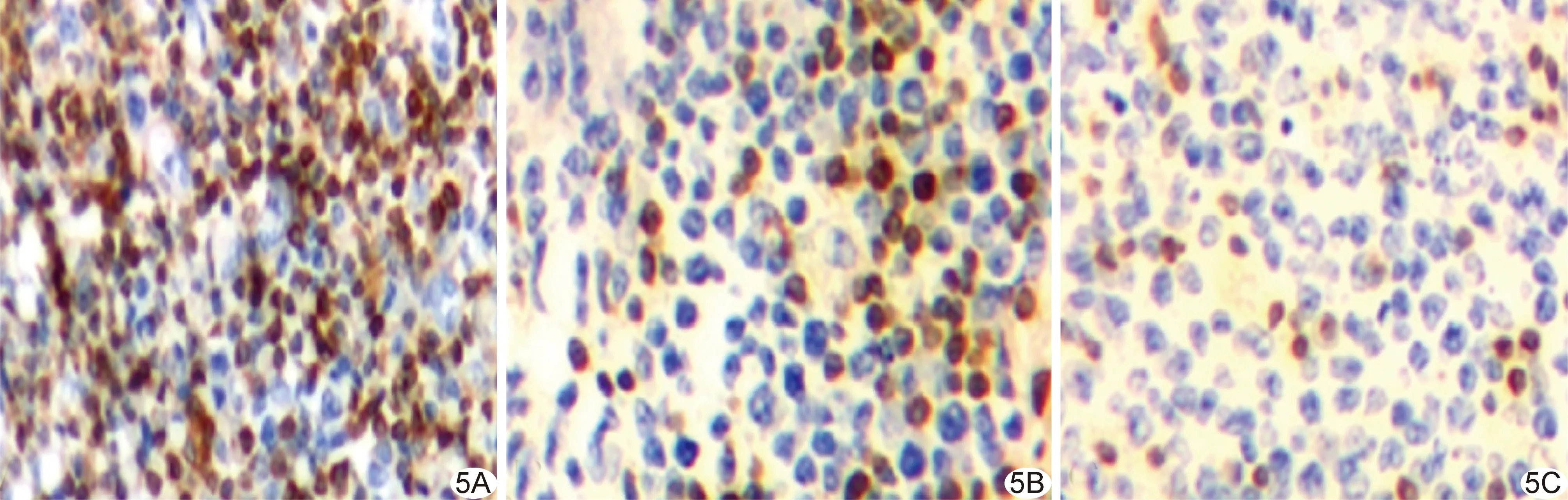
图5 免疫印迹法所示Bcl-2蛋白表达(×200) A.对照组粒子植入后10天; B、C.中活度组粒子植入后10天(B)、20天(C)
Bcl-2蛋白位于线粒体内膜、核膜和内质网,是与凋亡相关基因。本研究高、中、低活度组Bcl-2蛋白表达逐渐降低,植入粒子20天后Bcl-2蛋白表达均低于植入后10天,且均低于对照组,提示Bcl-2介导的细胞凋亡可能是125I粒子治疗肿瘤的主要机制之一。
综上所述,125I放射性粒子对裸鼠人移行细胞癌具有较强抑制作用,且具有剂量及时间正相关效应;抑制凋亡蛋白Bcl-2表达、促进肿瘤细胞凋亡是其作用机制之一。