狐源大肠杆菌中氯霉素类抗生素耐药基因的检测
冯 涛 富景宁 薛 原*
(1.东北林业大学野生动物与自然保护地学院,哈尔滨,150040;2.隆化县农业农村局,承德,068150)
大肠杆菌(Escherichiacoli)广泛存在于人和动物的肠道内,在人畜共患的细菌中十分常见,可以通过粪便造成环境的细菌污染,大肠杆菌通过质粒使其广泛传播,对人类和动物的健康具有潜在的威胁[1]。近几年,狐(Vulpesspp.)的饲养十分普遍,具有较高的经济价值和较大的养殖前景。
氯霉素类药物在临床上较为常用的有氯霉素、甲砜霉素和氟苯尼考,这类药物的抗菌谱广,在体内的分布也很广泛,对大肠杆菌的抑菌效果明显,在兽医的临床用药中占有不可或缺的地位[2]。但是,随着对氯霉素类药物的研究越来越深入,其毒性大,易产生耐药性,并且残留于动物机体内抑制某些蛋白质合成等缺点也逐渐暴露出来,包括中国在内的世界上很多的国家都已经禁止氯霉素和甲砜霉素在兽医临床上的使用[3]。氟苯尼考作为氯霉素的衍生药物,其在一定程度上具有较强的安全性和有效性,其在我国仍然被用作为兽药和添加剂而广泛使用[4]。由于临床使用存在问题,氟苯尼考的耐药性也在逐年上升,对环境造成一定的选择压力。氯霉素类耐药基因中cmlA、cat和floR的研究比较广泛,其中cmlA基因主要依赖外排泵机制使细菌产生耐药性[5],cat基因与氯霉素乙酰转移酶的灭活有关[6],而氟苯尼考的耐药机制的研究主要集中在floR基因上[7]。
本试验检测和分析了东北地区不同狐源养殖场中氯霉素类耐药基因分布情况,根据对氯霉素类耐药性的研究发现,狐源大肠杆菌对氯霉素的耐药率高达67.41%,对氟苯尼考的耐药性也达到了46.43%,因此调查狐源中耐氯霉素类大肠杆菌的分子流行情况,旨在掌握耐药基因的分布情况和流行规律,从而控制耐药性的进一步传播,为氯霉素类药物的合理使用提供理论依据,并对东北地区狐源养殖场的临床用药提供参考。
1 材料与方法
1.1 菌株
大肠杆菌质控菌株(菌株编号为ATCC25922),由中国兽医药品监察所提供;试验菌株于2016—2019年分离自东北不同地区狐养殖场,并分离纯化和鉴定的大肠杆菌224株。
1.2 试剂
10×Buffer、Dntp、Taq酶、DL-2000 Marker、6×Loading Buffer、pMD18-T载体,感受态细胞E.coliDH5α,均由TaKaRa公司提供;质粒小量提取试剂盒、DNA片段凝胶回收试剂盒,均由爱思进生物技术有限责任公司提供。
1.3 耐药基因的检测
PCR扩增的模板为已鉴定的大肠杆菌的质粒和菌液,采用25 μL PCR扩增体系,按照参考文献[8-9]设计引物序列(表1)。PCR扩增体系为94 ℃预变性5 min;94 ℃变性1 min,退火1 min,72 ℃延伸1 min,共30个循环;72 ℃延伸5 min,退火温度见表1。对PCR产物进行琼脂糖凝胶电泳验证,随机选择各个基因的阳性样本进行胶回收,连接到18-T载体上,进行克隆测序后将质粒样本送至吉林库美生物技术有限公司,利用DNASTAR软件分析,与NCBI的数据库进行同源性比较分析。

表1 耐药基因的引物序列
2 结果与分析
2.1 耐药基因检测结果
在224株狐源大肠杆菌中,结果表明cmlA、cat和floR基因扩增均出现阳性,有77.23%的大肠杆菌可以携带氯霉素类耐药基因,扩增片段大小与预期目的片段相符,经测序可得,其同源性均在99%以上(图1,图2,图3)。cmlA基因扩增的阳性例数为73例,阳性率为32.59%;cat基因检出的阳性样本有98例,检出率为43.75%;floR基因中有79例样本被检出,阳性率为35.27%(表2)。分别计算携带单个基因以及多个基因的情况,结果表明在224株狐源大肠杆菌中,只单独携带1种基因的比例占大多数,为47.32%,存在携带2个及3个以上基因的大肠杆菌。

图1 部分cmlA基因PCR产物的电泳图谱Fig.1 The electrophoretogram of portion cmlA 注:M:DL-2000 Marker;1:阴性对照;2—9:部分cmlA基因 Note:M,DL-2000 Marker.1,negative control.2-9,PCR products of cmlA gene
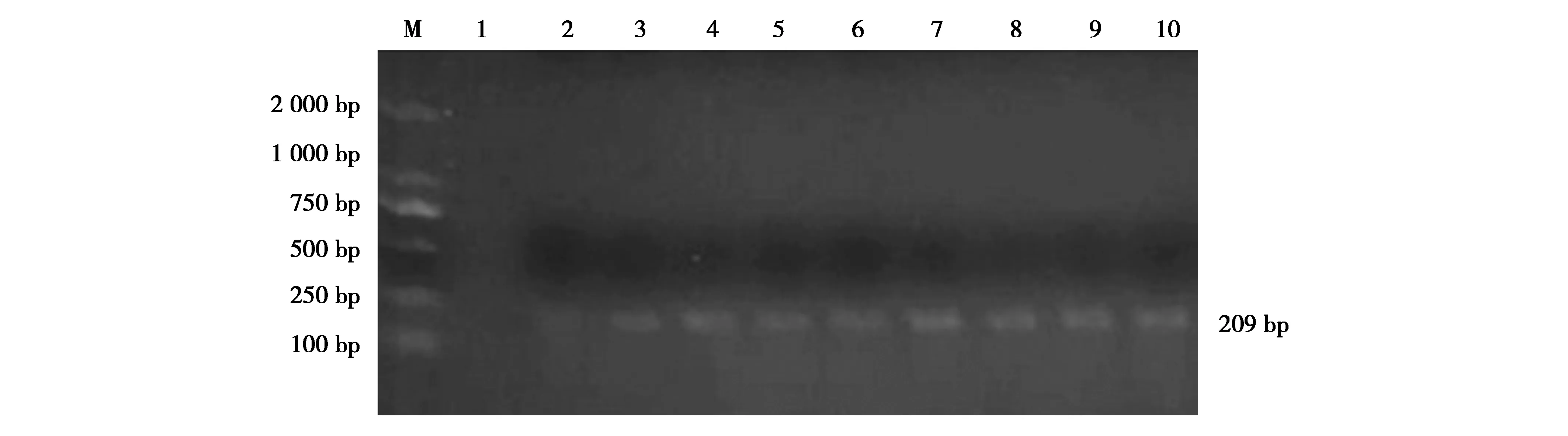
图2 部分cat基因PCR产物的电泳图谱Fig.2 The electrophoretogram of portion cat 注:M:DL-2000 Marker;1:阴性对照;2—10:部分cat基因 Note:M,DL-2000 Marker.1,negative control.2-10,PCR products of cat gene
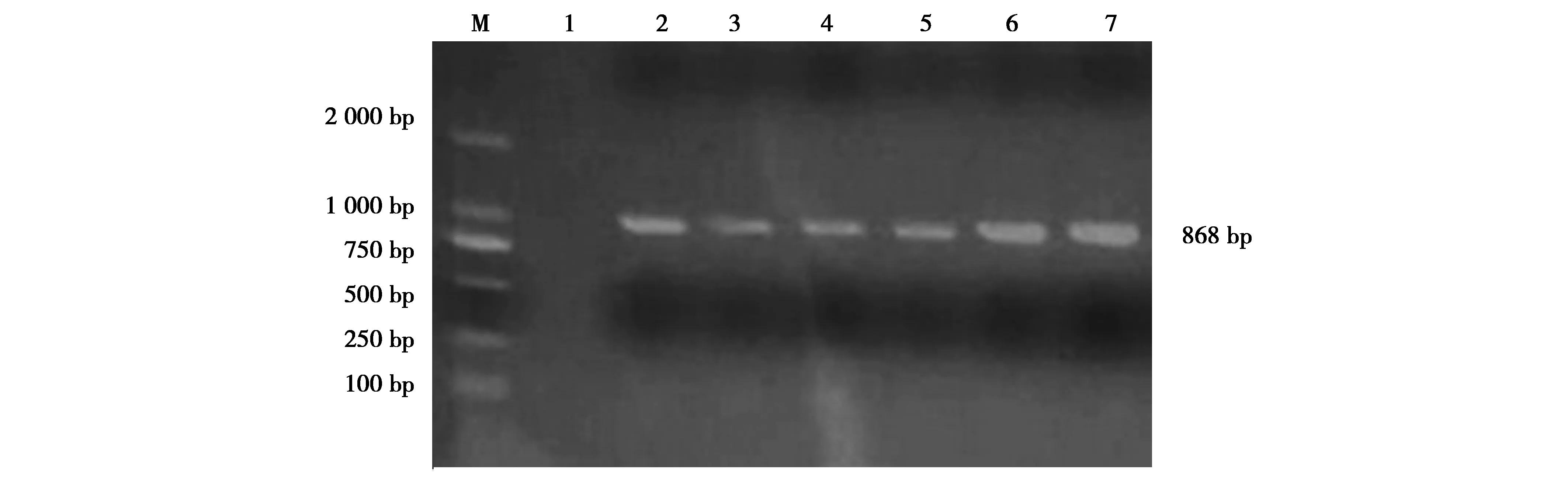
图3 部分floR基因PCR产物的电泳图谱Fig.3 The electrophoretogram of portion floR 注:M:DL-2000 Marker;1:阴性对照;2—7:部分floR基因 Note:M,DL-2000 Marker.1,negative control.2-7,PCR products of floR gene
2.2 耐药基因分布情况
不同地区的分布情况见图4,不同基因在东北不同地区的分布存在差异,各个基因在这3个地区均有检出,其中cmlA和cat基因在各地区的存在较为普遍,并保持较为相似的水平;floR基因的差异十分明显,以辽宁地区的检出率最高。

表2 狐源大肠杆菌产氯霉素类耐药基因携带情况及基因型
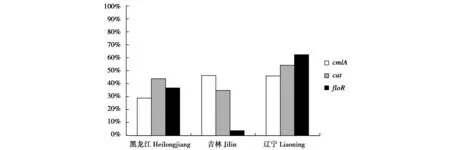
图4 氯霉素类耐药基因的地区分布Fig.4 The distribution of chloramphenicol resistant gene
3 讨论
随着细菌对抗生素的耐药性逐渐升高,多重耐药菌对环境的污染越来越严重,导致在临床治疗上的影响也趋于复杂化,一些日常的疾病也发生治疗失败的情况[10]。抗生素的使用压力加大,在分子水平上,耐药基因可以通过水平传播和垂直传播扩散到不同的个体、种群和环境中,抗生素的使用不当促进了耐药基因的产生和传播。尤其是动物的耐药性和耐药基因可以通过食物链传播到人类中,为人类疾病的治疗同样产生了威胁[11]。
在初期的研究中发现,氯霉素类的耐药性表现出一种较高的水平[12],因此本试验对狐源大肠杆菌进行氯霉素类耐药基因的检测和分析。cmlA基因是通过对外排泵上的蛋白来发挥作用,该蛋白可以保护机体免受氯霉素的影响,还可以改变药物的通路,使细菌产生对氯霉素的耐药性[5]。cat基因表达氯霉素乙酰转移酶从而产生灭活作用,细菌产生耐药性[6]。有173株可携带氯霉素类耐药基因,检出率高达77.23%。其中cat基因的阳性率较高,共有43.75%的大肠杆菌携带该耐药基因,这个结果与赵凤菊等[13]对猪源大肠杆菌氯霉素耐药基因的检测结果相似;cmlA的检出率为32.59%,与Momtaz等[14]对伊朗地区鸡源大肠杆菌的检测结果类似。这两种基因都对氯霉素产生作用,从而使机体产生耐药性。氯霉素虽然在兽药中被禁用了较长的时间,但是其耐药性和耐药基因的携带率仍然存在,可能与氯霉素易残留并且较难降解的特点有关,虽然该类药物已经不再使用,但是环境中存在的污染和繁殖过程中的传播仍然存在,还需要时间来消除它的影响。根据之前对虎源大肠杆菌的研究[3],cmlA和cat基因的检出率已经有所下降。氟苯尼考的耐药性为46.43%,其耐药基因floR存在于质粒中[15],并伴随质粒进行传播,从而使氟苯尼考的耐药性也在逐年上升。本试验中floR基因的阳性率为35.27%,这个结果与刘艳红等[16]对猪源和鸡源的大肠杆菌氟苯尼考耐药基因的研究结果相差较多,这个差异可能跟物种不同有关,在东北地区狐的饲养用药中,对氟苯尼考的使用还较少,但是其耐药性的增长仍然需要关注。只单独携带一种基因的比例占大多数,这个结果表明这3种基因相互之前的影响较小。比较分析不同地区耐药基因的分布情况,不同地区较为优势的基因不同,cmlA和cat基因在各地区都保持较为相似的水平,均表现为50%左右,没有较大的差异起伏;floR基因的地区差异尤为明显,以辽宁地区的检出率最高,表明该基因具有快速扩散和传播的潜力,需要加强监控。
狐的饲养具有较为广泛的发展前景,开展氯霉素类耐药基因的检测和监控,掌握产生氯霉素类药物耐药的主要机制,可以防止多重耐药菌的扩散和爆发,降低对狐的经济价值的影响,对指导养殖场临床用药具有一定的意义。了解耐药基因的流行病学规律,可以有效地降低耐药性及其相应的基因从动物扩散到环境甚至传播到人类的风险。因此,建议加强合理使用抗生素的管理,减少对抗生素产生环境压力,避免甚至消除耐药性的传播和扩散,为新药的研制提供分子基础。
——一道江苏高考题的奥秘解读和拓展

