131例40岁以上绝经前女性的骨密度及骨代谢指标特点分析
招文华 任辉 梁德 叶林强 陈康 沈耿杨 余翔 张志达 余佩沅 江晓兵*
1. 广州中医药大学第一临床医学院,广东 广州 510405 2. 广州中医药大学第一附属医院,广东 广州 510405 3. 东莞市中医院,广东 东莞 523000 4. 深圳平乐骨伤科医院,广东 深圳 518000
骨质疏松症(osteoporosis,OP)是一种好发于绝经后妇女及高龄男女的一种全身性代谢性骨病,其特点是骨量低下、骨微细结构破坏、骨脆性增加及易于骨折[1-2]。2003年至2006年我国的一次流行病学调查显示,50岁以上人群椎体OP总患病率为20.7%,女性则高达27.3%[3]。OP已成为威胁全球女性健康的公共问题。然而,在全球范围内,对于绝经前女性骨密度(bone mineral density,BMD)及骨代谢指标特点的分析仍然较少,尽管绝经前女性的OP发病率较低,但据统计,绝经前OP骨折可增加绝经后骨折风险1. 5~3 倍[4]。因此,对于绝经前女性进行骨密度及骨代谢指标的特点分析对于早期预防OP骨折的发生具有重要意义。本研究针对40岁以上绝经前女性这样一个特殊的群体,分别应用T值和Z值对该群体的骨密度特点进行分析,同时对该人群的骨代谢指标、身高、体重、身体质量指数(body mass index,BMI)进行分析,以期为临床提供一定的借鉴意义。
1 材料和方法
1.1 研究对象
在2017年3月至2017年4月纳入广州市社区OP流行病学调查的1170名女性人群中,选取资料齐全、符合入选标准的131名绝经前女性作为研究对象。入选标准:①年龄大于40周岁;②均为绝经前女性;③明确诊断未妊娠者;④自愿参与本研究并签署知情同意书。排除标准:①患有如恶性肿瘤、糖尿病、甲状腺疾病、甲状旁腺疾病、肾上腺疾病、自身免疫系统性疾病、慢性肝肾疾病等影响骨代谢的疾病;②服用糖皮质激素、抗癫痫药物、来曲唑、免疫抑制剂等影响骨代谢的药物等。所有研究对象在近6个月内未使用过活性维生素D、碳酸钙、双膦酸盐类等抗骨质疏松药物,且近6个月内未进行过雌/雄激素替代疗法。本研究获得广州中医药大学第一附属医院伦理委员会审批通过(审批号:ZYYECK[2016]028)。
1.2 研究方法
1.2.1骨代谢指标检测:研究对象于前一晚10点后禁食,于第二天上午8:00~9:00抽取空腹静脉血,离心后置于-80 ℃冰箱保存。骨代谢指标包括:钙(Ca)、磷(P)、碱性磷酸酶(ALP)、甲状旁腺素(parathyroid hormone,PTH)、骨钙素(osteocalcin,OC)、Ⅰ型前胶原氨基端前肽(procollagen I of aminoterminal propeptide,PINP)、Ⅰ型胶原羧基端肽(carboxyterminal propeptide of type I procollagen,β-CTX)、25羟维生素D[25(OH)D]。采用OCPC比色法检测血钙,磷钼酸紫外法检测血磷,速率法检测ALP,串联质谱法检测25(OH)D,电化学发光法检测PTH、OC、PINP、β-CTX。
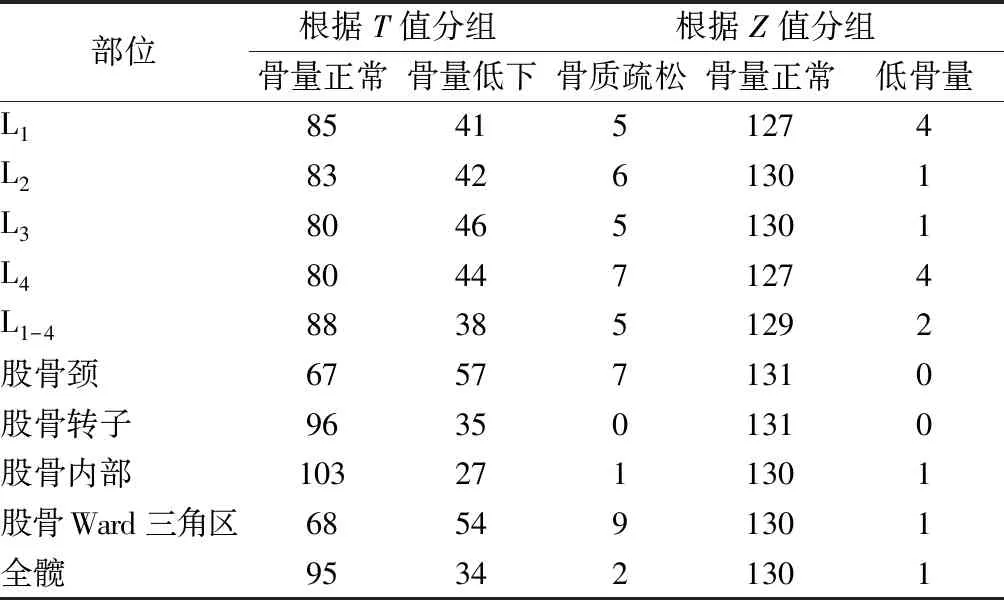
1.2.2骨密度检测:采用双能X线骨密度仪(美国HOLOGIC Wi型,精度≤0.4%)检测受试者正位腰椎1-4(L1-4)及左侧股骨近端的骨密度,所有检测操作均由同一位技术员完成。诊断标准参考2017年中国原发性骨质疏松症诊治指南[5]:基于DXA测量的中轴骨(L1-4、股骨颈或全髋) 骨密度,①对于绝经后女性、50岁及以上男性,建议使用WHO推荐的诊断标准,即T值≤-2.5为骨质疏松,-2.5 2.1一般资料 本研究共纳入131名患者,年龄范围为43~59岁,平均年龄为(50.1±3.5)岁;身高142~166 cm,平均为(156.8±4.7)cm;体重43~87 kg,平均为(59.30±8.20)kg;体重指数17.90~33.15 kg/m2,平均为(24.11±3. 05) kg/m2;腰围63~102 cm,平均为(78.8±7.9)cm;臀围82~114 cm,平均为(94.7±6.3) cm。 对131例患者的L1、L2、L3、L4、L1-4、股骨颈、股骨内部、股骨转子、股骨Ward三角区、全髋的BMD、T值、Z值进行详细描述。见表1。 表1 各部位骨密度、T值、Z值的描述分析 分别应用T值及Z值对131例患者进行组别的划分。首先,对各个部位应用T值划分为3个组别:骨量正常、骨量减少、骨质疏松组,其中L1-4的骨质疏松组为5例,检出率为3.8%;股骨颈部骨质疏松组为7例,检出率为5.3%;全髋的骨质疏松组为2例,检出率1.5%。其次,对各个部位应用Z值划分为两个组别:骨量正常、低骨量组,其中L1-4的低骨量组为2例,检出率为1.5%;股骨颈部低骨量组为0例,检出率为0%;全髋的骨质疏松组为1例,检出率0.76%。见表2。 最后,根据WHO推荐的OP诊断指南,对该人群进行最终的分组。应用T值分组时,本研究采用L1-4整体、左侧股骨颈及左侧髋关节三者中最低的T值来诊断OP,该人群分组为:骨量正常55例(42.0%),骨量减少67例(51.1%),骨质疏松9例(6.9%)。同样地,应用Z值分组时,本研究采用L1-4整体、左侧股骨颈及左侧髋关节三者中最低的Z值来划分骨量正常及低骨量组,该人群分组为:骨量正常组128例(97.7%),低骨量组3例(2.3%)。见表3。由于T值分组的骨质疏松检出率为6.9%,显著高于应用Z值分组后的低骨量检出率2.3%,故后续采用T值分组进行患者一般资料及骨代谢标志物的比较分析。 表 2 分别应用T值及Z值对该人群进行分组(n) 表3 分别应用T值及Z值对该人群的最终分组[n(%)] 3组受试者的身高差异无统计学意义(F=2.683,P>0. 05);3组受试者的体重、BMI、腰围及臀围之间差异均存在统计学意义(F=14.710,P<0.001;F=10.519,P<0.001;F=3.190,P=0.044;F=9.543,P=<0.001)。在体重、BMI、腰围及臀围方面,与骨量正常组相比,骨量减少组差异均具有统计意义(P值均小于0.05),但骨质疏松组差异无统计学意义(P值均大于0.05);与骨量减少组相比,骨质疏松组的体重、BMI、腰围及臀围差异均无统计学意义(P值均大于0.05)。见表4。 表4 3组受试者身高、体重、BMI、腰围、臀围的比较 3组受试者的Ca、P、PTH、β-CTX、25(OH)D水平差异无统计学意义(F=2.224,P=0.112>0.05;F=0.546,P=0.581>0.05;F=0.004,P=0.996>0.05;F=2.200,P=0.115>0.05;F=1.120,P=0.302>0.05),但与骨量正常或骨量减少组相比,骨质疏松组的β-CTX有上升的趋势。3组受试者的ALP、OC、PINP水平差异均有统计学意义(F=6.519,P=0.002<0.05;F=9.684,P<0.001;F=5.558,P=0.005<0.05)。在ALP、OC、PINP水平方面,与骨量正常组或骨量减少组相比,骨质疏松组差异均具有统计意义(P值均小于0.05);与骨量正常组相比,骨量减少组差异均没有无统计学意义(P值均大于0.05)。见表5。 表 5 3组受试者的骨代谢标志物比较Table 5 Comparison of bone metabolism markers among the three groups 绝经前女性人群的OP发病率较低,而对于绝经前不同年龄层人群其发病率也有较大的差异,如西班牙一项针对20~44岁绝经前女性的调查研究中,其OP发病率仅为0.34%[6],而我国上海地区一项针对绝经前女性的调查研究OP的发病率为2.7%[7]。由于女性骨量在30岁前逐渐增加,随后达到峰值,因此,对于绝经前女性,不同年龄层的OP发病率显著不同。除此以外,根据既往研究,绝经前女性发生OP主要与家族史、种族、运动习惯及饮食习惯等密切相关[7],而绝经前女性因患有影响骨代谢的疾病如甲旁腺功能亢进症、恶性肿瘤、糖尿病等或服用影响骨代谢的药物如糖皮质激素、抗癫痫药物等也会导致显著的骨量丢失。 本研究针对的人群是一个特殊的人群,其特点是:①40岁以上(43~59岁),该年龄段为30岁后,峰值骨量已逐渐丢失;②绝经前女性,仍有月经,雌激素对于骨量的保护作用仍然存在,但由于患者年龄为43~59岁,已逐渐进入围绝经期,月经发生紊乱,雌激素的生成与分泌欠规律[8-9]。③本研究设置的排除标准,排除了患有影响骨代谢疾病或服用影响骨代谢药物等继发因素,因此,本研究人群的OP患者为特发性OP患者。 目前国内对绝经前女性人群的特发性OP研究较少,已发表的论文对其诊断标准不一,多倾向于使用T值诊断[7],而根据ISCD(International Society for Clinical Densitometry)标准,指出对于绝经前女性的OP诊断应用Z值[10]。T值=(实测值-同种族同性别正常青年人峰值骨密度) /同种族同性别正常青年人峰值骨密度的标准差,根据T值划分组别,即T值≤-2.5为骨质疏松,-2.5 既往研究中,绝经后OP患者的BMI显著高于骨量正常组[11]。由于绝经后女性雌激素的缺乏,骨代谢处于一种骨吸收及骨形成均增强的高转换状态,且骨吸收大于骨形成,故绝经后女性人群容易发生OP。研究[12]证实,绝经后OP患者骨髓间充质干细胞向脂肪细胞分化活跃,这可能是绝经后OP患者的体重显著高于骨量正常者的一个重要原因。有学者[13]提出,体重增加可以增加对骨的机械应力,刺激骨形成,维持骨重建,这实际上是一种对绝经后OP患者骨量保护的一种代偿机制。体重、BMI、腰围、臀围是衡量肥胖的常用指标,以BMI较为公认。本研究发现,与骨量正常组相比,绝经前女性OP患者的身高、体重、BMI、腰围、臀围差异均无统计意义,而骨量减少组的体重、BMI、腰围、臀围差异均偏低且具有统计意义,这与绝经后骨量减少及OP患者的脂肪率显著高于骨量正常组存在差异,表明绝经前后女性的骨量及脂肪之间的规律、绝经前OP的发生机制与绝经后OP显著不同,可能与雌激素的存在有密切的关联性,但具体机制需要进一步研究。 在对骨量正常、骨量减少、骨质疏松组的骨代谢指标比较分析中,我们发现,3个组之间的Ca、P、25(OH)D、PTH的水平差异无统计学意义,这与国内外研究[7, 14-15]结果一致,提示绝经前女性特发性OP可能与营养元素Ca、P、维生素D缺乏无关,而PTH作为调节体内Ca、P代谢的关键激素,在3组之间差异亦无统计学意义。在对成、破骨指标的比较中,本研究发现,与骨量正常或骨量减少组相比,骨质疏松组的破骨指标β-CTX有上升的趋势,而成骨指标ALP、OC、PINP水平则显著上升,这表明绝经前女性特发性OP的骨代谢处于高转换状态。 本研究的优势是,对研究对象设置了严格的纳入及排除标准,为研究绝经前女性特发性OP提供一定的素材。同时,所有研究对象均进行了全面BMD检查及骨代谢指标检测,分别应用T值及Z值对该人群进行诊断,根据骨质疏松检出率的高低判断其敏感性,具有临床实用意义,同时,应用T值分组对骨代谢指标进行了较充分的分析。本研究仍存在局限性,样本量较小,存在一定的信息偏倚,今后可进一步扩大样本量加以证实。 综上所述,绝经前特发性OP的发病与Ca、P、25(OH)D、PTH无显著关联性,骨代谢的高转换状态可能为其发病的主要机制,遗传性因素可能是发病主要原因。1.3 统计学处理

2 结果
2.2 各部位BMD、T值、Z值的描述分析

2.3 分别应用T值及Z值对该人群骨密度进行分组

2.4 3组受试者身高、体重、BMI、腰围、臀围的比较
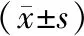
2.5 3组受试者骨代谢标志物的比较
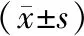
3 讨论

