踝肱指数与糖尿病足细菌感染的相关性分析
杜玉青, 李友山, 杨博华, 杨曦明, 吴 康,周笑允, 陈润铭, 安 琪, 董学宇, 段培航,
糖尿病足(diabetic foot,DF)是指因糖尿病神经病变和血管病变共同作用造成周围小动脉闭塞,或皮肤微血管病变以及细菌感染所引起的足部软组织和骨关节的破坏[1]。有研究报道,下肢缺血程度与DF创面愈合速度呈正相关[2],而踝肱指数(ankle brachial index, ABI)常用于评价周围血管疾病的肢体缺血程度,通过测量足背动脉、胫后动脉或胫前动脉以及肱动脉的收缩压,得到踝部动脉压与肱动脉压之间的比值[3]。目前,国内外对ABI与DF感染间的关系研究较少[4]。笔者回顾性分析我院收治的189例DF创面感染患者的临床资料,分析DF不同ABI分级的感染细菌谱分布及敏感抗生素情况,并探讨其相关性,报告如下。
1 资料与方法
1.1 临床资料 收集2018年1月—2019年1月我院周围血管科收治的189例2型糖尿病患者,其中男94例,女95例;年龄45~85岁,平均(64.6±12.7)岁;糖尿病病程20 d~36年,糖尿病平均病程(17.2±8.8)年;DF病程3 d~7年。根据ABI测量结果分为4组,正常ABI组(0.9<ABI≤ 1.3), 轻 度 ABI组(0.7< ABI≤ 0.9),中 度 ABI组(0.4< ABI≤ 0.7), 重 度 ABI组(ABI≤0.4)[5]。4组患者的性别、年龄、DF病程基线资料差异无统计学意义(P>0.05),糖化血红蛋白、糖尿病病程、吸烟史差异有统计学意义(P< 0.05),见表1。
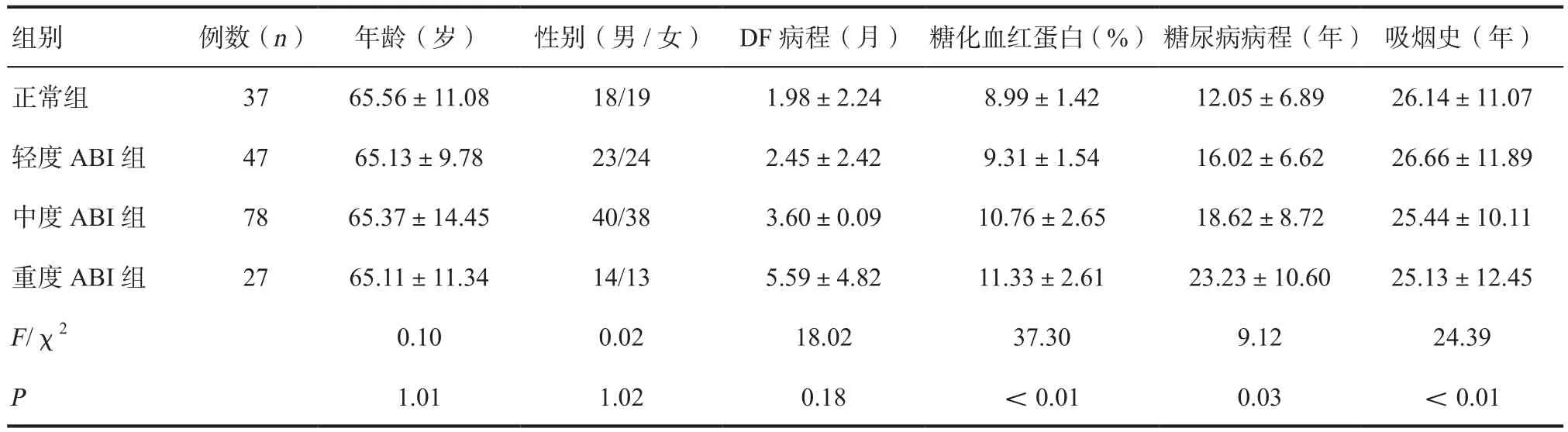
表1 不同ABI分级患者的基本临床资料比较
1.2 入选标准[6]DF诊断符合WHO的诊断标准,出现的足溃疡、渗出及感染都要记录为足病,且溃疡底部分泌物培养病原菌结果阳性。排除标准:(1)1型糖尿病;(2)所有可能非糖尿病性相关的溃疡,如因静脉功能不全、单纯动脉硬化闭塞症、恶性肿瘤长期化疗后等情况。
1.3 DF感染分级 采用美国感染疾病协会关于糖尿病足感染的临床分类指南[7]。DF感染程度的分级如下:无感染(1级):无感染的症状和体征。轻度感染(2级):感染仅累及皮肤和皮下组织,包括以下两个症状即可诊断:(1)DF创面红斑直径大于0.5 cm;(2)皮温升高,伴或不伴有皮色发红;(3)肿胀和硬结明显;(4)溃疡有流脓或者脓性分泌物;(5)糖尿病组创面或者周围触痛或者自觉疼痛明显;(6)无全身炎症反应。中度感染(3级):感染累及更深层组织,包括筋膜炎、骨髓炎、窦道形成、脓毒性关节炎等或者溃疡周围红斑直径>2 cm,无全身感染体征。重度感染(4级):具备以下两种或两种以上征象:体温>38℃或<36℃,心率>90次/min,呼吸>20次/min,白细胞计数<4.0×109/L或>12.0×109/L,中性杆状核粒细胞比例≥10%,二氧化碳分压小于32 mmHg;全身炎症反应明显。
1.4 踝肱指数的测定 采用DF筛查诊断箱中8 mHz双向多普勒血流探测仪测定,测量前先静息10 min,取平卧位,血压感应袖带缠绕于双上臂和双踝关节上端,取收缩压最高值为双侧肱动脉压;双侧胫后动脉或胫前动脉和足背动脉,取收缩压的最高值为双侧的踝动脉压;根据公式(踝肱指数=踝动脉压/肱动脉压)[8],计算出患者ABI,记录并分类入组。
1.5 方法
1.5.1 标本的采集 选用0.9%氯化钠冲洗溃疡面,用无菌拭子接触溃疡创面脓性分泌物较多处,在底部旋转2~3圈沾取脓液或分泌物,封闭保存并及早送检。本研究中无厌氧菌感染的发生,则不对其详述。
1.5.2 病原体培养 严格按照《全国临床检验操作规程》标准以及CLSI-2014年版药敏标准规范化操作和结果[9-10],接种、培养和鉴定DF分泌物的细菌,判读药敏结果。我院检验科采用BD Phoenix 全自动微生物分析仪完成细菌的检验和药敏实验,少数细菌药敏试验采用M-H琼脂K-B法。
1.6 统计学方法 应用SPSS 22.0统计学软件分析临床资料,以例(%)表示计数资料,比较用卡方检验,用均数±标准差表示计量资料,组间比较用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 DF细菌谱分布及差异 本组189例患者共培养出212株细菌(其中23例患者是混合细菌感染),其中82株革兰阳性菌(36.68%),126株革兰阴性菌(59.43%),真菌4株(1.89%)(真菌数量较少,不作为本次研究重点),不同ABI分级患者间的病原菌分布差异有统计学意义(χ2=47.43,P<0.05)。在轻度ABI组、中度ABI组中,DF细菌感染比例增加,具有统计学意义(P<0.05);在正常ABI组、重度ABI组中,DF细菌感染程度无统计学意义(P>0.05)。在不同ABI指数中,革兰阴性为主要致病菌,正常ABI组、轻度ABI组、中度ABI组、重度ABI组革兰阴性感染比例依次为55.85%、79.17%、62.35%、71.88%,见表2。
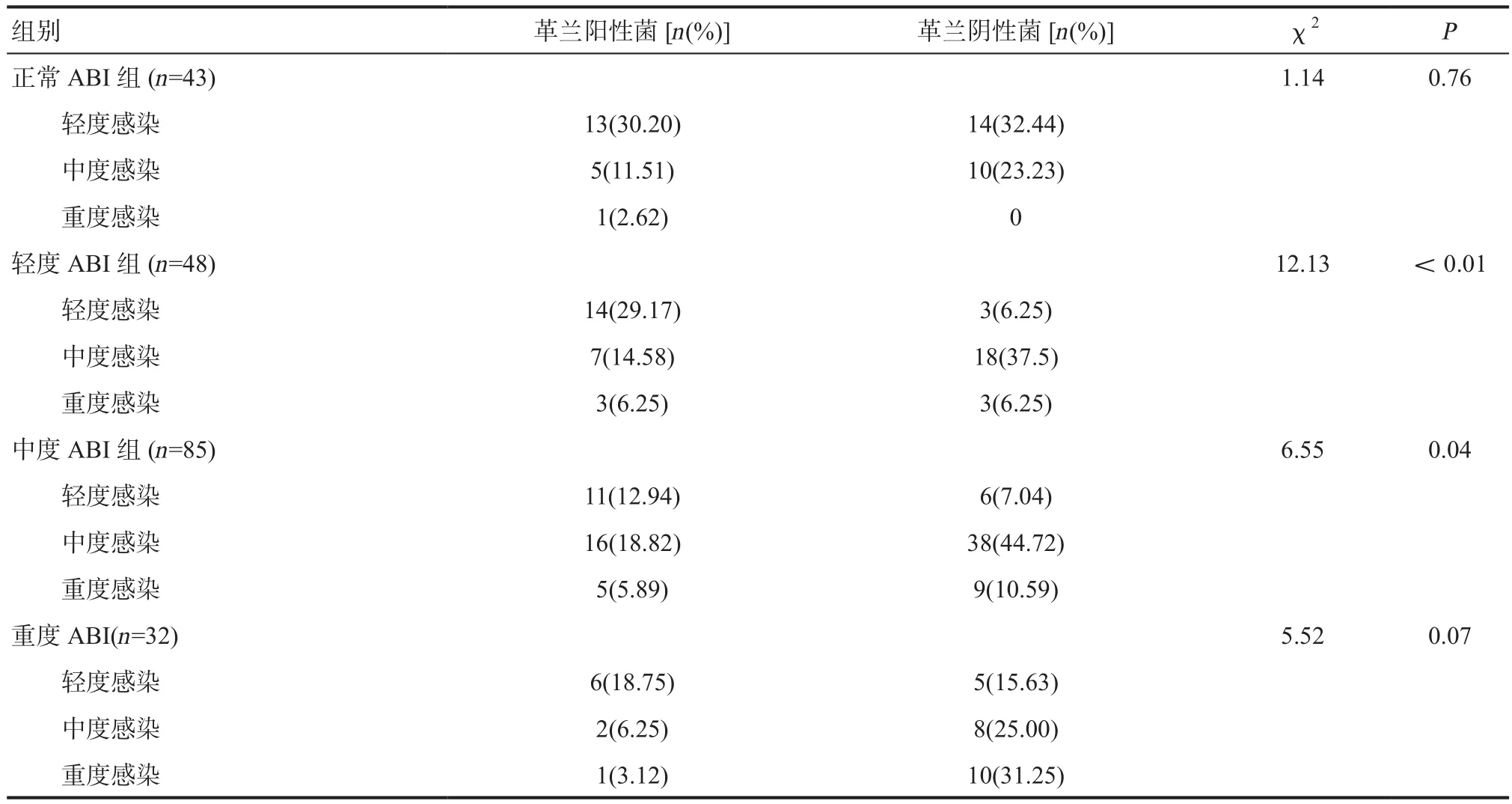
表2 不同感染程度DF病原菌分布
2.2 DF细菌感染与ABI相关性 DF细菌感染程度与ABI呈负相关(r= – 0.707,P<0.05),说明DF细菌感染程度越高,ABI越低。
2.3 DF不同细菌感染类型
2.3.1 革兰阳性菌感染类型 正常ABI组中主要致病菌为表皮葡萄球菌(57.89%)、金色葡萄球菌(21.06%);轻度ABI组中主要致病菌为金色葡萄球菌(50.0%)、表皮葡萄球菌(18.18%);中度ABI组主要致病菌为金色葡萄球菌(46.88%)、表皮葡萄球菌(25.0%);重度ABI组主要致病菌为粪肠球菌(66.67%)、表皮葡萄球菌(22.22%)。分析四组革兰阳性菌感染类型,随着ABI指数降低,粪肠球菌在各组感染比例增多,差异有统计学意义(P< 0.05)。革兰阳性菌主要致病菌依次为金色葡萄球菌(30.48%)、表皮葡萄球菌(37.80%)、粪肠球菌(18.29%)、链球菌(3.66%),见表5。
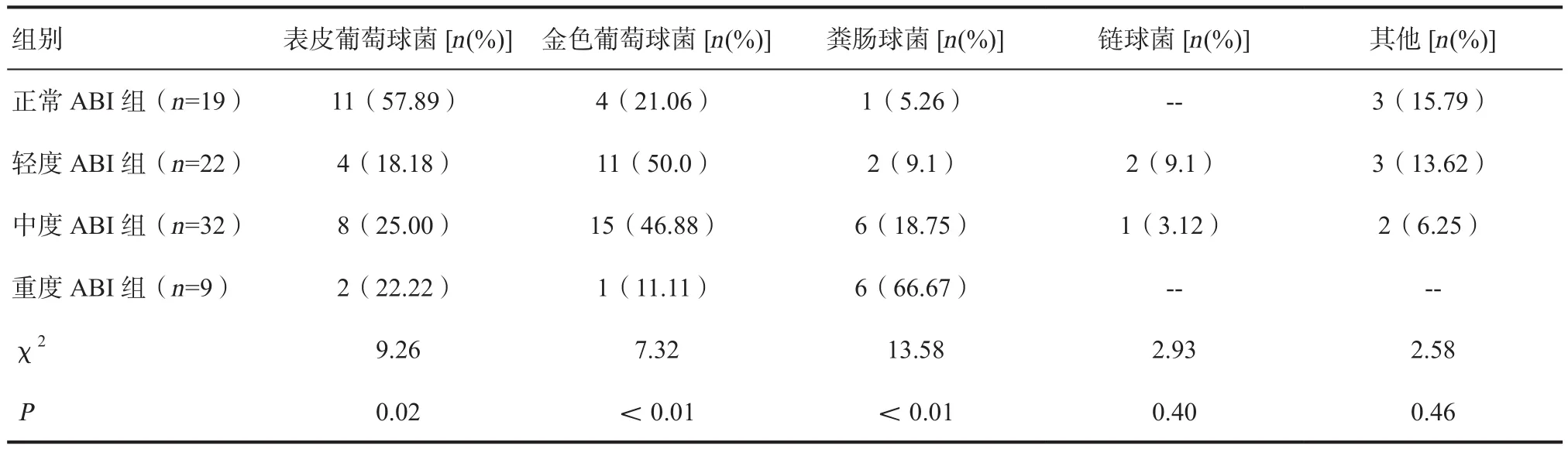
表5 各组革兰阳性菌感染类型及构成比
2.3.2 革兰阴性菌感染类型 正常ABI组中主要致病菌为绿脓假单胞菌(54.18%);轻度ABI组中主要致病菌为绿脓假单胞菌(60.0%)、大肠埃希菌(16.0%)、阴沟肠杆菌(12.0%);中度ABI组主要致病菌为绿脓假单胞菌(39.62%)、佛劳地椐盐酸杆菌(11.33%);重度ABI组主要致病菌为阴沟肠杆菌(43.48%)、绿脓假单胞菌(26.09%)。分析四组革兰阴性感染类型,绿脓假单胞菌感染比例最高(44.0%),但差异无统计学意义(χ2=11.127,P>0.05),其次为阴沟肠杆菌(14.29%),差异有统计学意义(χ2=16.549,P<0.05)。革兰阴性主要致病菌依次为绿脓假单胞菌(41.27%)、阴沟肠杆菌(15.08%)、大肠埃希菌(10.32%)、佛劳地椐盐酸杆菌(9.52%),见表6。
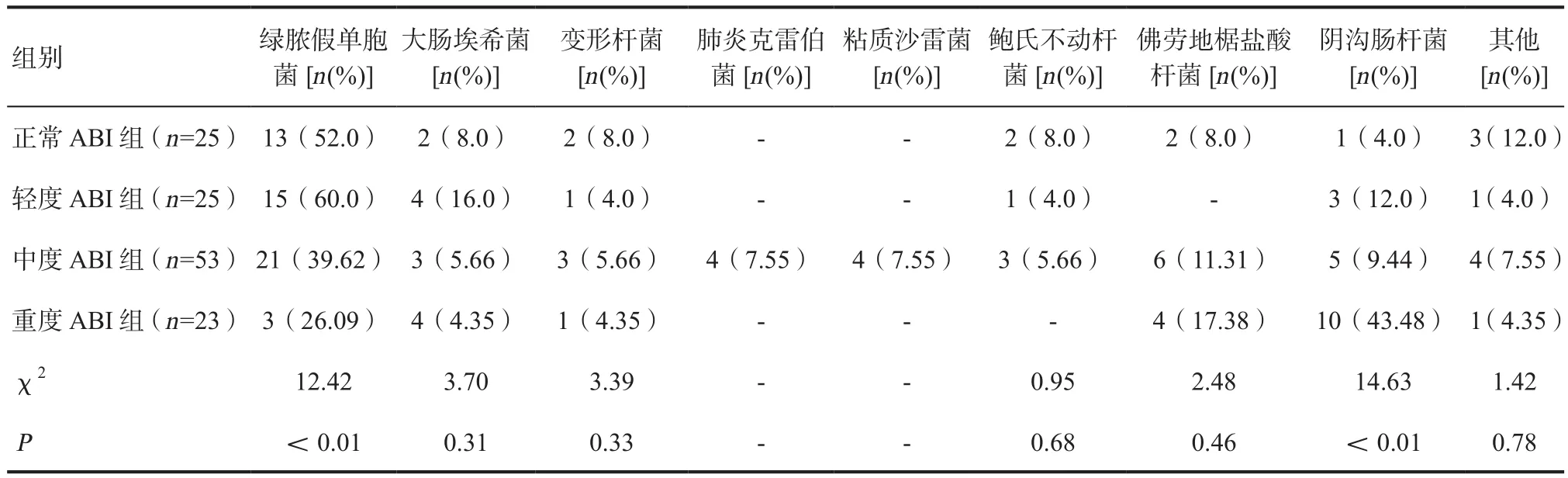
表6 各组革兰阴性感染类型及构成比
2.4 各组不同菌种敏感抗生素分布 在革兰阳性菌中,正常ABI组、轻度ABI组、中度ABI组中表皮葡萄球菌敏感抗生素主要为利奈唑胺(分别为81.81%、100%、87.5%)、四环素(分别为81.81%、100%、87.5%)、万古霉素(分别为81.81%、100%、75.0%),金黄色葡萄球菌敏感抗生素主要为万古霉素(分别为100%、100%、86.67%)、利奈唑胺(分别为100%、90.91%、93.33%)、 利 福 平(分 别 为 100%、81.81%、93.33%);中度ABI组、重度ABI组粪肠球菌敏感抗生素主要为万古霉素(分别为100%、100%)、氨苄西林(分别为100%、100%),见表7。
在革兰阴性菌中,正常ABI组、轻度ABI组、中度ABI组、重度ABI组均有铜绿假单胞菌,其敏感抗生素主要是阿米卡星(分别为100%、80%、80.95%)、环丙沙星(分别为100%、73.3%、80.95%)、 庆大霉素 (分别为 100%、73.3%、801.95%);中度ABI组、重度 ABI均有佛劳地椐盐酸杆菌和阴沟肠杆菌,佛劳地椐盐酸杆菌的敏感抗生素为阿米卡星(分别为100%、75.0%)、美罗培南(分别为100%、75.0%)、头孢吡肟(分别为100%、75.0%)、雅安培南(分别为100%、75.0%)、哌拉西林(分别为100%、75.0%);阴沟肠杆菌较为敏感的抗生素为庆大霉素、阿米卡星、环丙沙星、左旋氧氟沙星、莫西沙星、头孢吡肟、哌拉西林、碳靑霉烯类(均为75.0%、100%),见表8。

表7 革兰阳性菌主要菌种及敏感抗生素种类

表8 革兰阴性主要菌种及敏感抗生素种类

组别 菌种(n=93) 敏感抗生素及敏感性[n(%)]轻度ABI组(n=44) 大肠埃希氏菌(4) 阿米卡星4(100)阿莫西林3(75.00)美罗培南3(75.00)哌拉西林3(75.00)雅安培南3(75.00)左旋氧氟沙星3(75.00)氯霉素4(100)莫西沙星3(75.00)四环素3(75.00)铜绿假单胞菌(15) 庆大霉素11(73.3)阿米卡星12(80)环丙沙星11(73.3)中度ABI组(n=22) 肺炎克雷伯氏菌肺炎亚种(4)左旋氧氟沙星3(75.0)氯霉素3(75.0)环丙沙星3(75.0)美罗培南3(75.0)头孢吡肟3(75.0)头孢噻肟3(75.0)莫西沙星4(100)铜绿假单胞菌(21) 庆大霉素17(80.95)头孢他啶17(80.95)阿米卡星17(80.95)环丙沙星17(80.95)美罗培南17(80.95)左旋氧氟沙星17(80.95)粘质沙雷(4) 复方磺胺4(100)美罗培南4(100)哌拉西林4(100)头孢吡肟4(100)雅安培南4(100)氨曲南4(100)头孢他啶4(100)佛劳地椐盐酸杆菌(6) 庆大霉素6(100)阿米卡星6(100)美罗培南6(100)哌拉西林6(100)头孢吡肟6(100)雅安培南6(100)阴沟肠杆菌(4) 环丙沙星3(75.0)美罗培南3(75.0)哌拉西林3(75.0)雅安培南3(75.0)左旋氧氟沙星3(75.0)莫西沙星3(75.0)头孢他啶3(75.0)阿米卡星3(75.0)变形杆菌(4) 阿米卡星4(100)美罗培南4(100)哌拉西林4(100)雅安培南4(100)重度ABI组(n=14) 大肠埃希氏菌(4) 阿米卡星4(100)左旋氧氟沙星4(100)氯霉素4(100)莫西沙星3(75.00)四环素3(75.00)阿莫西林3(75.00)
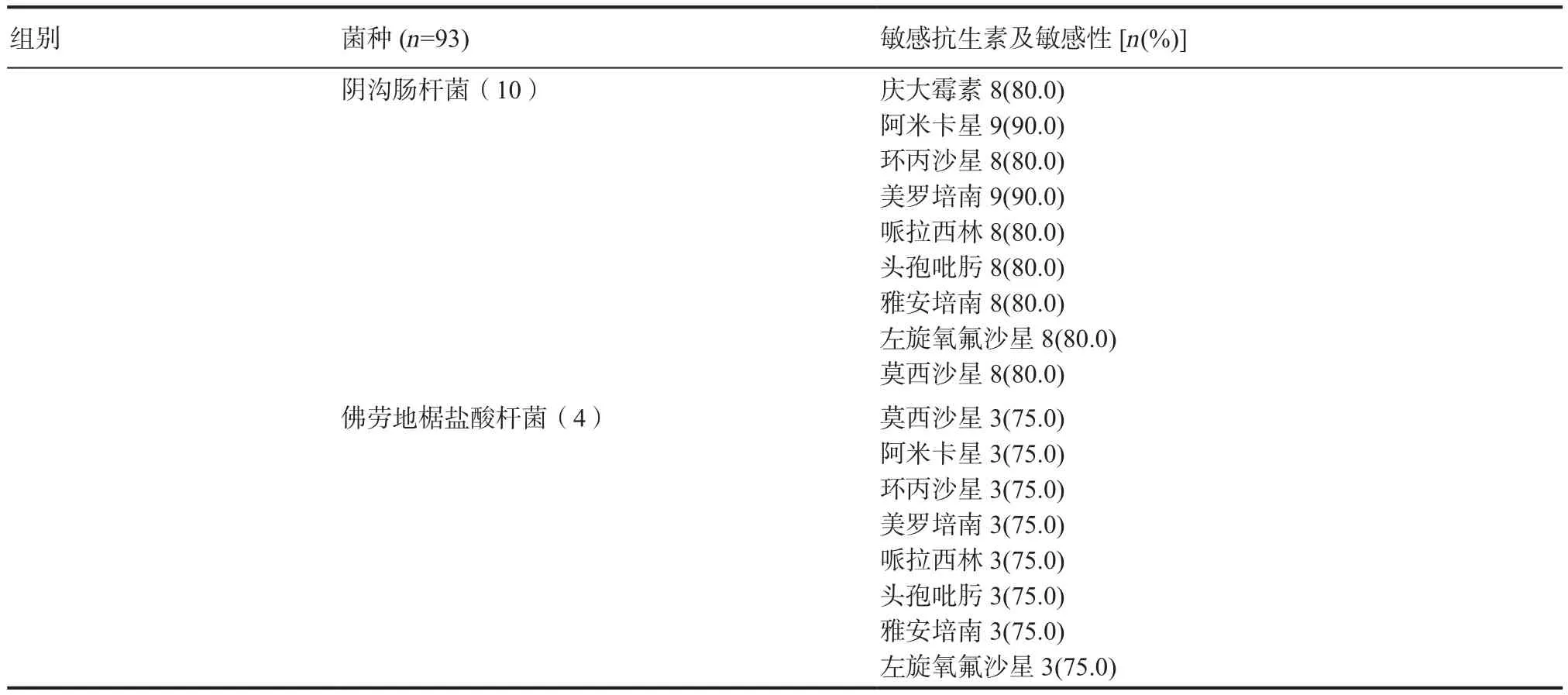
组别 菌种(n=93) 敏感抗生素及敏感性[n(%)]阴沟肠杆菌(10) 庆大霉素8(80.0)阿米卡星9(90.0)环丙沙星8(80.0)美罗培南9(90.0)哌拉西林8(80.0)头孢吡肟8(80.0)雅安培南8(80.0)左旋氧氟沙星8(80.0)莫西沙星8(80.0)佛劳地椐盐酸杆菌(4) 莫西沙星3(75.0)阿米卡星3(75.0)环丙沙星3(75.0)美罗培南3(75.0)哌拉西林3(75.0)头孢吡肟3(75.0)雅安培南3(75.0)左旋氧氟沙星3(75.0)
3 讨论
根据流行病学调查,我国成年人糖尿病前期患病率是11.6%,糖尿病总患病率高达50.1%[11]。DF是糖尿病临床常见的并发症,具有高发病率、高致残率、高费用的特点[12],感染因素会加重DF病情恶化[13]。Park等[14]证实,大部分DF患者可并发不同程度的下肢血管病变,进而引起下肢血管管壁弹性降低,管腔狭窄甚至堵塞等下肢代谢异常,加速感染的发生。研究证实下肢血管病变TASC分级与Taxes感染轻重分级呈正相关[15-16]。
ABI值与血管造影阳性相比,高于或低于正常ABI值对诊断外周动脉疾病的特异性约100%,敏感性为95%左右[17]。李金娟[18]认为若长期糖尿病患者ABI异常,则引起DF的风险概率显著上升。其机制可能为机体高糖状态下,造成血管内细胞处于长期缺氧,血糖波动异常,加上患者不规律服药等诱因,引起血糖控制不佳,最终糖基化终产物(advanced glycation end products,AGE)剧增,出现大量泡沫细胞,血管通透性增加,下肢血管缺氧,血流灌注损伤,下肢或者足部发生缺血性坏死,引发感染,出现DF创面反复感染。肿瘤坏死因子-α(TNF-α)作为一种常见的炎性介质,是炎症反应的始动因子,通过激活血管内皮细胞、中性粒细胞、单核-巨噬细胞产生,介导免疫应答和炎症反应[20],可增强内皮细胞组织因子的合成释放等机制参与炎症反应[21];另外,外周血单核细胞也有特殊的促炎症免疫表型,减少抗炎因子分泌,增加促炎症因子[22];白细胞介素-6(IL-6)可以诱导内皮生长因子的释放,刺激平滑肌细胞显著增生,增加细胞通透性,此外,IL-6也诱导肝脏形成血管紧张素原,引起血管紧张素Ⅱ浓度增加,通过上调NF-κB的表达,造成血管细胞黏附分子-1(vascular cell adhesion molecule 1,VCAM-1)、TNF-α、IL-6等多种炎性因子水平明显增加,最终出现正反循环反馈[23]。研究表明,革兰阴性菌是DF细菌感染的主要菌群[24-25]。根据本研究结果,革兰阴性菌在整个细菌群比例为59.43%,与上述文献报道基本相符。另外发现随着感染程度的加重,革兰阴性菌的数量也在上升,革兰阳性菌数量则呈不稳定趋势分布。阴沟肠杆菌感染比例有明显差异,提示随着ABI指数下降,阴沟肠杆菌比例增高。四组革兰阳性菌主要菌群为粪肠球菌和金葡萄球菌,表明DF感染表皮葡萄球菌和金葡萄球菌与ABI呈负相关。
本次研究选取株数较多的药敏,结果显示缺血程度不同,对其敏感抗生素种类也不同,但仍有共性。在革兰阳性菌中四组分泌物培养中均显示有金黄色葡萄球菌和表皮葡萄球菌,药敏试验表明以上两种细菌敏感抗生素为利福霉菌素类抗生素利福平、糖肽类抗生素万古霉素、唑烷酮类抗生素利奈唑胺;另外,中度ABI组、重度ABI组分泌物培养中均有粪肠球菌,对糖肽类抗生素万古霉素、β-內酰胺类抗生素氨苄西林敏感。这与既往研究有一定的相似性[26],提示万古霉素、利奈唑胺能够在临床中有效控制革兰阳性菌感染。
在革兰阴性菌中四组细菌培养均有铜绿假单胞菌,药敏试验结果表明敏感抗生素主要是氨基糖苷类阿米卡星、庆大霉素,喹诺酮类抗生素环丙沙星,第二代头孢头孢他啶和第四代头孢头孢吡肟以及碳靑霉烯类抗生素雅安培南、美罗培南。中度ABI组、重度ABI组中阴沟肠杆菌和佛劳地椐盐酸杆菌,该两种细菌均对第四代头孢头孢吡肟,氨基糖苷类阿米卡星,碳靑霉烯类雅安培南、美罗培南,青霉素类哌拉西林敏感;另外,阴沟肠杆菌对喹诺酮类左旋氧氟沙星、环丙沙星、莫西沙星抗生素也较为敏感。根据以上结果可以看出各类革兰阴性菌敏感抗生素主要是氨基糖苷类阿米卡星、四代头孢头孢他啶、碳靑霉烯类抗生素雅安培南、美罗培南、喹诺酮类。笔者认为临床中DF局部分泌物培养结果未回报前可优先考虑上述药物。而常翔等[26]表明青霉素是DF致病细菌的首选药物,与本药敏结果有所偏差,推测可能与DF患者长期广泛应用青霉素抗感染治疗而出现耐药菌关系密切。
因样本数量较小,结果分析有一定的偏差,但仍对临床抗生素的敏感性选择应用有一定的借鉴意义。ABI是临床外周血管常用的检测手段,如果出现血管钙化、神经病变以及感染时,会产生假阴性,仍具有筛查和预测DF发生发展的临床实际价值[27]。本结果表明ABI与细菌感染类型有一定相关性,但抗生素的敏感种类与ABI无关。因此,在抗感染治疗DF过程中,应反复进行分泌物的细菌检测,针对药敏实验结果合理选择抗生素。

