白冠长尾雉源金黄色葡萄球菌的分离鉴定与敏感抗菌药物的筛选
王光锋 李 舫
(山东畜牧兽医职业学院,潍坊,261061)
金黄色葡萄球菌(Staphylococcusaureus)隶属于葡萄球菌属,是革兰氏阳性菌代表,大部分金黄色葡萄球菌可产生肠毒素(staphylococcal enterotoxins,SEs)、杀白细胞素和剥脱毒素等毒性蛋白[1],进而引起食物中毒、蜂窝织炎、肠炎、败血症、过敏性疾病及自身免疫性疾病等[2],还可以引起鸡、鸭、鹅、猪、牛、兔等多种家禽、家畜发病。家禽感染主要表现为关节炎、腱鞘炎、脚垫肿、脐炎和葡萄球菌性败血症[3-4]等。该菌在自然界分布广泛,一年四季均可发生,为临床重要的人兽共患病病原菌。
白冠长尾雉(Syrmaticusreevesii)属于鸡形目(Galliformes),雉科(Phasianidae),是中国特产珍禽,属国家Ⅱ级保护动物。目前,国内关于白冠长尾雉的研究主要集中在种群数量调查、人工饲养繁殖、生理生化习性以及生态学等方面[5],关于白冠长尾雉疾病防治的研究较少。2019年5月,山东潍坊某动物园的白冠长尾雉发生一种急性疾病,病雉食欲下降、精神沉郁、关节肿胀、跛行,眼睑有脓性分泌物。剖检可见肝脏肿大,有黄白色点状坏死灶;脾脏肿大,呈紫红色;关节有胶胨样渗出物。本试验从送检白冠长尾雉病死病料中分离到1株细菌,通过细菌学检验方法鉴定为金黄色葡萄球菌,筛选了敏感药物,为该病的防治提供了依据。
1 材料和方法
1.1 病料来源
无菌采集动物园病死白冠长尾雉的肝脏、关节渗出液等组织。
1.2 主要试剂
脑心浸出液(BHI)液体培养基、普通营养琼脂、Baird-Parker琼脂(BP)、革兰氏染液购自青岛海博生物技术有限公司;CM304冻干兔血浆购自北京陆桥技术有限责任公司;药敏试纸片、微量生化发酵管购自杭州滨和微生物试剂有限公司;细菌基因组DNA提取试剂盒购自杭州昊鑫生物科技股份有限公司;PCR试剂盒购自天根生化科技(北京)有限公司;其他试剂均为国产分析纯。
1.3 细菌的分离与培养
将无菌采集的肝脏和关节渗出液病料,划线接种于营养琼脂上,37 ℃倒置培养18—24 h,观察菌落形态,挑取单个优势菌落,进行细菌的纯化。取典型菌落接种鉴别培养基Baird-Parker琼脂,37 ℃培养24 h,观察细菌的生长特征。
1.4 细菌形态学镜检
将纯化的细菌培养后,挑取单菌落,制备标本片进行革兰氏染色,镜检观察细菌形态。
1.5 细菌生化鉴定
将初步鉴定为金黄色葡萄球菌的菌株,接种于普通营养琼脂37 ℃培养24 h,进行生化鉴定和血浆凝固酶试验。血浆凝固酶的检测采用兔血浆凝固法,操作方法如下:将分离菌接种至含BHI培养基的试管中37 ℃培养16 h,用生理盐水将冻干兔血浆1∶4稀释,取0.5 mL稀释后的兔血浆加入小试管中,再加0.3 mL上述培养的细菌液,两者混合均匀后置37 ℃恒温培养箱内,每间隔0.5 h观察1次结果。若6 h内小试管中兔血浆和细菌培养物出现凝固或凝固体积大于原体积的一半,则判定为血浆凝固酶阳性[6-7]。同时做已知样品的阳性、阴性对照。
1.6 16S rRNA基因检测
根据细菌基因组DNA提取试剂盒说明提取分离菌的基因组DNA。采用已报道的通用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′、1492R:5′-GGYTACCTTGTTACGACTT-3′,对分离菌株16S rRNA基因进行扩增,预期扩增DNA片段大小为1 504 bp。PCR反应用30 μL反应体系,制备好的细菌基因组DNA 2 μL,上、下游引物(10 μmol/L)各1 μL,2×PCR Magic Mix 3.0 15 μL,灭菌水11 μL,瞬时离心混匀。反应参数:94 ℃预变性5 min,94 ℃变性45 s、55 ℃变性45 s、72 ℃延伸60 s,35个循环,最后72 ℃延伸7 min。用1%琼脂糖凝胶电泳检测结果并将PCR产物送上海生工生物工程有限公司进行测序,测序结果在GenBank中进行BLAST分析。
1.7 致病性试验
将20只健康成年鸡(Gallusgallus)随机分为2组,试验组每只鸡皮下接种1 mL培养至15 h的分离菌株肉汤培养物(用生理盐水调到1×108cfu/mL);对照组每只接种1 mL的生理盐水。连续观察7 d,每天记录发病死亡情况,死亡鸡剖检并进行细菌的分离。
1.8 药物敏感性试验
取纯培养的新鲜菌液接种平板,每个平板接种50 μL,用灭菌L棒均匀涂布,用无菌镊子夹取各种抗菌药物纸片贴在培养基表面,每个平板贴7张药敏纸片,每张纸片间距不少于20 mm,纸片中心距平皿边缘不少于15 mm,贴好后倒置于37 ℃温箱培养24 h,观察结果。
2 结 果
2.1 细菌分离培养镜检结果
病雉肝脏、关节渗出液病料接种营养琼脂平板上均形成中等大小,表面光滑,边缘整齐,初呈灰白色,继而为金黄色不透明的菌落。在Baird-parker琼脂上形成圆形、光滑湿润、灰黑色的菌落,菌落周围有一混浊带,外层有一透明圈。镜检可见单个、成双、短链或堆状的蓝紫色球状细菌。
2.2 细菌生化试验结果
结果表明分离菌株能分解乳糖、葡萄糖、麦芽糖、蔗糖、甘露醇,甲基红试验阳性,V-P试验阴性,还原硝酸盐,不产生靛基质,H2S试验阴性,可产生血浆凝固酶,与报道的金黄色葡萄球菌的生化特性一致[8]。
2.3 致病性试验结果
实验组接种细菌后24 h出现精神沉郁、食欲下降,接种部位皮肤破溃、关节肿胀,72 h 开始死亡,接种后7 d试验鸡发病率为100%(10/10),死亡率为70%(7/10)。死亡鸡剖检病变主要为肝、脾出血,从病变组织分离到细菌,经鉴定为金黄色葡萄球菌。对照组无明显症状。
2.4 PCR检测结果
分离菌株基因组DNA利用16S rRNA通用引物进行PCR扩增,获得大小约为1 500 bp的目的片段,与预期片段大小相符(图1)。测序结果在GenBank进行Blast比对,与其同源性最高的均为金黄色葡萄球菌各株系的16S rRNA序列,同源性达到99.2%以上,进一步证实分离菌株为金黄色葡萄球菌。

图1 分离菌株PCR鉴定Fig.1 PCR identification of the isolated strain 注:M:DNA标准DL2000;1:分离菌株的PCR扩增产物 Note:M,DNA ladder marker DL2000.1,PCR amplification product of isolated strain
2.5 药敏试验结果
药敏试验结果显示,分离菌株对米诺环素、大观霉素、万古霉素、苯唑西林、哌拉西林、妥布霉素、头孢类药物等15种药物敏感;对卡那霉素、氨苄西林、四环素、左氟沙星、链霉素、庆大霉素6种药物中介;对青霉素、环丙沙星、氨曲南等11种药物耐药(表1)。
3 讨 论
白冠长尾雉数量稀少,为全球性易危物种。为了保护这一物种,国内学者已经对其生态学、行为学等方面进行了深入研究[9],但关于其疾病防治,目前只有白冠长尾雉感染鸡异刺线虫(Heterakisgallinae)、大肠杆菌(Escherichiacoli)、巴氏杆菌(Pasteurellamultocida)等的报道[10-12]。本试验从动物园发病的白冠长尾雉肝脏、关节渗出液病料中分离到1株细菌,经细菌分离培养、形态镜检、生化试验、16S rRNA序列分析鉴定为金黄色葡萄球菌。通过致病性试验,证实分离菌对健康成年鸡有较强的致病作用,并从人工感染的鸡体内再次分离到金黄色葡萄球菌,证实该动物园白冠长尾雉发病是由金黄色葡萄球菌感染所致,为国内首次报道。
金黄色葡萄球菌是多种动物的病原菌,该菌抗原结构复杂,可以通过产生水解酶(β-内酰胺酶)灭活抗生素,也可以通过改变药物作用的靶位结构,降低抗生素的敏感性[13]。本文药敏试验结果显示,分离菌株对米诺环素、大观霉素、头孢类药物等15种药物敏感;对卡那霉素、氨苄西林、四环素、左氟沙星、链霉素、庆大霉素6种药物中介;对青霉素、环丙沙星、氨曲南等11种药物耐药,说明该分离株耐药性已较严重。所以当动物发生该病时,应通过药敏试验选择敏感有效的药物,合理使用,以提高治疗疗效。
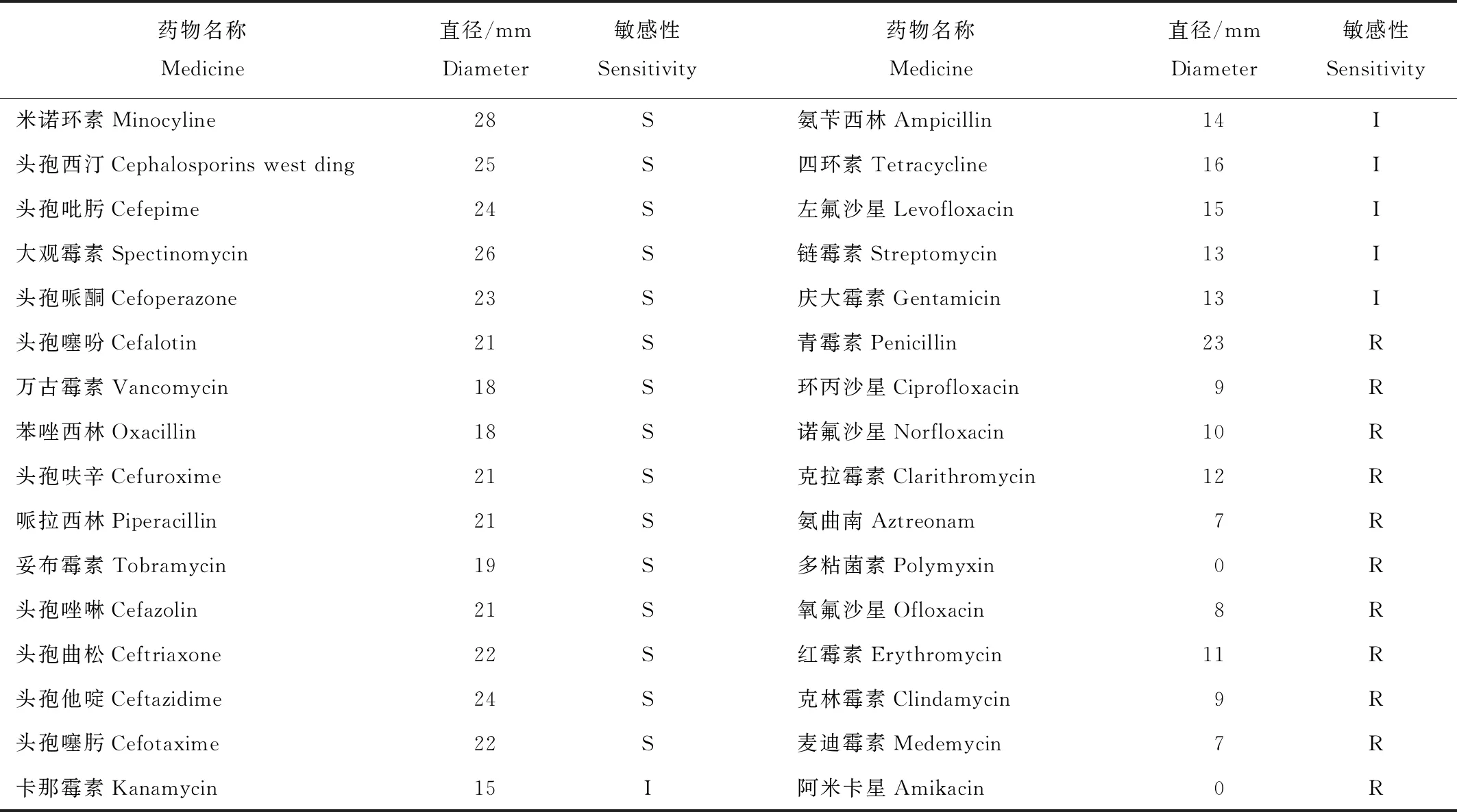
表1 分离菌株药敏试验结果
金黄色葡萄球菌对外界环境抵抗力较强,常因气候突变、皮肤伤口感染、驱赶或注射疫苗等应激因素影响,引起动物发病。所以动物园要加强珍禽饲养区的管理,及时清理粪便、清洁用具,对饲养工具定期消毒,搞好环境卫生,以降低葡萄球菌病的发生。

