基于非靶向代谢组学的大熊猫主食竹代谢产物分析
吴海兰 潘 欣* 余中亮 何永果 李才武 邹立扣 黄 炎 张和民 刘春华 何 鸣
(1.成都理工大学旅游与城乡规划学院,成都,610059;2.中国大熊猫保护研究中心,都江堰,611830;3.四川农业大学资源学院,成都,611130)
大熊猫(Ailuropodamelanoleuca)作为我国“国宝”级的珍稀濒危物种,主要栖息于中国四川、甘肃和陕西的部分山区,截至2013年底,野生大熊猫种群数量约1 864只,2019年底圈养大熊猫达到了600余只。竹类作为大熊猫摄取营养物质的主要食物来源,主要包括竹叶、竹笋以及竹茎。由于大熊猫保留了食肉动物消化系统特征,而竹类纤维素较高,这使得大熊猫对其具有较低的消化率。为维持机体生长发育所需的能量和营养,野生大熊猫会随着季节不同而采食竹子的不同部位[1-3]。竹类中的有机化合物以及营养物质是大熊猫生长发育的物质基础,因此,对大熊猫主食竹的研究至关重要[4-5]。
代谢组学是对有机体代谢物进行定量分析,并寻找代谢物与生理和病理变化相对关系的研究。按研究的目的,代谢组学又可分为靶向和非靶向,其中非靶向代谢组学能从整体反映代谢物的变化,全面地挖掘小分子代谢物,有利于发现新的代谢物和新的代谢通路[6]。Jensen等[7]通过非靶向代谢组学分析激酶抑制剂索拉非尼对心脏代谢存在的影响,研究证明预防的干预措施可有助于减轻索拉非尼引起的心脏损伤。李鑫磊等[8]探究白茶的代谢物特征及其形成的加工学原理,利用非靶向代谢组学将白茶与绿茶、乌龙茶和红茶代谢产物特征进行比较,结果表明白茶中大部分黄酮醇或黄酮糖苷类物质显著高于其他茶类。
近年来,越来越多研究关注于大熊猫主食竹的营养成分等分析,如主食竹中氨基酸含量及其相互间比例的分析[9],主食竹中有机养分分析[10]以及主食竹不同部位的营养价值比较[11]等。但鲜有主食竹代谢物产物差异性分析,鉴于此,本文采用LC-MS技术,分析竹子不同部位的差异性,鉴定竹子不同部位显著差异成分,为研究大熊猫对主食竹不同部位的选择提供参考依据。
1 材料与方法
1.1 试验样品
收集圈养大熊猫3种主食竹,包括苦竹(Pleioblastusamarus)、方竹(Chimonobambusaquadrangularis)、刺竹子(Chimonobambusapachystachys),共63个样品,包括竹笋、竹叶和竹杆样品各21个。
1.2 仪器与设备
超高效液相色谱-双分压线性阱-静电场轨道阱串联质谱仪(UHPLC-LTQ Orbitrap,赛默飞世尔科技公司)、恒温数控超声波清洗器(KQ-300GDV,昆山超声仪器公司)、纯水系统(Milli-QAdvantageA10,德国Merck Millipore公司)、冷冻干燥机(7754070,美国LABCONCO公司)、精密天平(MC京制00000246,德国Sartorius公司)、台式高速冷冻离心机(5430R,德国Eppendorf公司)和涡旋振荡器(G560E,美国Scientific Industries公司)。
1.3 前处理方法
称取100 mg样本,加入20 μL内标(L-2-氯苯丙氨酸,0.3 mg/mL,甲醇配置)和0.6 mL的甲醇∶水(v∶v=7∶3);在-20 ℃放置2 min预冷,加入研磨机(60 Hz,2 min);超声取30 min;-20 ℃静置20 min;离心15 min(13 000 rpm,4 ℃);取200 μL上清装入带内衬管的LC-MS进样小瓶中。
1.4 色谱条件
色谱条件为:色谱柱为 BEH C18 柱(100 mm × 2.1 mm i.d.,1.7 μm;Waters,Milford,USA);正离子模式:流动相A为水(含0.1%甲酸),流动相B为乙腈(含0.1%甲酸);负离子模式:流动相A为水(含5 mM甲酸铵),流动相B为乙腈(含5mM甲酸铵)。梯度洗脱程序为0—1.5 min:5%—25% B,1.5—10.0 min:25%—100% B,10.0—13.0 min:100% B,13.0—13.5 min:100%—5%,5%B维持1.0 min。流速为0.40 mL/min,进样量为3 μL,柱温为45 ℃。
1.5 质谱条件
样品质谱信号采集分别采用正负离子扫描模式,电喷雾毛细管电压、进样电压和碰撞电压分别为3.5 kV、40 V和40 eV。毛细管和离子温度分别为350 ℃,载气流量为45 L/h,质谱扫描范围为50—1 000 m/z,分辨率为30 000。
1.6 数据处理
将原始数据导入代谢组学处理软件 Progenesis QI(Waters Corporation,Milford,USA)进行基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化,最终得到保留时间、质荷比和峰强度的数据矩阵,将处理的数据矩阵导入SIMCA-P软件,进行主成分分析(PCA)、正交偏最小二乘-判别分析(OPLS-DA)等多元统计分析,再根据变量对分组贡献值(VIP)的大小和组间变化的显著性(P<0.05)进行差异性代谢产物的筛选。鉴别差异代谢物的主要数据库为 http://www.hmdb.ca/等公共数据库,最后利用 MetaboAnalyst平台进行聚类热图和代谢通路分析。
2 结果与分析
2.1 竹子各部位的色谱图
通过在正、负离子模式下对样本进行分离和数据采集,图1为各样本总离子流图,由图可以看出,色谱峰基线平稳,峰分离效果良好,仪器分析均信号强且稳定性良好。

图1 竹笋组(A)、竹茎组(B)、竹叶组(C)在正离子模式(1)和负离子模式(2)下的基峰强度色谱(BPI)Fig.1 Base peak intensity chromatograms(BPI)of root group(A),stem group(B),and leaf group(C)in positive ion mode(1)and negative ion mode(2)
2.2 竹子各部位的代谢物主成分分析
竹类样本进行不同部位分组(图2),共检测到1 112种代谢物,竹叶组共有497种代谢物,竹笋组251种代谢物,竹茎组364种代谢物,不同器官间共有38种物质。
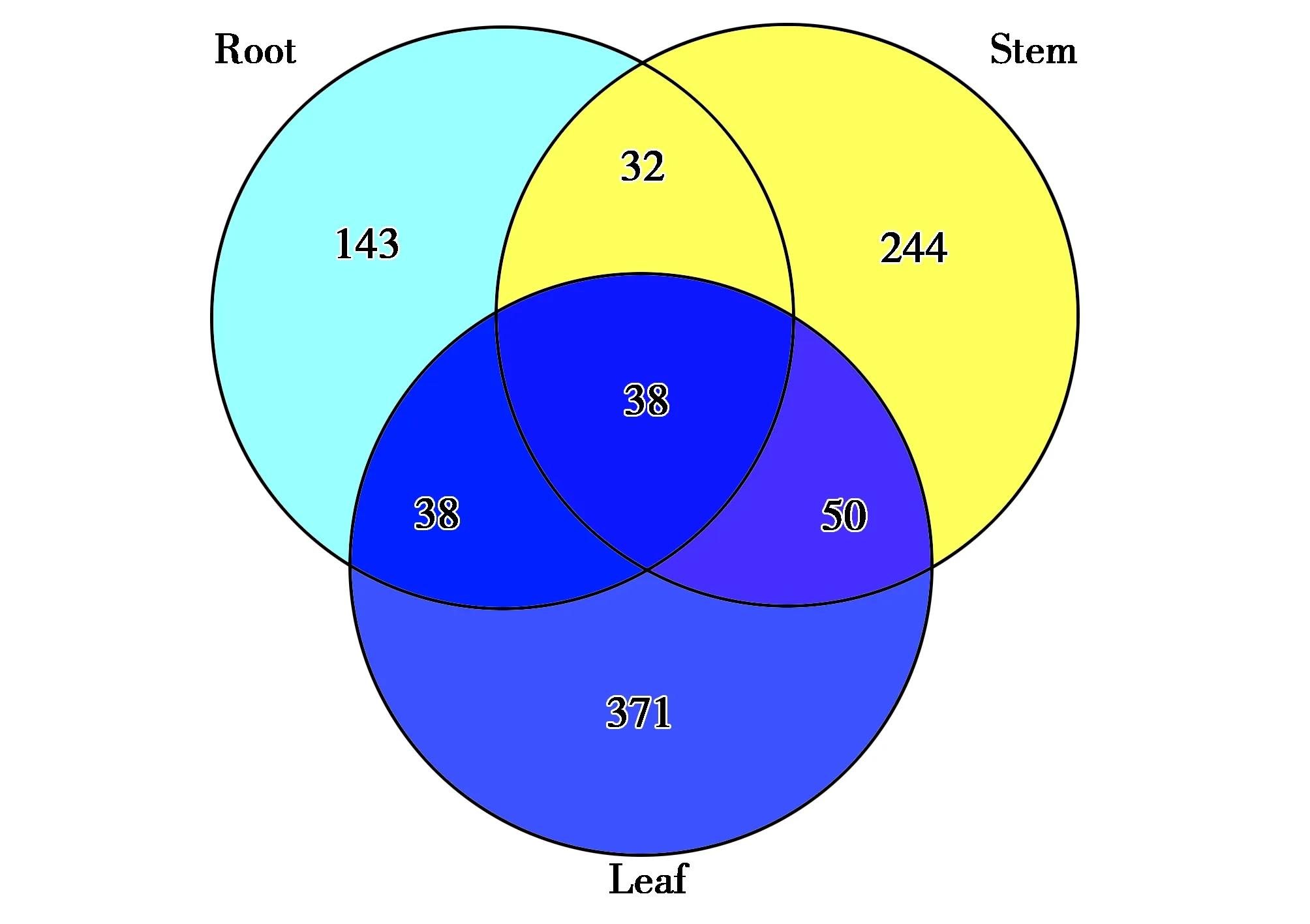
图2 各组代谢物(Venn图)Fig.2 Metabolites in each group(Venn graph) 注:Leaf:竹叶组;Root:竹笋组;Stem:竹茎组 Note:Leaf,bamboo leaf group.Root,bamboo shoot group.Stem,bamboo stem group
将数据进行面积归一化处理,处理后导入SIMCA-P软件中进行主成分分析(PCA),用UV算法处理数据进行拟合,拟合后得R2X=0.865,Q2=0.823,两个参数值均>0.5,且数值相差不大,说明拟合性较好,得PCA图(图3)。如图3所示,所有样品都处在95%的置信区间内,且竹叶、竹笋和竹茎3组样品各聚在一起,区分明显。

图3 主成分分析Fig.3 Principal component analysis 注:Leaf:竹叶组;Root:竹笋组;Stem:竹茎组 Note:Leaf,bamboo leaf group.Root,bamboo shoot group.Stem,bamboo stem group
2.3 竹子各组间的OPLS-DA分析
为筛选出组间的差异代谢物,将竹叶组、竹茎组和竹笋组数据处理后,得到OPLS-DA得分图(图4,图5和图6)。如图所示,竹叶组、竹茎组和竹笋组的代谢产物明显分离,表明各组之间存在显著差异,全部样品组都位于置信区间内,同时参数R2Y和Q2都大于0.9(表1),说明模型的稳定性较好,数据可靠。经过OPLS-DA置换检验发现Q2点从左到右均低于最右边的原始的蓝色的Q2点,且Q2<0,R2和Q2的回归线与横坐标交叉或者小于0,说明评估模型没有发生过拟合。以上结果表明OPLS-DA模型能有效区分各组样本,可用于后续的差异成分分析。
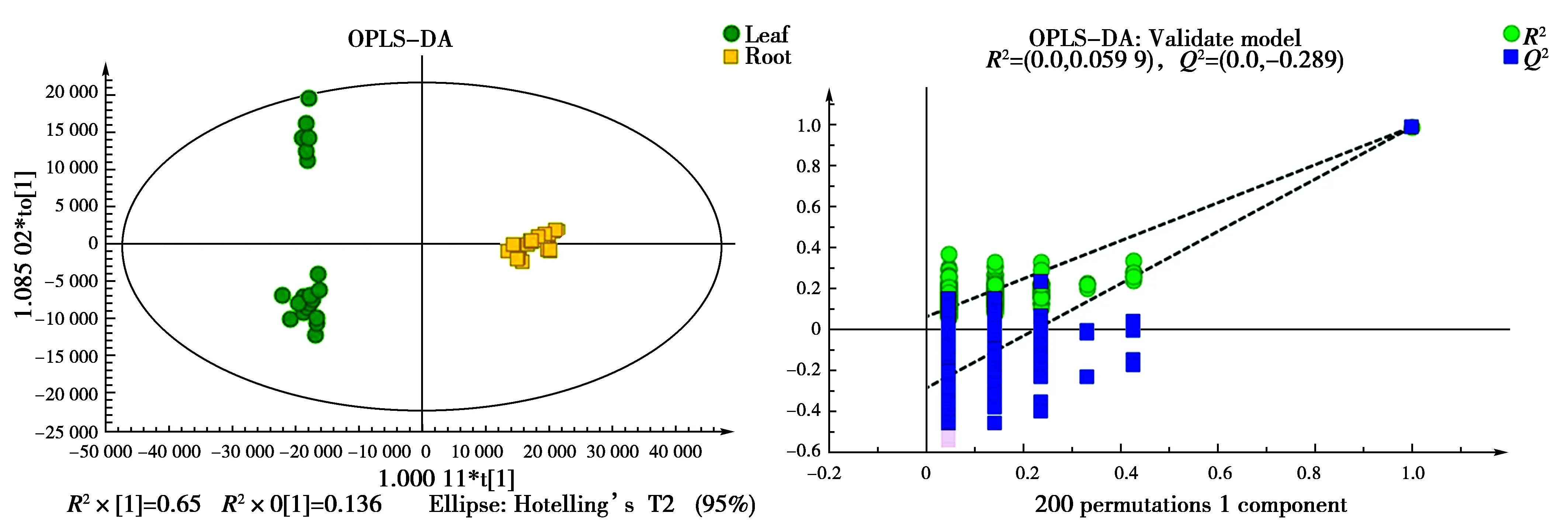
图4 竹叶组与竹笋组的OPLS-DA模型得分图和置换检验图Fig.4 OPLS-DA model score map and replacement test chart of leaf group and root group

图5 竹叶组和竹茎组的OPLS-DA模型得分图和置换检验图Fig.5 OPLS-DA model score map and replacement test chart of leaf group and stem group
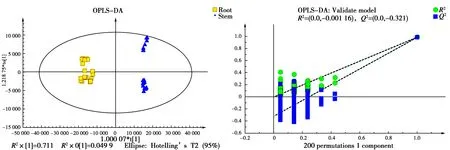
图6 竹笋组和竹茎组的OPLS-DA模型得分图和置换检验图Fig.6 OPLS-DA model score map and replacement test map of root group and stem group

表1 OPLS-DA模型的R2Y与Q2值
2.4 竹子不同部位的差异代谢物筛选
根据OPLS-DA生成的VIP值来筛选组间差异代谢物(VIP>1,P<0.05),对竹叶、竹茎和竹笋分别进行组间比较,在竹叶-竹笋组、竹茎-竹叶组、竹茎-竹笋组中分别筛选到80、85及40个差异代谢物。VIP值越大,分类贡献越大,越能表明差异代谢物对样品组间的分类影响强度,在此基础上,继续以VIP>3,P<0.05为指标的差异代谢物,共筛选到21种显著差异代谢物,主要包括脂肪酸和共轭物5种、十八烷酸类4种、二十烷酸类3种、黄酮类3种、有机酸2种、糖类以及其他4种物质等(表 2,表3和表 4)。
再利用 SPSS 22.0 进行变化差异倍数分析(fold change,FC),由log2(FC)值可知,竹叶-竹笋组中除9,12,13-TriHOME、柠檬酸、9(10)-EpODE、甲基丙二酸、异青蒿素2″-醋酸酯、D-麦芽糖和龙胆苦苷,其余代谢物含量均是竹笋组样品高于竹叶组。竹茎-竹叶组中除生物蝶呤、N-(3-oxo-hexanoyl)-homoserine lactone和5-hydroperoxy-7-[3,5-epidioxy-2-(2-octenyl)-cyclopentyl]-6-heptenoic acid,其余代谢物含量均是竹叶组样品高于竹茎组。竹茎-竹笋组中除生物蝶呤和龙胆苦苷,其余代谢物含量均是竹笋组的样品高于竹茎组。

表2 竹叶-竹笋组差异代谢物

表3 竹茎-竹叶组差异代谢物

表4 竹茎-竹笋组差异代谢物
2.5 代谢产物的聚类热图分析
如图6所示,颜色代表了代谢物的丰度高低。通过筛选出的差异代谢物将竹子各部位样品进行聚类分析,结果显示,差异代谢物在3组样品中的含量明显区分,竹叶组的白三烯B4、甲基丙二酸、柠檬酸、D-麦芽糖、13-OxoODE、9(10)-EpODE、9,12,13-TriHOME、异青蒿素2″-醋酸酯等代谢物的含量相对较高。竹笋组的赤酮酸、9,10-DHOME、9S,12S,13S-trihydroxy-10E,15Z-octadecadienoic acid、9S,11R,15S-trihydroxy-2,3-dinor-13E-prostaenoic acid-cyclo[8S,12R]、methyl 8-[2-(2-formyl-vinyl)-3-hydroxy-5-oxo-cyclopentyl]-octanoate和奎宁酸含量最高。竹茎组的N-(3-oxo-hexanoyl)-homoserine lactone、5-hydroperoxy-7-[3,5-epidioxy-2-(2-octenyl)-cyclopentyl]-6-heptenoic acid、生物蝶呤和龙胆苦苷含量较高。
2.6 代谢通路分析
为探究食竹对大熊猫机体代谢调节所产生的作用机制,对筛选出的差异代谢物质经 metaboanalys通路富集分析。MetPA平台主要基于HMDB数据库和KEGG代谢通路,结合通拓扑分析和路富集分析的结果,筛选出与实验的最相关的代谢通路,最终得到代谢通路影响因子图(图7),共筛选出 6条相关的代谢通路。图中圆圈表示所有匹配的代谢通路,圆圈的颜色和大小分别依据代谢通路的P值和通路影响值(pathy impact)确定的。基于impact值大于0.02对关键代谢途径进行筛选,结果发现有5条关键代谢途径。主要包括柠檬酸循环(citrate cycle),淀粉和蔗糖代谢(starch and sucrose metabolism),乙醛酸和二羧酸的代谢(glyoxylate and dicarboxylate metabolism),缬氨酸、亮氨酸和异亮氨酸的降解(valine,leucine and isoleucine degradation)、花生四烯酸代谢(arachidonic acid metabolism)(图8)。
3 讨论
大熊猫属于食肉目(Carnivora)动物,虽其食性已高度特化为以竹类为食,但仍然保留肉食动物的消化系统特征[12],而竹类粗纤维含量较高且营养价值较低,相对典型的食肉动物消化系统,大熊猫无疑对竹子的消化利用率较低[13-14]。大熊猫在不同的生理阶段对营养及能量的需求不同,为满足机体营养需要,大熊猫会采取最佳觅食策略即对主食竹在不同季节会采食不同部位[15]。
本文利用非靶向代谢组对采集的大熊猫主食竹各部位进行分析,总共筛选出21个显著差异代谢物质,其中包括脂肪酸和共轭物5种、十八烷酸类4种、二十烷酸类3种、黄酮类3种、有机酸2种、糖类以及其他物质4种等。热图分析发现差异代谢物在3组样品中的含量明显区分,竹叶组柠檬酸、D-麦芽糖、甲基丙二酸和黄酮类物质含量较高;竹笋组3种脂肪酸和共轭物,以及奎宁酸含量较高。竹茎组生物蝶呤和龙胆苦苷含量较高。
差异物质进行代谢通路的富集分析,得到5条通路较为显著,分别为柠檬酸循环,淀粉和蔗糖代谢,乙醛酸和二羧酸的代谢,缬氨酸、亮氨酸和异亮氨酸的降解,花生四烯酸代谢。柠檬酸循环、淀粉和蔗糖代谢与乙醛酸和二羧酸的代谢都与能量代谢有关,且柠檬酸循环是机体将糖或其他物质氧化而获得能量的最有效方式;其主要参与的差异代谢物为柠檬酸和D-麦芽糖,且这两种物质在竹叶中含量较高,而大熊猫一年中采食竹叶的时间最长,占比也较大[16]。Atapattu等[17]研究发现,柠檬酸能够促进胃蛋白酶的活动,从而改善对蛋白质和纤维的消化和吸收。除此外,柠檬酸能起到调味剂的作用,可直接刺激机体口腔味蕾细胞来促进唾液分泌,增强食欲[18],从而提高采食量,以促进体内钙的排泄、沉积和营养物质消化吸收[19]。D-麦芽糖能促机体对竹类中钙、镁、锌等矿物质的吸收,也能促其进肠胃蠕动[20],有利于大熊猫从竹叶中获取必需营养。
甲基丙二酸参与缬氨酸、亮氨酸和异亮氨酸的降解,缬氨酸、亮氨酸和异亮氨酸属于支链氨基酸(BCAA),大熊猫须从食物中获取的必需氨基酸。支链氨基酸可增加蛋白合成,可促进相关激素的释放,如生长激素、胰岛素和胰岛素样生长因子-1,以及利于维持一个合理的睾酮/皮质醇比例[21]。野生大熊猫一般在3—5月交配,在此期间雄性大熊猫需要保持体能优势,雌性大熊猫需要能保证正常发情、正常受孕的激素水平[22]。而竹叶中富含甲基丙二酸,因此发情期需要采食大量竹叶来促进血液中激素水平,从而提高其繁殖性能[23]。

图7 差异代谢物热图Fig.7 Differential metabolite thermogram

图8 差异代谢物通路富集分析Fig.8 Enrichment analysis of differential metabolite pathways
大熊猫在交配后受精卵着床延迟1.5—4.0个月,这是其所独有的妊娠生理特性[24]。此时各大山系均已发笋,竹笋组织鲜嫩、含水量以及蛋白质含量高,而纤维素含量和木质化程度低,且适口性较好,是该时段大熊猫的优选蛋白质食物。其富含的奎宁酸能抗病毒、抑制平滑肌收缩、降血脂等[25],当雌性所食竹笋营养积累到一定程度,可利于受精卵着床和胚胎的快速发育。野生大熊猫妊娠期为97—163 d,通常于9—10月产仔,此时当年生幼竹新叶易取食,而竹叶中都含较高的黄酮类化合物[26],大熊猫幼仔的主要营养以及早期的免疫防护均来源于母乳,有研究表明,黄酮类化合物被动物摄食后,可在小肠葡糖苷酶的作用下水解,从而在小肠黏膜细胞中代谢形成雌马酚(equol),发挥雌激素的功能,有利于促进雌性大熊猫产仔后的乳汁分泌[27-28],幼仔也通过母乳提高自身免疫力、抗病毒和抗菌等。
除此,竹茎中富含的龙胆苦苷具有抗原虫,保肝,刺激胃液和胃酸的分泌等功效[29]。生物蝶呤具有提高免疫力、抗炎症等功效[30],有利于雌性产仔后在育幼阶段来弥补产仔过程的能量耗损和哺乳的营养需求。大熊猫幼仔发育需要度过漫长的冬季,1岁以后开始吃竹叶[16],竹叶中富含的白三烯B4、前列腺素E2参与了花生四烯酸代谢,花生四烯酸作为其合成的直接前体,具有能诱发细胞的生长,调节免疫功能,促进毛发生长以及机体发育等重要功能[31]。因此,本研究发现大熊猫选择消化率较低且营养价值低的竹类为食,除竹类易获取以及营养成分较稳定外,采食竹子不同部位可满足大熊猫在不同生理阶段的需求。
4 结论
本文通过应用非靶向代谢组学对苦竹、方竹和刺黑竹的63个样品进行分析,结果表明竹子不同部位存在代谢差异,共筛选出21种显著差异代谢物,结合差异物质的生理作用,我们可进一步解释大熊猫在不同生长阶段取食竹子的不同部位,来满足自身的生理需求、生长发育的原因。竹子的代谢物含量不仅在不同部位存在差异,在其不同生活史阶段和不同环境中也会受到影响,后期研究中,我们将在非靶向代谢组的基础上,利用靶向代谢组学对竹子中的代谢物质做进一步定性和定量研究。

