基于尼氏染色图谱的小型啮齿动物快速脑区定位方法
王明娟 朱青青 潘永良 徐天扬 杨雨晨 张忠山
(湖州师范学院医学院,浙江省媒介生物学与病原控制重点实验室,湖州,313000)
大脑是最为精细和复杂的系统,由解剖上相连、功能上既相互独立又相互影响的脑区组成[1]。随着中枢神经系统疾病发病率的增加,对脑神经科学的研究需求日益迫切[2]。啮齿类动物由于中枢神经系统在解剖结构、生物构成及生理功能等方面与人类相似,且具有较完善的神经行为评估系统,所以被广泛应用于各类研究[3]。其中一些新兴物种在某些生理和行为上不同于传统实验物种,在建立某些特定疾病模型方面更具有优势,如长爪沙鼠(Merionesunguiculatus)较大小鼠更适用于脑梗和癫痫模型的建立[4-6]。脑立体定位技术可以更好地了解各脑区甚至其分亚区的功能信息,因此在中枢神经系统疾病模型的建立和功能研究中备受关注[7-9]。现含有空间立体定位信息的脑图谱都局限于大小鼠等传统实验物种,无法满足精确定位新兴物种脑区三维坐标的需求。此外,脑区坐标会因体型和性别而异,即使是有图谱的物种,定位过程中仍会有少许偏差而需反复调整,极大地影响了脑功能和精神障碍疾病的研究进展。虽然有少量文献报道了一些啮齿类动物脑图谱的构建,但对于如何快速和准确确定脑区三维坐标的报道仍缺乏。因此,当前实验以长爪沙鼠为对象,通过制作尼氏染色图谱和结合脑立体定位技术,旨在建立一套快速准确和适用范围较广的,且能满足不同体型、性别的脑区定位方法。
1 材料
1.1 实验动物
雄性长爪沙鼠35只,90日龄,体重(60±10)g,购于浙江省实验动物中心,饲养在湖州师范学院医学院转化医学平台实验动物中心。实验期间长爪沙鼠均在(22±2) ℃、相对湿度(50±5)%环境下饲养。所有关于实验动物的操作均遵守湖州师范学院实验动物管理制度与操作规程,并尽可能减少动物的痛苦。
1.2 实验器材与试剂
桌面型数显型脑立体定位仪68005(深圳市瑞沃德生命科技有限公司);KUY NICE SZM-7045 单臂双目手术显微镜(北京天诺翔科学仪器有限公司);恒流蠕动泵(保定兰格恒流泵有限公司);Leica CM1850冰冻切片机(德国雷卡公司);防脱载玻片(江苏世泰实验器材有限公司);尼氏染液(西格玛奥德里奇公司);酒精;二甲苯等。
2 研究方法
2.1 制备长爪沙鼠尼氏染色图谱
灌流方法参考《大鼠脑组织灌注固定方法的改进》[10],腹腔注射戊巴比妥钠溶液(8 mg/100 g体重),开胸,于心尖部插入灌流针,经左心室到达主动脉升部,先灌注生理盐水6 min(10转/min),至右心耳流出透明清亮液体,4%多聚甲醛(4 ℃)灌流30 min(10转/min),取脑组织,后固定2 h,保存至30%蔗糖溶液(4 ℃)中脱水至鼠脑沉淀。后行40 μm冠状冰冻切片后进行尼氏染色[11]:将脑片置于尼氏染色液中染色3 min,后用蒸馏水洗涤2次(每次数秒即可);再依次经75%、95%、100%乙醇进行浓度梯度脱水,最后直接浸于二甲苯中透明化,中性树胶封片,即可获得一套长爪沙鼠尼氏染色图谱。通过比小鼠脑图谱(http://atlas.brain-map.org/atlas#atlas=1&plate)和长爪沙鼠尼氏染色后的脑片,即可得到各脑区解剖结构和相对位置的信息,为了保证脑图谱的完整性,可多做几套图谱防止缺片漏片。
2.2 立体定位方法
2.2.1 固定
啮齿动物的左右脑基本对称,而且颅骨具有明显的解剖学标志(图1-C)。麻醉长爪沙鼠后,将耳杆从左右两侧插入外耳道,于主框固定(图1-A),使鼠脑左右高度一致。调节“压环旋钮”使压环上移,将啮齿动物的门齿固定于脑定位仪的上颌固定器;调节“固定旋钮”使得啮齿动物的头部自然伸展,后旋紧固定;下压“压环按钮”,夹紧头部(图1-B)。完成后对已固定好的长爪沙鼠脑袋进行推压,保证其从各个方向受力后均不发生偏移与滑脱。
2.2.2 校准头颅位置
在手术显微镜下定前囟(人字缝与矢状缝的交点)为主要基准点,后囟(矢状缝与冠状缝的交点)为辅助基准点(图1-C),两囟水平高度一致,并将前囟作为原点(0,0,0)。前后囟连接线即为Y轴,以向后为正;Z轴为竖直方向,以向上为正;X轴垂直于矢状平面,以向右为正。
2.2.3 确定脑区空间坐标
固定长爪沙鼠后剃毛,用2%碘伏和75%酒精充分消毒头顶部,沿矢状缝作长切状剪开,充分暴露骨缝,3%双氧水清除骨膜后用四棱钻钻开颅骨前囟位置,暴露脑膜,将脑膜挑破再垂直向主要基准点进针1 cm。针刺成功后立即将长爪沙鼠麻醉断头取脑,快速液氮冷冻,再行200 μm冠状面切片,按顺序贴片。以有进针痕迹最明显的脑片作为原点所在的切片。
对照尼氏染色图谱及原点所在切片,大致推算目标脑区的三维坐标数据。数出目标脑区脑片与原点所在脑片相差片数,片数乘以200 μm即得X值;然后利用标尺在染色图谱上测得目标脑区与中线垂直距离为Y值;目标脑区与原点所在水平面垂直距离加上颅骨厚度即为Z值。根据此坐标数据再次对第二只长爪沙鼠进针,后续重复上述操作,清点出目标脑区所在脑片(图1-D)与该脑片之间偏差的片数,并将脑片数×200 μm以得出所需脑区的准确轴数据。根据针痕用标尺测量,对X轴值和Z轴值进行微调,得出目标脑区最终的精确坐标。最后用第3只鼠再次重复以验证目标脑区坐标数据的准确性。

图1 长爪沙鼠脑立体定位的主要步骤Fig.1 The main steps of stereotaxic localization of Meriones unguiculatus brain 注:A:固定外耳道附近的脑颅骨;B:固定长爪沙鼠的鼻端;C:长爪沙鼠脑颅骨暴露后的解剖形态,Ⅰ为前囟点Ⅱ为后囟点;D:带有进针痕迹的侧脑室脑区 Note:A,fixes the skull near the external auditory canal.B,fixes the nasal end of Meriones unguiculatus.C,fixes the anatomical morphology of Meriones unguiculatus skull after exposure.I,the anterior fontanel point,II,the posterior fontanel point.D,the lateral ventricle brain area with needle insertion marks
3 结果
利用上述方法对长爪沙鼠5个脑区进行定位,左右两侧侧脑室(LV),终纹床核(BST),室旁核(PVH),杏仁核内侧核(MeA),中央杏仁核(CeA),共101例实验结果(1只鼠可定位多个不同目标脑区)。LV定位65例,成功62例;BST脑区定位15例,成功13例;PVH脑区定位5例,成功5例;MeA脑区定位10例,成功9例;CeA脑区定位6例,成功6例,成功率达94.06%。
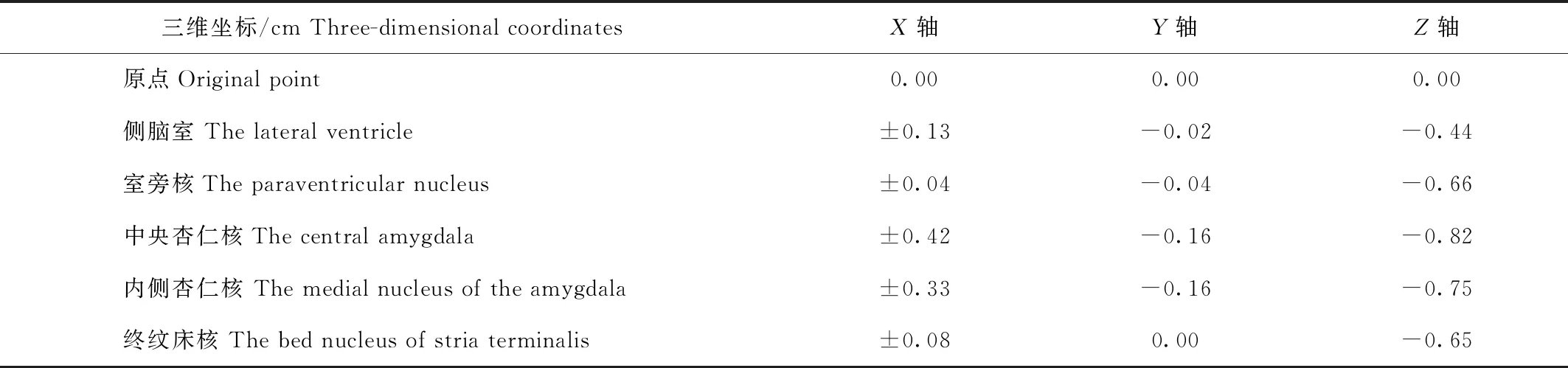
表1 以长爪沙鼠前囟所对应脑表面为原点所得出目标脑区定位坐标(平均值)
4 讨论
目前我国神经功能障碍的患者人数众多,发病率逐年攀升,然而,在疾病早期症状特异性低,极易漏诊、误诊,有效治疗手段十分有限,需要研究者更深入了解大脑的结构功能及大脑发育、发展和退化规律以改变目前的窘境。而脑立体定位技术被视为研究中枢调控系统的重要前提和基础。
同一物种各脑区在发育不同阶段的解剖结构会有偏差,导致目标脑区坐标发生变动,如老龄鼠通常会有不同程度的脑萎缩,较年轻个体神经元面积减少6%—48%[12],此外,性别因素对某些目标脑区的坐标定位也有影响,比如研究发现在前腹侧室周核和视前区性双形核等脑区结构具有明显的性别差异[12-14]。因此在进行脑区定位时需将年龄、性别纳入考虑因素。小型啮齿动物头骨形态结构相似,均有前后囟,左右对称的耳道及突出的门齿。本实验操作方案不仅能对沙鼠目标脑区进行有效定位,同样还适用于其他各类小型啮齿动物。通过本文操作流程,可根据待研究物种的性别、体重、日龄制作出一套相应的脑区图谱以实现对活体目标脑区的精准定位,避免因无关因素引起脑区定位偏差。
在整个实验过程中,头部的正确固定是脑立体定位成功的基础,左右耳孔夹持器插入过深会损坏中耳结构,插入不当则会使头部在实验中途发生移动而导致实验失败。对新手而言耗时较长。理想的头部固定应是将其从各个方向受力后均不发生偏移与滑脱,保证长爪沙鼠颅骨处于水平状态且前后囟要大致处于同一水平线。总体而言,本定位方案对仪器设备等实验室条件要求相对不高,操作步骤简单,成功率高,能有效减少动物使用量。在神经科学中将脑立体定位技术与药物微量注射[15-17]、损毁[18-19]光遗传学等技术[20]相结合,有助于更好地促进精神疾病动物模型研究。但此方法采用竖直向下进针,适用于进针路径无重要血管结构及生命中枢的目标脑区,否则需要通过一定角度进针,该方式还有待深入探讨。
致谢:湖州师范学院医学院陈佳欣、王晓彤同学协助操作,特此致谢。

