皮肤T细胞淋巴瘤免疫微环境研究进展
李凡 王琳
四川大学华西医院皮肤性病科,成都610041
一、肿瘤微环境与皮肤T细胞淋巴瘤
皮肤T 细胞淋巴瘤(cutaneous T⁃cell lymphoma,CTCL)是一组来源于T 细胞的局限于皮肤的异质性肿瘤,是第二常见的结外非霍奇金淋巴瘤。大多数CTCL 具有惰性生物学行为,预后良好;但当宿主免疫系统受损时,其临床过程可呈侵袭性。局部干预及单药系统治疗是大多数CTCL 的主要管理策略[1],但CTCL 复发率仍较高。干扰素(IFN)作为CTCL 尤其是蕈样肉芽肿(mycosis fungoides,MF)最重要的治疗手段之一,已广泛应用于临床,其主要是通过对抗宿主的免疫抑制状态发挥疗效[2]。免疫治疗在CTCL 中具有广阔前景。
肿瘤微环境是肿瘤细胞与多种宿主细胞之间形成的复杂网络,主要包括肿瘤细胞和非肿瘤成分,后者包括造血源性细胞、间叶源性细胞以及非细胞结构成分(表1)。但其组成并非一成不变,肿瘤细胞可以通过分泌细胞因子和趋化因子等改变肿瘤周围基质组成[3]。相应地,基质中的非肿瘤成分,尤其是其中的免疫细胞及相关细胞因子,可以直接或间接影响肿瘤细胞的表型、侵袭、转移及其对治疗的反应[1]。肿瘤微环境组成和功能对于肿瘤生存和免疫逃逸等都至关重要,是宿主免疫功能的重要体现。深入了解CTCL的免疫微环境组成及功能可以帮助人们寻找更有效的对抗肿瘤的治疗手段,同时帮助临床医生更好地判断疾病预后。
二、不同肿瘤微环境成分在CTCL发生发展中的作用
1.辅助性T 细胞(T helper cell,Th 细胞)及相关细胞因子:Th 细胞在免疫系统中发挥重要作用,分为两种主要亚型:Th1 和Th2。CTCL 被认为是Th2 细胞占主导地位的疾病。人体内还存在其他一些独立亚型的Th细胞,如调节性T细胞(regulatory T cells,Treg)、Th17细胞、Th22细胞等。以这些细胞为靶向,阻断相关细胞因子的生物学功能已被应用于一些自身免疫性疾病的治疗中。
CTCL的进展与Th2型细胞因子表达升高及Th1型细胞因子的表达下降有关。早期MF 具有Th1 型细胞因子的表达模式,而肿瘤期CTCL 微环境以Th2 型为主[4]。这种向Th2偏移的模式被认为是宿主细胞免疫和抗肿瘤效应受到抑制的关键因素。Th2型细胞因子的表达还能促使红皮病、免疫抑制和细菌感染的发生,是进展期MF和Sézary综合征患者预后不良的重要因素之一[5]。研究者还发现,白细胞介素(IL)⁃25(IL⁃17E)和IL⁃19 在CTCL 微环境中表达升高[6⁃7],而IL⁃21在肿瘤期MF患者中表达显著下降[8]。此外,由氧化应激诱导产生的细胞因子如IL⁃6,在CD30+CTCL 和早期MF 患者中异常表达,也可作为预后不良的预测标志[9]。
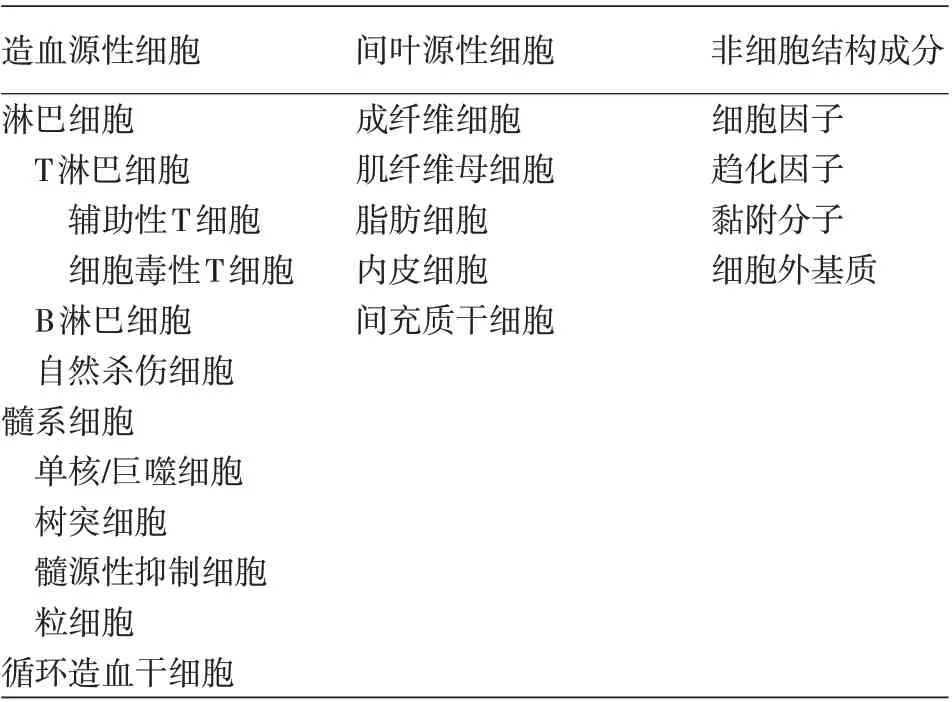
造血源性细胞淋巴细胞T淋巴细胞辅助性T细胞细胞毒性T细胞B淋巴细胞自然杀伤细胞髓系细胞单核/巨噬细胞树突细胞髓源性抑制细胞粒细胞循环造血干细胞间叶源性细胞成纤维细胞肌纤维母细胞脂肪细胞内皮细胞间充质干细胞非细胞结构成分细胞因子趋化因子黏附分子细胞外基质
Th17 细胞以在IFN⁃γ 缺如的情况下产生前炎症因子IL⁃17为特征,通过产生IL⁃17A、IL⁃17F、IL⁃6、IL⁃22和IL⁃23等细胞因子来维持自我更新。关于Th17细胞在CTCL中的地位一直备受争议。Miyagaki 等[10]对CTCL 患者皮损进行研究,发现IL⁃22 对肿瘤微环境的形成具有更重要作用,而仅有少数患者皮损中的IL⁃17 mRNA 水平升高。虽然最初认为IL⁃22 的产生与Th17 细胞表达IL⁃17A 相关,但后来证据表明,Th22细胞在IL⁃17A缺如的情况下也能产生IL⁃22。Miyagaki等[10]提出,IL⁃22通过促进角质形成细胞表达CC趋化因子配体20 来趋化其受体CCR6 表达阳性的细胞,即通过趋化CCR6+不成熟树突细胞(DC)和朗格汉斯细胞(Langerhans cells,LC)至CTCL 皮损中,发挥促肿瘤生长的作用。反过来,LC也能诱导Th22细胞产生IL⁃22。
在多种实体肿瘤中Treg数量与疾病预后呈负相关。但在淋巴瘤中却不同,其功能及作用机制更为复杂。有学者将其总结归纳为4种类型:抑制性Treg、恶性Treg、直接杀伤肿瘤Treg和无能Treg[11]。该分类有助于预测淋巴瘤患者的预后及基于Treg 的免疫治疗研究。CTCL 中既存在恶性Treg,又有直接杀伤肿瘤的Treg。Heid等[12]在对15例Sézary综合征患者的研究中发现,8例患者皮损和血液中的Foxp3+细胞比例显著下降,而另外6例明显增加;在这6例患者中,这些Foxp3+细胞经证实是单克隆CTCL细胞,它们能够抑制T 细胞IL⁃2 mRNA 的表达。Shareef 等[13]研究发现,早期MF微环境中的Foxp3+细胞数量高于肿瘤期MF 和Sézary 综合征,认为Foxp3+Treg可以直接抑制MF肿瘤细胞活性。
阿仑单抗(alemtuzumab)是一种针对T或B淋巴细胞表面CD52 糖蛋白的单克隆抗体,除了能直接消减淋巴细胞外,多项临床研究已显示,它能增加Treg 的比例,减少前炎症因子IFN⁃γ 和IL⁃17 的产生并上调抗炎症细胞因子IL⁃4、IL⁃10和转化生长因子β水平,其中以对Treg的影响最为显著[14]。随后的体外试验证实,阿仑单抗能介导补体依赖的T细胞溶解,保留Treg[15]。研究显示,皮下应用低剂量阿仑单抗对白血病期CTCL 有效,临床总缓解率达74%~86%,但对MF疗效不理想,侧面反映了二者来源于不同的T细胞亚群[16]。MF肿瘤细胞源于非迁移性皮肤定居记忆性T细胞,而白血病期CTCL细胞具有中枢性记忆T细胞的表型,能在皮肤、血液、淋巴结之间迁移再循环。阿仑单抗作用需要中性粒细胞、自然杀伤(NK)细胞的参与,因此其作用部位实际在血液而非皮肤[17],所以对MF效果不佳。
2. 细胞毒性T 淋巴细胞(cytotoxic T lymphocytes,CTL)和NK细胞:在CTCL早期,皮损局部主要由少量肿瘤细胞和大量反应性细胞组成,后者主要为活化的CTL 和表达细胞毒标记的Th1细胞,说明CTCL早期是以细胞介导的抗肿瘤免疫反应为主,限制着肿瘤细胞的扩散[4]。多项研究结果表明,从CTCL 患者中分离出的活化CTL、反应性Th细胞及NK细胞均能在体外对自身肿瘤细胞产生杀伤作用,且外周血和局部微环境中的CTL数量与预后呈正相关[18]。
KIR3DL2 是杀伤细胞免疫球蛋白样受体(killer⁃cell immunoglobulin⁃like receptor,KIR)家族的成员之一,又称CD158k,是NK 细胞表达的最主要MHCⅠ类分子受体,与MHCⅠ类分子结合后能抑制NK细胞的细胞毒作用,也表达于一些CTL中[19]。在CTCL微环境中,伴大细胞转化的MF、Sézary 综合征和原发性皮肤间变性大细胞淋巴瘤(primary cutaneous anaplastic large⁃cell lymphoma,PCALCL)的肿瘤细胞均被检测到有异常表达的KIR3DL2[20],可能是由于基因重塑导致NK 细胞受体异位表达。KIR3DL2 并非通过直接对肿瘤细胞发挥杀伤作用,而是激活NK 细胞和巨噬细胞,分别通过抗体介导的细胞毒作用和细胞吞噬作用来发挥效应[20],抗KIR3DL2单克隆抗体IPH4102治疗CTCL的初步临床研究正在进行中。
CD226 是免疫球蛋白超家族成员之一,主要表达于CTL 和NK 细胞表面,其配体CD155 在多种肿瘤细胞中表达。Takahashi 等[21]研究了这两者在CTCL 中的表达和功能,结果显示,CTCL微环境中CD155 mRNA表达增加,而患者外周血中NK 细胞和CTL CD226 表达减少;体外试验显示,重组CD226 能对CD155+肿瘤细胞产生细胞毒作用,证实CD226可能作为治疗CTCL的潜在手段。
在治疗方面,Accart 等[22]在Ⅰ/Ⅱ期临床试验中首次证实,将表达人IFN⁃γ的腺病毒载体注射至CTCL患者局部皮损,能诱导浸润的CD8+TIA⁃1+CTL数量的增加,且与临床获益相关。来那度胺是沙利度胺的衍生物,能增强NK细胞的功能,刺激T 细胞增殖和IL⁃2 的产生,从而促进Th1 型免疫应答并抑制IL⁃10的产生。在32例MF/Sézary综合征患者的Ⅱ期临床试验中,来那度胺单药治疗的完全有效率为28%[23]。
3. 肿瘤相关巨噬细胞(tumor⁃associated macrophage,TAM):由于微环境缺氧及存在多种生长因子、免疫抑制因子等,促使营养型巨噬细胞向TAM转变。目前已知至少有6 种TAM 亚型,以M1 型(TAM1)和M2 型(TAM2)最为重要[24]。TAM1由细菌产物或免疫刺激物如IFN⁃γ激活,具有抗肿瘤免疫活性,可产生低水平的IL⁃10和高水平的IL⁃12,主要存在于肿瘤的早期阶段;而TAM2 主要由IL⁃10、IL⁃13和IL⁃14 等激活,可产生低水平IL⁃12 和高水平IL⁃10,促进肿瘤生长,在肿瘤晚期阶段占优势。
Sugaya等[25]研究发现,MF患者皮损中的CD163+TAM数量比例与预后相关,而另一项纳入30例MF/Sézary综合征的研究也证实,患者皮损中的CD163+TAM 浸润密度明显增加[26],提示TAM2 在其发病机制中扮演重要角色。有学者[27⁃28]证实,在皮肤CD30+淋巴增生性疾病中TAM2 的数量增多并紧密分布在肿瘤细胞周围。
TAM 的具体作用机制尚不完全清楚。目前已知TAM2能通过分泌IL⁃4、IL⁃13、转化生长因子β 等下调TAM1 和CTL 的数量,从而抑制免疫;还可产生相关趋化因子,通过募集抑制性免疫细胞来维持肿瘤微环境的免疫抑制状态,从而促进肿瘤发展[29]。Wu 等[30]报道,在MF 患者皮损中,TAM 相关细胞因子的mRNA 表达上调,消减TAM2 能延缓肿瘤进展;研究者还发现,TAM在肿瘤血管生成中也发挥作用[30]。
以上研究均表明,TAM 在CTCL 的发展中具有重要意义,调节TAM2的功能可能成为潜在的治疗手段。Furudate等[31]证实,IFN⁃α和IFN⁃γ也能通过TAM2来发挥对MF的治疗作用。此外,集落刺激因子1(colony⁃stimulating factor 1,CSF1)及其受体介导的信号传导对单核吞噬细胞和巨噬细胞的存活及分化至关重要。研究证实,在多种肿瘤内存在的CSF1R+TAM都与不良预后相关[32]。以CSF1/CSF1R为靶向的药物正在多种实体肿瘤和淋巴造血组织肿瘤中进行试验,但尚无关于皮肤淋巴瘤的研究。
4.树突细胞(DC):DC 是最主要的抗原呈递细胞,而肿瘤来源的IL⁃10 可以抑制DC 成熟。有学者[33⁃34]发现,MF/Sézary 综合征患者皮损中有明显未成熟DC浸润,且数量随着肿瘤进展而增加,未见成熟DC,从而提出未成熟DC可能诱导机体对CTCL的免疫耐受。但Iliadis等[18]研究显示,MF微环境中CD1a+细胞的减少又与治疗抵抗相关。此外,Kakizaki等[28]在PCALCL和淋巴瘤样丘疹病(LyP)的微环境中也未检测到成熟DC(CD83 和CD208)的表达,但发现PCALCL 中CD205+DC 的数量明显高于LyP,这些细胞可能是具有免疫原性的DC。Vieyra⁃Garcia等[35]报道,CTCL局部炎症反应由c⁃Kit+OX40L+CD40L+DC募集和激活良性T细胞引起,这种激活可能提供了致瘤信号;靶向c⁃Kit、OX40 和CD40信号通路可能成为新的MF治疗途径。
LC是局限于表皮的髓样DC,对皮肤的局部免疫至关重要,它们能迁移至淋巴结中发挥抗原呈递功能,但也能通过诱导耐受、介导炎症等途径发挥致病作用[36]。Pileri等[37]对不同分期MF 的微环境进行研究,发现ⅠA/B 至ⅡB 期患者皮损中LC 明显下降,提出LC 的减少可能有助于肿瘤细胞免疫逃逸。但到目前为止,LC在免疫应答中的确切功能没有被阐明,在CTCL中的地位也需要进一步评估。
浆细胞样树突细胞(plasmacytoid dendritic cells,pDC)是一类特殊的DC亚群,能通过产生Ⅰ型IFN和其他前炎症细胞因子来发挥抗病毒作用,并通过调控髓系DC、淋巴细胞及NK 细胞的功能来连接固有和适应性免疫。它们在肿瘤微环境中的作用复杂,既有诱导抗肿瘤免疫的潜能,又可能有助于免疫耐受。但仅有少量研究显示,MF/Sézary综合征患者皮损中pDC 数量与正常皮肤相比有所增加[38],但pDCs在CTCL中的具体功能或与其他免疫细胞之间的相互作用未被评估。
Brentuximab Vedotin(BV)是一种抗体⁃药物偶联物,它除了能直接作用于CD30阳性的细胞外,其中的活性细胞毒制剂单甲基auristatin E 还能激活肿瘤微环境中的DC[39],从而提高机体的抗肿瘤免疫能力。一项Ⅱ期临床试验显示,在进展期MF/Sézary 综合征患者中BV 治疗前景良好,而药物反应时间、反应持续时间、疾病无进展生存期、无事件生存期均与CD30 表达无关[26]。另一项Ⅰ期非对照试验在12 例早期CTCL患者中评估了局部使用瑞喹莫特的安全性和有效性,结果显示75%有效,该药能诱导DC的活化[40]。
5. 髓源性抑制细胞(myeloid⁃derived suppressor cells,MDSC):MDSC 是一组来源于髓系的不成熟细胞,病理情况下会聚集并活化,从而通过多种机制来抑制宿主的免疫应答,在炎症、感染及肿瘤中均存在[41]。在肿瘤中,已有大量的数据证实它能抑制T 细胞免疫反应,其主要作用途径包括:剥夺T细胞的必需氨基酸、激活氧化应激、干扰T细胞的生存发育及运输,并能与其他免疫细胞相互作用,共同促进肿瘤微环境免疫抑制状态的形成[41]。此外,MDSC还能通过破坏细胞外基质、促血管生成等非免疫途径来促进肿瘤的增殖与转移。
Geskin等[42]首次对MF/Sézary综合征患者外周血MDSC数量与疾病分期的关系进行研究,结果显示,MDSC 数量在MF/Sézary 综合征患者中没有明显升高;但在ⅠB 期及以上的MF 中,MDSC 能产生更多的活性氧类;此外,IFN 的治疗作用可能与抑制MDSC 的功能有关。但在人体组织中,尚缺乏MDSC 的特异性细胞标记,其识别主要依靠多种标记的组合及其免疫抑制功能[43]。因此,到目前为止,关于MDSC在人类T细胞淋巴瘤微环境中的研究仍屈指可数。
吲哚胺2,3双加氧酶1(indoleamine 2,3⁃deoxygenase 1,IDO1)是MDSC的重要功能标志之一[44],它能催化肿瘤微环境中色氨酸代谢,导致可溶性犬尿氨酸及其下游代谢产物释放,诱导Treg及抗原呈递细胞免疫耐受,从而导致肿瘤免疫逃逸[45]。Maliniemi 等[46]研究90例CTCL,发现所有CTCL患者均有CD33+IDO1+MDSC 表达,而在部分LyP 病例中,其比例高达30%,证实IDO1/犬尿氨酸通路在CTCL 微环境中的重要作用。
总之,目前已有的基础及临床研究结果显示,MDSC 作为一个潜在的治疗靶点和可靠的预后标志,具有极大的研究价值。
6.其他微环境成分:B 淋巴细胞除了在体液免疫中起重要作用以外,也有抗原呈递作用,从而介导抗肿瘤效应。B 细胞还能释放促肿瘤生长和化疗耐药等的细胞因子[47]。调节性B 细胞最初发现于自身免疫性疾病中,能抑制多种细胞如T 细胞的功能,还可通过分泌抗炎介质IL⁃10 促进T细胞向Treg 转化,从而削弱宿主的免疫应答[48]。但目前对B细胞在肿瘤中的作用研究结果比较矛盾,如Theurich等[49]研究发现,33 例CTCL 中18 例患者皮损的浸润B 细胞明显增加,其数量与患者生存呈负相关;但Iliadis 等[18]对16 例MF 的研究显示,微环境中仅有少量B 细胞存在甚至缺如,且与临床表现不相关。关于CTCL 微环境中B 细胞的作用及机制还需进一步探索。
肥大细胞是固有免疫的重要组成部分之一,在良性炎性皮肤病和CTCL 中均发现了浸润的肥大细胞。Eder 等[50]对不同亚型和分期的CTCL进行研究,发现在所有CTCL中,MF 微环境中的肥大细胞数量和密度最高,且ⅠA 和ⅠB 期的数量明显高于ⅡA 和ⅡB 期。但关于肥大细胞与肿瘤临床行为之间的关系还需要更大队列的研究。
成纤维细胞能通过多种机制促进肿瘤细胞的生长。Miyagaki等[51]报道,早期CTCL微环境中的成纤维细胞表达高水平CXCL9 和CXCL10,能募集Th1 细胞、CTL 和NK 细胞。CTCL 进展时,CXCL9 和CXCL10 表达下调,促使微环境向Th2 模式发展。研究显示,与健康对照相比,CTCL 患者微环境中存在更高水平的骨膜素[52]。骨膜素是一种成纤维细胞产生的细胞外基质蛋白,IL⁃4 或IL⁃13 能刺激其产生。骨膜素除能诱导形成Th2 模式为主的肿瘤微环境外,还能通过刺激胸腺基质蛋白的产生诱导慢性炎症反应,从而直接刺激CTCL生长。
三、结语
由于CTCL的低发病率和高度异质性,目前尚没有可靠的预后标志;同时,复发难治性CTCL 患者也亟待新的治疗策略的出现。近年来,学者们不断强调肿瘤免疫逃逸和微环境免疫监视的相关性,人们对CTCL的研究也细化到肿瘤微环境中的免疫细胞、体液因子和基质,并由此衍生出潜在的新治疗手段。但许多关于CTCL的疑问仍有待解答,对肿瘤微环境的组成及功能也需要更加深入的探讨,以期更完善地阐释CTCL 的病理生理机制,对临床诊疗实践提供帮助。
利益冲突所有作者均声明不存在利益冲突

