质子放疗的现状与展望
张怡航,黄御华,王 犇,方春锋,杨 涛,曲宝林,4,徐寿平,,4,张高龙
(1.解放军总医院第一医学中心放疗科,北京 100853;2.北京航空航天大学物理学院,北京100191;3.河北一洲肿瘤医院放疗科,河北涿州 072750;4.北京航空航天大学精准医疗高精尖创新中心,北京 100083)
0 引言
1946 年,罗伯特威尔逊研究了质子与物质相互作用过程中的剂量分布[1],发现了质子的衰减与X射线衰减的不同之处,意识到质子束可用于医学放疗。1950 年,美国加利福尼亚大学劳伦斯伯克利实验室第一次用质子束治疗患者[2]。20 世纪50 年代后期出现了用于脑部肿瘤治疗的质子放疗技术,且瑞典科学家证明了通过剂量调制器和磁场扫描仪可以控制辐射剂量在患者体内的二维强度分布[2],这为之后的质子放疗提供了坚实的理论基础。1961 年,美国哈佛大学核物理加速器实验室成功研制了第一个剂量旋转调制轮[2],使得许多配套设备如补偿器等开始投入使用,很多技术逐渐从理论转变为现实应用,质子放疗技术迅速发展。1990 年,美国罗马琳达大学医学中心出现了真正意义上的第一台医用质子放疗设备[1],标志着质子放疗正式进入实用临床阶段,这也是现代质子放疗时代的开始。据国际粒子治疗联合会(Particle Therapy Co-Operative Group,PTCOG)统计,目前在世界范围内已有近百所医疗机构在使用质子、重离子放疗技术实施肿瘤治疗[3],且正在建设的质子放疗中心有百余家之多,全球已有近20 万名患者接受过质子放疗。该技术正在逐步走向成熟,但是在加速器小型化、质子束稳定性等方面仍有待发展。
随着物理学等学科的发展和临床实践的推进,加速器小型化、质子束稳定性等问题得到逐步解决,质子Flash 照射技术、核磁影像引导技术、调强质子放疗(intensity modulated proton therapy,IMPT)以及质子自适应放疗(adaptive radiation therapy,ART)技术均发展迅速。因此,未来质子放疗有着更为广阔的应用前景。本文阐明当前质子放疗的物理与生物学理论基础,分析质子放疗系统及各子系统的组成,讨论质子放疗的未来发展趋势,以期为质子放疗的发展提供新思路。
1 质子放疗的物理与生物学理论基础
质子可用于放疗与其物理特性密切相关。当质子的运动速度降低时,其能量损失的变化速率大致与速度平方成反比。当质子能量低于1 MeV 时,质子的运动速度逐渐与原子最外层电子的运动速度接近,阻止本领随着速度的降低而降低。质子在水中阻止本领随其能量变化的情况如图1 所示[4]。
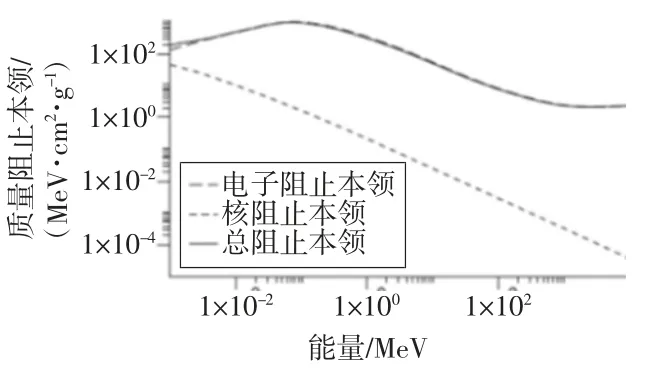
图1 质子在水中阻止本领随其能量变化的情况[4]
由图1 可知,材料对质子的阻止本领主要来自于电子,在电子密度较高的材料中,质子的射程变短,会在材料中沉积更多的剂量。在穿过介质时,质子还会受原子核的电磁相互作用,但其影响可以忽略。图2 为X 射线、电子和质子的剂量深度分布曲线。
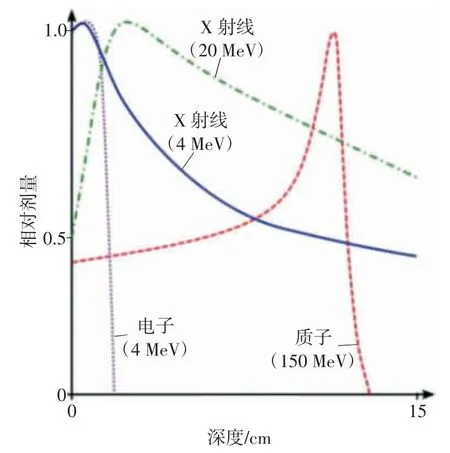
图2 X 射线、电子和质子的剂量深度分布曲线
质子释放能量时存在一个峰值,该峰值称为布拉格(Bragg)峰,这一特性使得质子的剂量分布更加可控。质子贯穿靶物质时,开始释放的能量并不多,只有到了质子射程的末端才会释放大量的能量,故存在Bragg 峰[5];之后,能量呈现断崖式下降,几乎可以忽略,因此认为质子束在Bragg 峰处沉积全部能量。该特性在放疗中可实现剂量的集中分布[6]。临床应用中使肿瘤细胞正好处于Bragg 峰位置处,实现对靶区肿瘤细胞造成最大程度杀伤的同时对周围正常组织的损伤显著减少,从而杀灭肿瘤且不会对正常器官形成较大的毒副作用。
2 质子放疗系统组成
经过数十年发展,以IBA、Varian 等为代表的多家企业推出了多种可应用于临床治疗的商业型质子放疗设备,如ProteusTM系统、ProBeam 系统等。质子放疗系统有单室紧凑型和多室型两类。完整的质子放疗系统主要包含以下子系统:(1)离子源与加速器系统,产生满足后端治疗所需的质子束;(2)质子束流传输系统,将满足所需参数的质子束传输至相应治疗室以供治疗使用;(3)质子束照射系统,用于质子束实施具体治疗[1]。
2.1 离子源与加速器系统
临床治疗中,质子在离子源中由氢气剥离电子产生。为治疗深度在3~30 cm 的肿瘤,需将质子束加速到70~250 MeV[8]。一般选择同步加速器或回旋加速器作为质子加速器[9]。同步加速器是全世界最早应用于临床的医用质子加速器[10-11],一般具有5 m 以上大直径环形结构,单件尺寸小、质量较轻;可引出脉冲型束流,且引出效率高,但平均流强较小;束流能量可在线调节且能散小、束流品质高,同时配有直线加速器作为质子注入器,但成本高、临床剂量率小。回旋加速器体积相对较小,符合质子装置紧凑化、小型化的发展趋势,引出的束流连续稳定,且束流的平均流强大、能量固定不变、临床剂量率高,因此在质子放疗中心有着广泛的应用。目前,全球大部分质子放疗中心采用回旋加速器。但在临床应用中,回旋加速器需要在束流传输过程中搭配能量选择系统进行降能以满足后续治疗需要,因此会产生大量的次级辐射[7]。
2.2 质子束流传输系统
质子束流传输系统衔接加速器与各个治疗室,将加速器引出的质子束按照实际需求调节能量和参数后送入不同治疗头供后续照射使用。加速器引出质子束后,先经过公共的主输运线(若采用回旋加速器,在加速器后需搭配调制能量的能量选择系统),主输运线中设置开关磁体系统将引出束流偏转至治疗室的机架内部输运线[12]。质子束输运线中除了磁体系统和束流监测系统之外,还包含真空、水冷和电气等外部系统。
2.3 质子束照射系统
由Bragg 峰曲线可知,若对肿瘤靶区实施单一位置和角度的照射,在皮肤和肿瘤之间的正常器官组织会受到1/3 以上的峰值剂量[13]。因此,质子放疗采用多射野角度对靶区照射以增加治疗的焦皮比,减少对正常组织的损伤。目前,用于临床的质子治疗室主要有固定束治疗室和旋转机架治疗室2 种。固定束治疗室中质子束流沿单一固定方向照射,通过与治疗床的配合来改变相对照射角度与位置,实现对部分肿瘤的治疗。近年来,许多学者提出了多个不同角度固定束治疗头错位布置的治疗室设计方案,增加了可治疗的肿瘤种类,确保了患者的治疗疗效[14]。旋转机架治疗室可实现质子束在一定范围内的偏转,可从不同方向照射肿瘤靶区,减少对正常组织的损伤。旋转机架按形态结构可分为桁架式、整体式和分片式;按机架所安装的磁铁模式可分为常温磁铁和超导磁铁;按束流扫描方式可分为前扫描和后扫描[15]。在实际应用中质子束照射主要有 3 种[8,16]:一是单散射技术,用于5 cm 以下小射野且有较大平均剂量率需求的眼部肿瘤固定束治疗;二是双散射技术,用于15 cm 以上较大射野的头颈部肿瘤固定束治疗和体部肿瘤旋转束治疗;三是摆动式散射技术,用于30 cm 以上大射野的部分肿瘤旋转束治疗。一般传输至治疗室的质子束并不能直接满足肿瘤靶区的照射需求,且质子束截面也不适用于靶区的实际几何形态和结构。被动散射质子治疗(passive scattering proton therapy,PSPT)将质子束通过能量调节器和散射片来实现对质子束流纵向、横向的展宽,配合适形器、补偿器调节质子束的束流后沿的剂量分布并使质子束高剂量分布区域更好地包绕肿瘤的形状。IMPT 借助治疗头内具有的磁体系统,通过对偏转磁场的调制使得质子束按照控制实施相应的偏转,形成治疗照射所需射野。目前临床上发展了笔形束点扫描(pencil beam scanning,PBS)[3]、光栅式扫描等多种扫描方式。IMPT 对束流性能、机械精度、在线监测、软件算法及软硬件配合度有极高要求,束流利用率高,无需高原子序数材料准直和采用补偿器,降低了中子辐射剂量。
3 质子放疗的未来发展趋势
目前,质子放疗的物理理论基础已相当完善,其临床应用也日趋成熟。随着凝聚态物理及其应用技术、计算机技术的发展以及质子放疗技术的推广,质子放疗的未来发展趋势总体较为乐观,具体表现如下。
3.1 质子放疗设备的发展趋势
3.1.1 放疗设备的小型化
当前质子放疗设备存在成本过高、较为笨重的问题,给质子放疗技术的推广造成了较大影响。回旋加速器的小型化最主要的方式是减小回旋加速器半径大小,具体方法是增大磁场强度。随着超导技术的发展与应用以及超导材料成本随着生产规模的扩大而下降,高强度环路电流的获取难度和成本降低,人造高强度磁场的稳定性增强,从而可实现回旋加速器的小型化。质子束在被引导至治疗头的过程中,其运动方向的改变极为依赖磁场作用,而强磁场技术的发展有利于机架设备的小型化,尤其是旋转机架的小型化有了更大的技术空间。
强化统筹政策落地。省财政厅、省扶贫和移民办组织开展对58个资金整合县的统筹整合工作进行交叉检查,并将检查结果进行全省通报,对2016年统筹整合财政涉农扶贫资金工作开展较好的6个县给予每县200万元的奖励,对资金结转结余较大的6个县分别追减200万元(该奖罚已在2017年财政专项扶贫资金中安排到位);对结转结余较大的6个县,统筹整合资金规模小、整合资金支出进度慢的4个县,2017年度整合实施方案出台晚、未按时报备的3个县全省通报并约谈县(市、区)财政局长、扶贫办主任,要求相关县(市、区)拿出具体整改措施,签订脱贫攻坚整改承诺书,确保按时整改到位。
3.1.2 质子束的稳定性
由于质子加速器和传统放疗使用的电子直线加速器的物理结构及性质不同,临床上质子束与X 射线存在较大差异,因此需要进一步对质子束的束流特性进行研究,其稳定性也需要进一步保证。
Mevion 质子系统将同步回旋加速器安装在机架上,避免了使用传统束流线和剂量监测电离室,保留了治疗头前端的能量调制器(energy selector,ES)和自适应孔径(adaptive aperture,AA)[17]。该系统的独特设计形成了与其他系统在Bragg 峰形状、光斑大小及其半影锐化效应方面明显不同的束流特性。这种ES 和AA 的结合使得不采用束流传输线和射程移位器情况下可实现质子PBS。在质子非等中心扫描束研究方面,美国医学粒子治疗加速器(American medical particle therapy accelerator,AMPTA)的临床实践和医学验收调试[18]表明,该扫描束治疗的溢出光斑范围、大小变化和位置变化分别在0.3 mm、15%和0.5 mm 左右。2 种独立的束流监测器校准方法一致性均优于1.0%。实施非等中心治疗允许侧半影减少约30%。该方法中束斑范围、大小变化、位置和剂量的日常质量保证测量值始终分别在基线数据的1 mm、10%、1 mm 和2%范围内。其质子束的束流稳定性已经可保证MedAustron 粒子中心采用非等中心质子束治疗实施水平和垂直固定束照射。相信在不久的将来,质子束流稳定性将在临床上得到验证。
3.1.3 质子Flash 照射技术的发展
质子Flash 照射需在小于0.5 s 的时间内输送高剂量的质子,在实践中面临的首要挑战是增加质子束的宽(深)度。在动物临床实验中,Flash 照射的质子束需覆盖小鼠的整个肺部区域,但加速器无法产生足够宽的质子束。目前,主要采用薄扁铅箔偏转以确保质子束变宽,在保持高剂量率的同时输送剂量均匀的质子束[19]。
新型质子加速器能够瞬间输送高剂量的质子束,这使得质子放疗更简单、设备更紧凑、治疗速度更快。且治疗结果显示,其剂量率最高达到了200 Gy/s,大幅超过Flash 照射所需的剂量率[20]。故相对于在X射线放疗领域中的应用,Flash 照射技术在质子放疗领域有着更广阔的应用前景,但Flash 照射技术的硬件发展是建立在质子加速器技术发展基础上的。因此,推进质子源技术的发展是Flash 照射技术进步的重要途径。此外,在实际应用中,Flash 照射技术也离不开配套的剂量追踪系统和图像引导系统来保证其安全性和有效性。
3.2 质子放疗中肿瘤定位追踪的精细化
3.2.1 深度学习技术在肿瘤定位追踪中的应用
对于胸、腹部肿瘤的实时追踪主要是通过金标追踪和呼吸追踪。这2 种追踪方式在当前CyberKnife技术中的应用已经较为成熟,但在治疗过程中往往只能起到实时监测及微调作用,对肿瘤定位追踪精度要求较高的质子放疗而言仍存在不足。考虑到患者身体状况不同,呼吸运动导致的组织运动规律存在差异。为了预测这一规律,还需借助强大的计算机系统。
当前的计算机技术,尤其是深度学习技术发展迅速,使得计算患者的呼吸运动规律成为可能。深度学习技术可以利用已有患者的呼吸运动数据对该患者短时间内的运动做出较为精准的预测。对于不同患者,深度学习得出的呼吸作用规律不同。相比现有呼吸追踪技术,基于深度学习的呼吸追踪对于患者呼吸运动的预测在具体细节上会更加准确。
3.2.2 核磁影像引导技术的发展
在分次治疗过程中,核磁影像引导技术可以实时引导肿瘤治疗,正常组织会受到更少的剂量照射,因此,核磁影像引导技术在质子放疗中有着广阔的应用前景。
目前核磁影像引导技术仍然存在问题,主要是核磁图像引导与质子放疗系统相互干扰。核磁成像时产生的磁场会对质子束产生影响,洛伦兹力使得质子束的径迹发生偏转,进而影响剂量分布及其测量结果[21];质子束流可能会影响核磁成像设备的电子元器件,影响其正常工作[22]。同时,用于产生、输送和偏转质子束流的磁铁也会对核磁图像质量产生影响[23],这对加速器的磁场屏蔽技术提出了较高的要求。可以预见,随着凝聚态物理学的发展,磁场屏蔽技术的进一步提高会给磁场带来更好的防护,以满足同时开展质子治疗和核磁成像的要求,进而可有效地保障核磁成像质量。
3.3 质子放疗技术的发展
3.3.1 IMPT 技术
IMPT 在剂量学上优于PSPT 和调强放疗(intensity modulated radiation therapy,IMRT),但目前主要局限在3 个方面:治疗计划、治疗实施和运动管理。与IMRT 相比,IMPT 极易受各种不确定因素影响,尤其是解剖结构的内部组织差异,因此IMPT 的治疗计划和计划评估需要特殊的考虑[24]。其他不确定性来源还包括用于计算治疗计划剂量分布模型的近似值和假设。对于治疗计划,IMPT 需减少质子射程和计算剂量分布的不确定性,改进稳健性计划并进行优化,提高自适应治疗计划和实施的效率,并考虑如何利用质子RBE 的可变性使临床获益。
3.3.2 ART 技术
ART 作为影像引导放疗(image guided radiation therapy,IGRT)发展延伸出的一种新型放疗技术,是通过改变放疗照射方式来实现对患者肿瘤或周围组织解剖变化的调整,即通过引导图像(如CT 图像、核磁图像等)评判患者解剖和生理变化,或放疗过程中的反馈信息(如肿瘤大小、形态及位置)变化,分析分次放疗与原始计划之间的剂量差异,从而指导当前或后续分次放疗计划的重新设计,实现个体化放疗。
质子放疗技术起步较晚,需要先进的图像引导技术来提升质子放疗的临床潜力。质子和X 射线与人体组织的作用机制存在一定的差异,将X 射线的ART 技术应用于质子中还需要大量的实验验证。另外,由于质子射程的不确定性较大,组织解剖结构变化对射程会产生一定影响,因而对摆位准确性和剂量计算要求更高[25]。
目前,国际上质子ART 技术还处于研究与临床探索阶段。Kurz 等[26]比较了虚拟 CT(vCT)和 CT 查找表(CTLUT)2 种强度校正方法在 IMPT 中的可行性,同时研究了锥形束CT(cone beam CT,CBCT)图像应用于质子ART 技术的可行性。Kim 等[27]通过散射校正CBCT 图像的质子剂量计算,研究了质子ART 的可行性。Hoffmann 等[28]研究表明,对于晚期肺癌的IMPT必须进行自适应调整以确保靶区的覆盖。Botas 等[29]开发了一种用于IMPT 的在线计划自适应算法,显著提高了分次间几何变化的处理质量。且该算法的临床实施将允许治疗前执行正确的自适应调整,从而可减小IMPT 中计划外扩边界。随着图像引导技术的不断发展、用于ART 实施与效果评估软件工具的研发以及临床经验的积累,ART 技术将逐渐变得成熟、可靠,从而在未来广泛应用于质子分次放疗中。
4 结语
随着CT、PET、MRI 等多模态医学成像技术的普及,对放疗患者可以做到更好地勾画肿瘤及准确照射。而相对于早期肿瘤的治疗技术,质子放疗存在着精度高、对正常组织保护更好的优越性。未来,肿瘤治疗技术中质子放疗的地位将进一步提升。

