来源于P. bacterium 1109的甘露醇脱氢酶的重组纯化及酶学性质研究
逯付之,徐 炜,吴 昊,张文立,光翠娥,沐万孟
(江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
甘露醇又名D-甘露糖醇,是一种晶体状不吸湿的功能性稀有己糖醇[1]。与蔗糖相比,甘露醇具有50%的甜度和较低的卡路里,目前在食品工业中主要用作功能性甜味剂[2],在制药、化学和医疗行业中也得到了广泛应用[3]。
甘露醇可以通过多种方法获得,目前的合成方法主要包括有天然提取法、化学合成法、生物转化法[4],其中生物转化法又包括酶转化法和微生物细胞转化法。天然提取法主要是从海带中提取,包括水重结晶法和电渗析器法[4]。在工业上,甘露醇主要是通过葡萄糖和果糖的混合物催化加氢制得,但是生产效率不高,果糖∶葡萄糖(质量比1∶1)混合可得到甘露醇∶山梨醇(质量比1∶3)的混合产物[5]。生物转化法主要包括全细胞[6]和游离酶,酶的催化特异性强,催化底物的转化率高,且出现副产物比例低,因而近年来利用生物转化法合成甘露醇受到越来越多的关注[7]。利用生物转化法把底物D-果糖转化为甘露醇过程中,起关键作用的是甘露醇脱氢酶(MDH),同时需要辅酶因子NAD(P)H或NADH参与[8],在此基础上,MDH还可以与甲酸脱氢酶联用,构成NAD(P)H或NADH再生的的双酶系统生产甘露醇[9]。目前已经有来自乳酸菌包括L.sanfranciscensis[10]、L.intermedius[11]、L.brevi[12]、L.reuteri[13]、L.mesenteroide[14]、L.pseudomesenteroide[15]的MDHs,还有来自其他细菌包括C.magnolia[16]、P.fluorescens[17]、R.sphaeroides[18]、T.maritima[19]和T.neapolitana[20]的MDHs被报道。
研究生物转化法合成甘露醇过程中,关键是研究MDH的催化效率和催化条件。目前已经报道的MDHs中,大多数来源于中温微生物,它们的热稳定性相对较弱,不利于大规模工业生产中,特别是在长时间中生物转化[21]。P.bacterium1109属于耐热菌属,它的全基因组已经被测序并公布在Genebank上(登录号为:LDJB01000003),经功能注释存在一个编码MDH的基因片段(Genebank登录号为KLU39398.1)。本研究将来自P.bacterium1109的目的基因导入到E.coliBL21(DE3)中诱导表达,分离纯化重组酶,同时研究了该重组酶的酶学性质以及反应条件,为酶法工业化生产甘露醇奠定理论基础。
1 材料与方法
1.1 材料与仪器
E.coliBL21(DE3)、E.coliDH5α上海生工(生物工程)有限公司;载体pET-22b(+) 上海捷瑞生物工程有限公司;氨苄霉素(Amp)、异丙基硫代半乳糖苷(IPTG)、SDS-PAGE凝胶电泳试剂、标准蛋白Marker、D-果糖、D-核糖、D-木糖、L-山梨糖、D-阿洛糖、D-甘露糖、D-半乳糖、D-甘露糖醇、木糖醇、山梨醇、D-阿拉伯糖醇、半乳糖醇、阿洛糖醇、烟酰胺腺嘌呤二核苷酸(NAD+)、还原型辅酶烟酰胺腺嘌呤二核苷酸(NADH) Sigma-Aldrich公司;液体LB培养基、固体LB培养、脱色液 依据文献[20]进行配制;其它试剂 均为国产分析纯。
PE20型pH计 梅特勒-托利多仪器上海有限公司;WFH-201B7型蛋白电泳设备、MP3型凝胶成像系统 美国Bio-Rad公司;Waters2695型高效液相色谱仪(HPLC)、Sugar-PakTM钙离子色谱柱 美国Waters公司;恒温水浴锅 上海生工有限公司;紫外/可见分光光度计 美国瓦里安仪器公司。
1.2 实验方法
1.2.1 重组MDH的质粒构建和氨基酸序列分析P.bacterium1109为耐热菌属,其全基因组序列已公布在NCBI数据库(GenBank:LDJB01000003),调取其已注释MDH基因序列(GenBank:KLU39398.1)并委托上海捷瑞公司合成。MDH基因用限制性内切酶NdeI和XhoI双酶切后,连接到同样双酶切的pET-22b(+)载体上,获得重组质粒pET-22b-Peba-MDH,且重组基因C端加上6个组氨酸标签便于目的蛋白的纯化。具体实验操作步骤参考已报道文献[22]。
重组MDH与其它已报道MDHs的氨基酸序列比对和同源性分析,通过Clustal-Omega和Espript在线网址完成。
1.2.2 重组MDH的诱导表达和分离纯化 将重组质粒导入到E.coliBL21(DE3)中,并涂布在固体LB培养基平板上(含Amp)37 ℃过夜培养12 h,由于pET-22b(+)载体上含有抗Amp基因片段,成功转化的菌体会在平板上形成菌落。挑取成功转化的重组菌的单菌落,接种到4 mL的LB液体培养基(含Amp)37 ℃摇床(200 r·min-1)过夜培养(12 h),然后将4 mL种子液转移到200 mL的LB液体培养基中(含Amp),在此条件继续下继续培养到细胞光密度0.6~0.8(OD600)时,添加异丙基硫代半乳糖苷(IPTG)至终浓度为1 mmol/L,将摇瓶转移至28 ℃摇床(200 r·min-1)诱导培养6 h。之后通过离心机(8000 r·min-1,5 min)收集菌体,用缓冲液(50 mmol/L Tris-HCl缓冲液,100 mmol/L NaCl,pH7.0)洗涤菌体两次。将洗涤后的菌体进行超声破碎,离心(12000 r/min,10 min)收集上清液。同时上清液用孔径0.45 μm的水相滤膜过滤,使用填充有螯合Ni2+的层析柱进行纯化[23]。
所有纯化步骤均在4 ℃条件下进行。重组酶的纯化分三个步骤[20],第一步:用5个柱体积的上样缓冲液(50 mmol/L Tris-HCl,500 mmol/L NaCl,pH7.0)平衡柱子,将上述收集的上清液(粗酶)泵入装有螯合Ni2+的层析柱;第二步:用洗涤缓冲液(50 mmol/L Tris-HCl,500 mmol/L NaCl,50 mmol/L咪唑,pH7.0)除去柱内杂蛋白;第三步:用洗脱缓冲液(50 mmol/L Tris-HCl,500 mmol/L NaCl,500 mmol/L咪唑,pH7.0)洗脱并收集目的蛋白。将收集的目的蛋白用含10 mmol/L EDTA的透析液(50 mmol/L Tris-HCl,pH7.0)透析6 h,去除金属离子,最后用不含EDTA的透析液(50 mmol/L Tris-HCl,pH7.0)去除EDTA,透析完成后将目的蛋白溶液放在低温冷藏。
1.2.3 重组MDH相对分子量和全分子量的测定 SDS-PAGE电泳检测,分离胶和浓缩胶的丙烯酰胺以12%(w/v)和4%(w/v)比例配制。电泳结束后用考马斯亮蓝染色1~3 h至深蓝色,然后用脱色液脱色至透明,通过蛋白酶条带与Marker的对比,确定其相对分子量。
使用高效液相色谱(HPLC)检测系统进行全分子量的测定,绘制全分子质量的标准曲线,根据标准曲线得出重组酶的全分子质量。
HPLC条件:流动相:0.1 mol·L-1Na2SO4,0.05% NaN3和0.1 mol·L-1KH2PO4;柱温:25 ℃;流速:1 mL·min-1;紫外检测器:280 nm。
1.3 重组MDH的酶学性质研究
1.3.1 重组MDH的酶活检测 纯酶溶液的蛋白浓度利用Lowry法检测并计算[24]。使用紫外/可见分光光度计(紫外340 nm)通过测量NADH吸光值的变化量来测定重组MDH的酶活[23]。反应体系1 mL:50 mmol/L Tris-HCl(80 ℃,pH8.5),0.5 mmol/L NADH,50 μL纯酶和100 mmol/L D-果糖。
比酶活:每毫克酶蛋白所含的酶活单位(U/mg)。
1.3.2 重组MDH最适pH和pH稳定性的测定 MDH是一种氧化还原酶,可以催化甘露醇和D-果糖之间的可逆反应。配制pH为6.0~9.5的Tris-HCl(50 mmol/L)缓冲液。
还原反应研究:将反应体系1 mL:50 mmol/L Tris-HCl,0.5 mmol/L NADH,50 μL纯酶和100 mmol/L D-果糖,置于不同pH条件下进行反应,并将结果中的最高酶活设定为相对酶活100%。
氧化反应研究:将反应体系1 mL:50 mmol/L Tris-HCl,0.5 mmol/L NAD+,50 μL纯酶和100 mmol/L甘露醇,置于不同pH条件下进行反应,并将结果中的最高酶活设定为相对酶活100%。
取pH分别为7.0、8.0、9.0的Tris-HCl(50 mmol/L)缓冲液各800 μL,分别加入200 μL纯酶溶液,并将其置放于4 ℃条件下,分别每隔2 h取样以D-果糖为底物测定酶活力变化,并分别将0 h测定的酶活设定为相对酶活100%。
1.3.3 重组MDH最适温度和温度稳定性的测定 同1.3.2研究重组MDH的还原反应和氧化反应。将pH8.5的还原反应体系(1 mL:50 mmol/L Tris-HCl,0.5 mmol/L NADH,50 μL纯酶和100 mmol/L D-果糖)分别在55、60、65、70、75、80、85、90 ℃的水浴锅环境中反应,并将结果中的最高酶活设定为相对酶活100%。将pH8.5的氧化反应体系(1 mL:50 mmol/L Tris-HCl,0.5 mmol/L NAD+,50 μL纯酶和100 mmol/L甘露醇)分别在上述的水浴锅环境中反应,并将结果中的最高酶活设定为相对酶活100%。
将纯酶溶液置于75、85、90 ℃条件下保温,定时取样加入到1.3.1反应体系中,测定不同温度取样的酶活,并将初始酶活设定为相对酶活100%,利用一级动力学模型,作出相对酶活的图像,研究重组MDH的热稳定性。
1.3.4 金属离子对重组MDH的影响 将金属离子Co2+、Ba2+、Ni2+、Ca2+、Mg2+、Zn2+、Mn2+和Cu2+分别加入到1.3.1反应体系中,至终浓度为1 mmol/L。在最适条件下,将测得的酶活性进行比较,并将不添加金属离子的一组设定为相对酶活100%。
1.3.5 重组MDH的底物特异性 将可能存在还原反应的不同底物(包括D-果糖、D-核糖、D-木糖、L-山梨糖、D-阿洛糖、D-甘露糖、D-半乳糖)分别添加到1 mL反应体系(50 mmol/L Tris-HCl,0.5 mmol/L NADH,50 μL纯酶)中,至终浓度50 mmol/L,将测得的酶活性进行比较,其中底物为D-果糖的反应体系测定的酶活设定为相对酶活100%。
将可能存在氧化反应的不同底物(D-甘露醇、木糖醇、山梨醇、D-阿拉伯醇、半乳糖醇、阿洛糖醇)分别添加到1 mL反应体系(50 mmol/L Tris-HCl,0.5 mmol/L NAD+,50 μL纯酶)中,至终浓度50 mmol/L,将测得的酶活性进行比较,其中底物为D-甘露糖醇的反应体系测定的酶活设定为相对酶活100%。
1.3.6 重组MDH以D-果糖为底物的动力学参数测定 使用不同浓度的D-果糖(10~200 mmol/L)在最适条件下测定酶活性,研究重组酶的动力学参数。利用Lineweaver-Burk双倒数法绘图,计算重组MDH的动力学参数,包括米氏常数(Km)、催化常数(kcat)、催化效率(kcat/Km)。
1.3.7 重组MDH在甘露醇生产中的应用 研究D-果糖转化生产甘露醇,在pH8.5和温度80 ℃条件下,加酶量为20 U/mL,加入NADPH的终浓度为200 mmol/L,使用初始浓度100、200和400 mmol/L的D-果糖作为底物,定时从反应体系中取样,使用HPLC检测甘露醇的生成量。
甘露醇检测:将定时所取样品离心(4 ℃,12000 r/min,5 min)取上清液,用0.22 μm微滤膜过滤,将过滤液稀释进行HPLC检测,根据反应体系产物与甘露醇标准样品的出峰时间进行定性分析,根据反应体系与甘露醇标准样品的出峰面积进行定量分析。检测条件:Waters2695型高效液相色谱仪,Waters 示差折光检测器(RI),Sugar-PakTM钙离子色谱柱(10 μm,D7.8 mmol/L×300 mmol/L),流动相为0.22 μm 滤膜过滤后的超纯水,柱温85 ℃,流速0.6 mL/min。
1.4 数据处理
Clustal-Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/?tdsourcetag=s_pctim_aiomsg)和Espript(http://espript.ibcp.fr/ESPript/ESPript/)在线网址进行氨基酸序列比对分析。采用Origin 7.0 Pro进行试验数据图表分析,所有试验至少重复三次,结果表示为平均值±标准偏差。
2 结果和讨论
2.1 重组MDH的质粒构建和在E.coli BL21(DE3)中的表达
经测算重组基因片段全长1047 bp,可编码349个氨基酸,翻译蛋白理论相对分子质量为37.59 kDa(包含6个组氨酸)。经过重组蛋白的纯化步骤,将纯化的酶蛋白溶液进行SDS-PAGE蛋白电泳检测(图1),得到的蛋白条带单一,分子量大小约为37 kDa,与理论值基本一致,表明重组MDH成功表达,纯化效果较好。
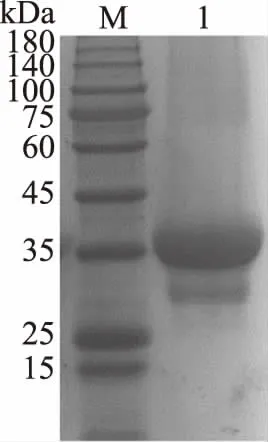
图1 重组MDH纯化后的SDS-PAGE电泳图
使用装备有紫外检测器的TSKgel G2000SWXL凝胶色谱柱,测定来自P.bacterium1109的MDH的蛋白全分子质量。绘制全分子质量的标准曲线(图2),根据标准曲线得出重组酶的全分子质量约为150 kDa,SDS-PAGE结果显示该酶的单亚基相对分子质量约为37 kDa,表明一个酶分子含有四个单亚基,推测该酶是一个四聚体结构。目前已报道来源于C.hydrothermalis[25]的MDH是唯一的二聚体结构,来源于L.mesenteroides[14]、R.sphaeroides[26]的MDHs是单体结构,来源于C.magnoliae[16]、T.neapolitana[20]、A.bisporus[27]的MDHs为四聚体结构,其中来源于C.magnoliae[16]、T.neapolitana[17]的MDHs单亚基相对分子质量与本实验的重组酶相近,为35~36 kDa。
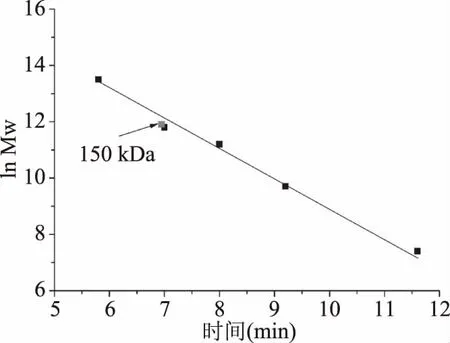
图2 重组MDH全相对分子质量
2.2 重组MDH的氨基酸序列分析
目前,已经有十多种来自不同微生物的MDH编码基因被克隆鉴定,并在NCBI官网中公布了蛋白质登录号。表1显示了来自不同微生物的MDHs的氨基酸序列同源性分析结果。来源P.bacterium1109的MDH和来源C.hydrothermali[25]的MDH有最高同源性(46.77%),其次与来源耐热菌T.maritima[19]、T.neapolitana[20]的MDH同源性分别为32.38%和32.59%。此外,来源P.bacterium1109的MDH和来源R.sphaeroides[18]的MDH的同源性最低(17.94%)。虽然P.bacterium1109来源的MDH与大多数MDHs的同源性较低(<40%),但通过氨基酸序列比对鉴定其仍显示出几个关键残基(图3)。例如,协调大多数中链MDH与Zn2+结合的残基(Cys37,His58,Glu59,Glu138,Cys142),催化残基(Cys84,Cys87,Cys90)和辅因子结合残基(Gly162,Gly164和Gly167),但通过P.bacterium1109 MDH与其它MDHs对比,发现R.sphaeroides[26]和P.fluorescens[20]的MDHs是例外,因为它们两者均属于长链MDH,不严格依赖Zn2+和其他金属辅因子,不同于其它多元醇脱氢酶。

图3 MDHs的氨基酸序列比对
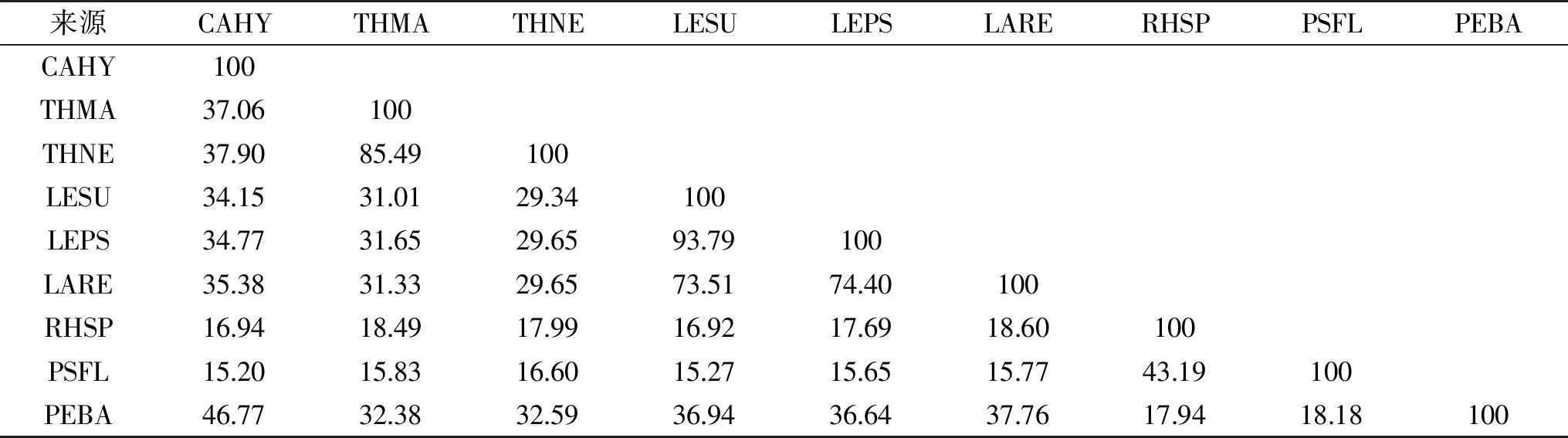
表1 不同来源MDHs的同源性对比(%)
大多数中链MDH都保留了用于协调金属离子结合(显示为黑色的向下箭头)和催化作用(显示为红色的向下箭头)和辅因子结合(显示为蓝色的向下箭头)的残基。
2.3 重组MDH的酶学性质鉴定
2.3.1 重组MDH的最适pH和pH稳定性 酶的催化活性受pH的影响很大。本文研究了来源于P.bacterium1109 MDH的酶活力在D-果糖还原和甘露醇氧化过程中受pH的影响。如图4,来自P.bacterium1109的MDH,当以D-果糖和甘露醇为底物时,最适还原、氧化pH分别为8.5和9.0,表明该酶在碱性条件下比其他MDH显示更高的活性,此外当以D-果糖为底物时,该酶在pH6.5的弱酸性条件下仍可保留接近50%的相对活性,表明该酶具有较宽的pH谱。在工业化大规模生产中往往要求酶具有宽的pH谱以适应体系环境的变化,在糖酶的催化反应中,略带酸性的环境可以有效抑制碳水化合物的美拉德(褐变)反应[28],防止产生非酶褐变和减少副产物的产生[29-30]。在本文研究中,来源P.bacterium1109的MDH在pH分别为6.0和6.5的弱酸性条件下,表现出相对较高的活性,这有利于其在甘露糖醇工业生产中的应用。
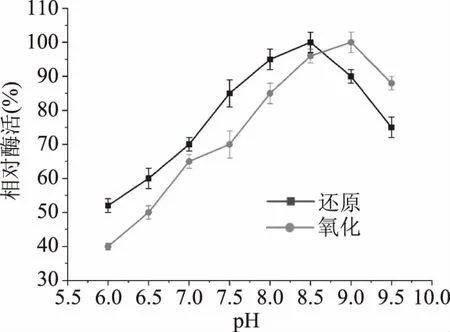
图4 pH对重组MDH催化活性的影响
由图5可知,重组酶在不同pH环境下的稳定特性。在长时间置于不同pH环境后,重组酶的活力变化不大,pH7.0条件下6 h,酶活为96%,pH8.0条件下6 h,保持92%的酶活力,在pH9.0环境下,酶活虽有下降,但6 h后仍能保持89%的活力,综上所述该酶有比较好的pH稳定性。
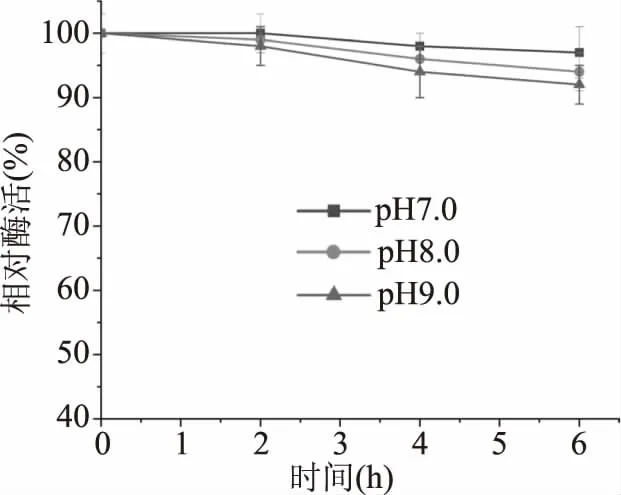
图5 重组MDH的pH稳定性
2.3.2 重组MDH的最适温度及温度稳定性 温度是影响酶催化效率的重要条件之一。如图6,来自P.bacterium1109的MDH,当以D-果糖和甘露醇为底物时,最适还原和氧化温度分别是80和85 ℃。当以D-果糖为底物时,在55~85 ℃间,该酶的催化活力随着温度的升高而逐渐增加。80 ℃时,酶活力达到最大。在70~90 ℃的范围内保持最大活性的70%以上,表明该酶可以在较宽的温度范围内发挥其催化活性。相较于其它来源的MDHs,大多数MDHs的最适温度都低于40 ℃,其中包括来源L.sanfranciscensis[10]、L.intermedius[11]和C.magnolia[16]的MDH,最适温度分别是35、35和37 ℃,然而来自Thermotoga的两个菌属T.maritime[19]和T.neapolitana[20]的MDH具有较高的最适温度,分别为95 和90 ℃(表4)。
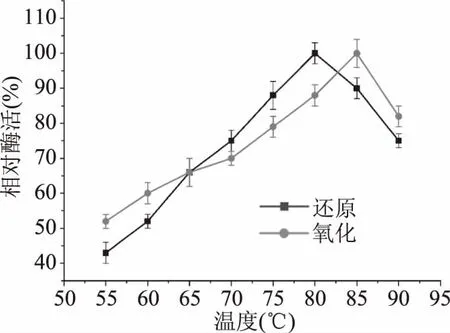
图6 温度对重组MDH催化活性的影响
由图7可知,75 ℃条件下温育6 h,保持大于80%的酶活。85和95 ℃条件下分别温育6和4 h,仍然能分别保持52%和48%的酶活。由表2可知,在75、85、90 ℃条件下,来自P.bacterium1109的MDH的半衰期分别为28.5、5.3、3.0 h,另外两个具有较高最适温度的MDH,来自于T.maritime[19]和T.neapolitana[20]的MDH的半衰期分别是1.0、0.5、0.25和24.6、2.0、1.6 h,相较而言,来自P.bacterium1109的MDH有更长的半衰期,热稳定性更好。综上所述,该酶的热稳定性较高,当酶在较高温度下进行长时间反应时,良好的热稳定性是实际应用中评估的重要标准。
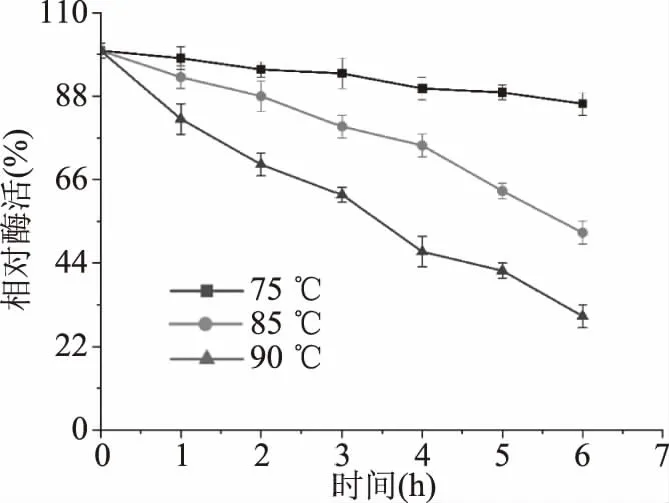
图7 重组MDH的热稳定性
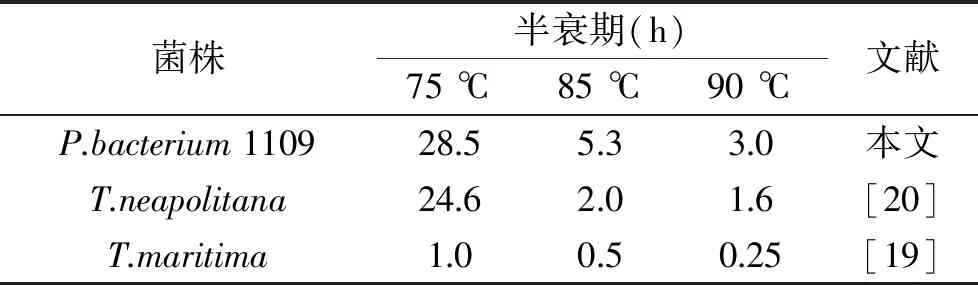
表2 三种耐热MDHs的热稳定性比较
2.3.3 重组MDH的金属离子的依赖性 金属离子在催化过程中通常作为辅助因子或激活剂,在酶的催化反应中起着非常关键的作用。在作用于单糖的氧化脱氢酶中,金属离子对酶的催化活力通常会有很大的影响[10]。本文研究了不同二价金属离子对重组MDH催化活力的影响(图8)。以纯化后经EDTA处理的原始酶作为对照组,可以看出,金属离子对酶的催化活力有比较大的影响。其中Cu2+、Zn2+、Ca2+、Mn2+都可以提高酶的催化活力,分别达到未添加金属离子酶活的160%、260%、150%、170%。同时发现,添加Mg2+、Ba2+、Ni2+对酶活产生了不同程度的抑制,添加Co2+对酶活没有显著影响(P>0.05)。
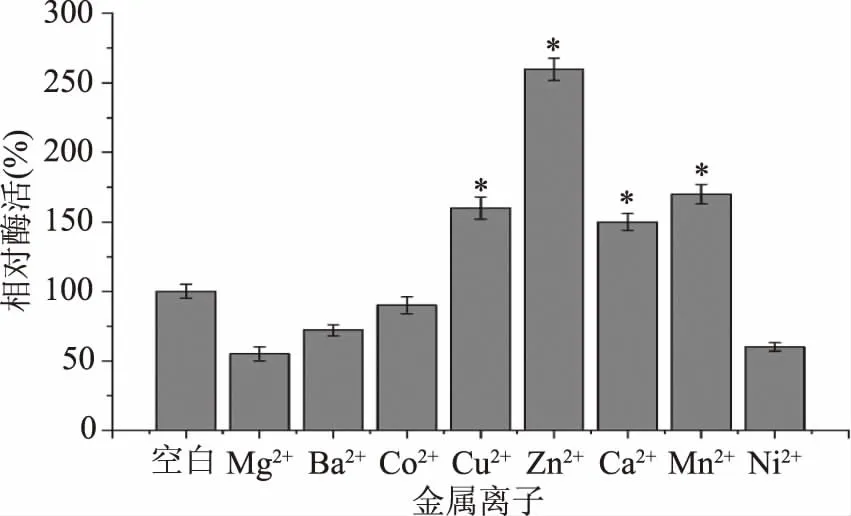
图8 金属离子对重组MDH催化活性的影响
MDH属于中链多元醇脱氢酶,之前的研究表明Zn2+可能对其的活性有很大的影响,通过测定来自C.herbarum[31]的MDH晶体结构,证实晶体中的一些关键残基被识别为金属离子结合位点。由表4可知,目前报道的大部分MDH对金属离子Zn2+有依赖型,Zn2+对酶的催化活力都有显著提高。然而来自P.fluorescens[17]和R.sphaeroides[18]的两个长链MDH没有显示出对金属离子的依赖性。在本文研究中,Zn2+极大增强了MDH的酶活力,这表明酶结构中可能存在金属离子的结合位点。
2.3.4 重组MDH的底物特异性研究 通过使用NADH和NAD辅因子,分别从还原和氧化两方面研究重组MDH的底物特异性(表3)。当提供不同的己糖作为底物时,重组MDH对D-果糖具有较高的还原活性,比酶活为97 U/mg,对D-阿洛糖的活性很小,相对活性为17%,而对其他己糖(D-塔格糖、D-木酮糖和L-山梨糖等)没有显示任何活性。当与不同的己醇反应时,重组MDH对D-甘露醇表现出最大的氧化活性,并且对D-阿拉伯醇表现出一定的催化能力,相当于最大活性的25%。此次研究证明了来自P.bacterium1109的MDH有很强的底物专一性,并且重组MDH对D-果糖的还原活性高于目前报道的大多数MDH(表4)。
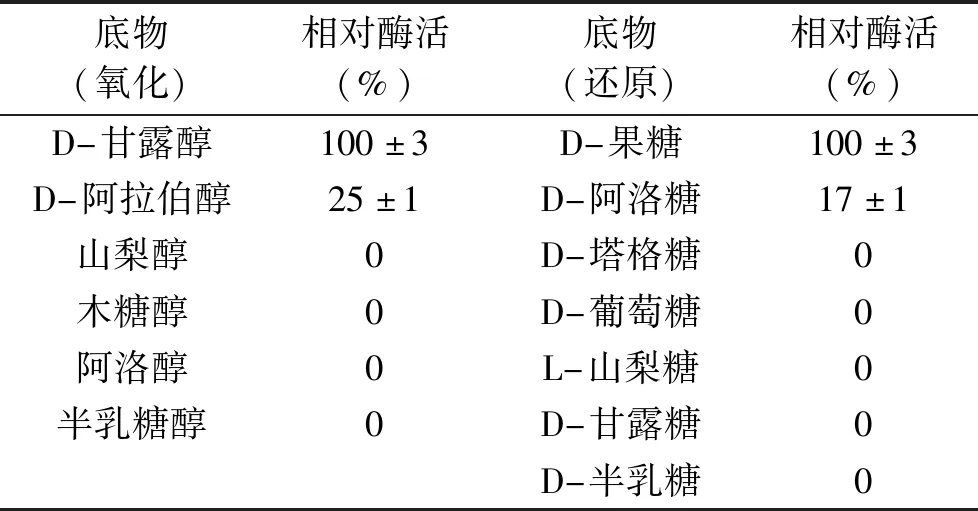
表3 重组MDH的底物特异性
2.3.5 重组MDH以D-果糖为底物的动力学参数测定 由表4可知,来自P.bacterium1109的MDH的Km值和kcat/Km值分别为20 mmol/L和7.5 L/(mmol·min)。相比而言,重组MDH和底物D-果糖的亲和程度高于大多数MDHs。就其催化性能而言,到目前为止,已经报道的MDHs中(表4),以D-果糖为底物来自P.bacterium1109的重组MDH的催化性能也高于大多数MDHs,已知来自L.pseudomesenteroides[15]的MDH比酶活表现最高的是450 U/mg,但是其非常不稳定,在20 ℃条件下48 h,丧失了60%的酶活。在这项研究中,考虑到来自P.bacterium1109的MDH在底物亲和度和催化性能表现出来的综合能力,表明它在D-果糖工业生产甘露醇中有很高的价值。
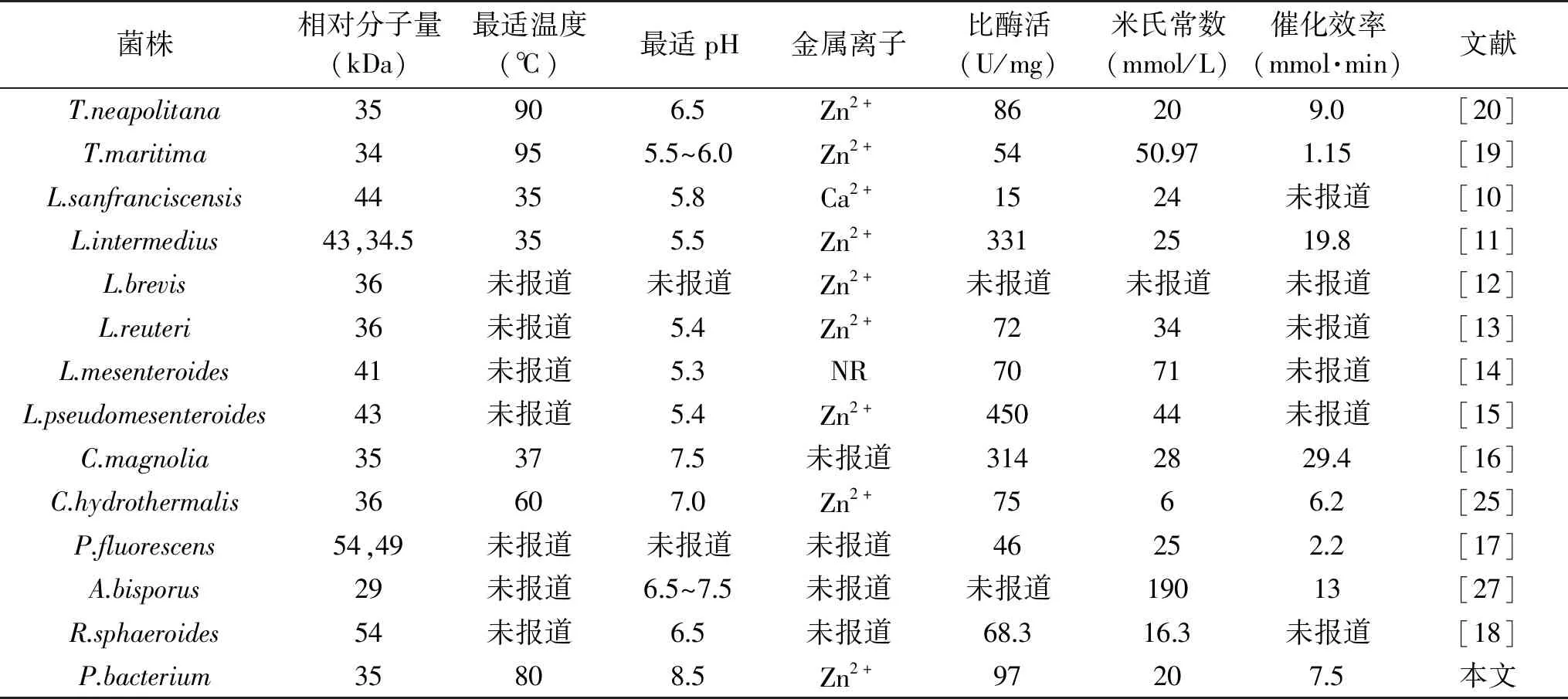
表4 不同来源MDHs的性质比较
2.3.6 重组MDH在甘露醇生产中的应用 研究甘露醇的转化结果表明(图9),在最适反应条件下,当以初始浓度100、200和400 mmol/L的D-果糖作为底物进行甘露醇转化过程中,产率随着时间的增加而增加,甘露醇的转化率在最初的1 h内急剧增加,最终以100 mmol/L的D-果糖作为底物产率达到95%,以200、400 mmol/L的D-果糖作为底物产率也分别达到80%以上。值得注意的是,上述三个不同D-果糖浓度的反应体系中,甘露醇的转化率都没有达到100%,目前尚无100%转化率的文献研究,例如,来自L.mesenteroides[14]的MDH以100 mmol/L的D-果糖作为底物生产甘露糖醇达到了95%以上的转化率,来自T.maritima[16]的MDH生产甘露糖醇的转化率最高达到了80%以上。推测可能是辅酶因子NADH的不可逆消耗[32]和酶活力降低等原因导致。
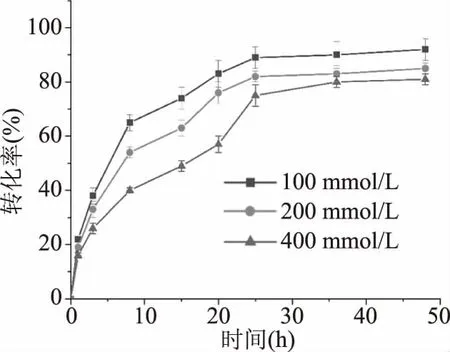
图9 甘露糖醇的生物转化
3 结论
本文鉴定了一株来源于耐热菌属P.bacterium1109的MDH,并可以应用于甘露醇的酶法合成。将来源于耐热菌属P.bacterium1109的MDH在大肠杆菌中表达,然后将表达的重组MDH目的蛋白进行分离纯化,进行酶学性质研究。以D-果糖为底物时,重组表达的MDH的酶活为97 U/mg。该重组MDH最适pH和温度分别是8.5,80 ℃,在碱性环境下有较好的热稳定性,在75、85、90 ℃条件下,来自P.bacterium1109的MDH的半衰期分别是28.5、5.3、3.0 h。Zn2+存在时可以极大提高MDH的酶活力。在重组酶底物特异性的研究中发现,该酶对底物D-果糖有较强的亲和力,并且具有相对窄的底物谱,底物专一性较高。在该酶的最适反应条件下,以400 mmol/L的D-果糖作为底物甘露醇产率达80%以上。总而言之,本文鉴定的重组MDH具有较高的热稳定性和底物专一性等特点,在工业生产甘露醇中有很大的应用前景。

