白扁豆非淀粉多糖的理化性质、抗氧化活性及其抑菌性能
尹术华,吴文英,宋也好,李 露,付王威,李文娟
(南昌大学食品学院,江西南昌 330047)
白扁豆(DolichoslablabL)又称藊豆、白藊豆和南扁豆,是一种豆科类植物,原产于印度、印度尼西亚等地,在汉、晋时期引入我国[1]。白扁豆具有较高的营养价值、味甘性温、对食欲低下、胸闷胃虚、醉酒呕吐等症状均具有良好的防治效果,在抗菌、抗肿瘤、抗氧化等方面均有重要的生理作用[2-3]。近年来,从白扁豆成熟种子中获得一种活性组分——白扁豆多糖,前期研究发现该多糖可通过上调bcl-2稳定线粒体膜通透性,保护神经细胞,减少细胞凋亡,抑制脑的缺氧性损伤[4-6]。史娟[7]采用超声波辅助提取方法对白扁豆多糖的提取条件进行优化并研究其特性。徐敏[8]以白扁豆多糖为研究对象,通过响应面法研究最佳提取条件。这些研究大多集中于对白扁豆粗多糖的提取优化,而对其化学成分分析、单糖组成及微观形貌特征等的研究却未见报道。
最近,非淀粉多糖在食品及生命科学领域被广泛关注[9]。非淀粉多糖是豆类的主要成分,传统观点认为其是影响豆制品营养有效利用的重要因素[10]。然而近几年,科学研究已证实,非淀粉多糖具有免疫调控、稳定血糖、调节血脂等活性功能及其在肠道中的益生元作用,是目前研究的热点[11]。白扁豆富含淀粉,但目前有关白扁豆非淀粉多糖(Non-starch Polysaccharide fromDolichoslablabL,NS-DLP)研究较少,尤其是对其理化性质的研究鲜有报道。因此本研究应用传统的热水浸提法提取白扁豆中水溶性多糖,采用酶解法结合Sevage法除去白扁豆水提物中的蛋白质和淀粉后,获得NS-DLP,并进一步开展该多糖的分子量、单糖组成、红外光谱分析、抗氧化活性以及抑菌性能的研究。
1 材料与方法
1.1 材料与仪器
白扁豆 安徽济顺中药饮片有限公司(食品级);L-鼠李糖、D-阿拉伯糖、D-甘露糖、D-半乳糖、L-岩藻糖、D-葡萄糖、半乳糖醛酸、维生素C、1,1-二苯基-2-三硝基苯肼(DPPH)、D-木糖、葡聚糖标准品 优级纯,纯度99.9%,美国Sigma公司;牛血清蛋白BSA 美国Amersco公司;咔唑、耐高温α淀粉酶(30万U)、碘化钾 上海阿拉丁生化试剂公司;考马斯亮蓝G-250 美国Fluka公司;木瓜蛋白酶(10万U) 北京索莱宝科技有限公司;糖化酶(5万U) 上海源叶生物科技有限公司。
Dionex ICS5000型离子色谱仪 美国Dionex公司;UPLC-1260高效液相色谱仪 美国Agilent公司;Nicolet5700傅里叶红外光谱仪、-80 ℃超低温冰箱 美国Thermo公司;TU1900紫外分光光度计 北京普析通用仪器责任有限公司;多功能酶标仪 美国BIORAD公司;Buchi R20-SE0旋转蒸发仪 瑞士Buchi公司;循环水真空泵 上海亚荣生化仪器厂;超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 NS-DLP提取工艺流程 白扁豆粉末→95%乙醇浸泡过夜→干燥并称重→热水浸提4 h过滤(提两次)→酶解→离心,浓缩→碘-碘化钾试剂验证淀粉→80%乙醇醇沉过夜→离心复溶→Sevage脱蛋白(重复四次)→除去有机试剂→透析→冷冻干燥→NS-DLP
1.2.2 NS-DLP提取关键步骤 以白扁豆为原料提取NS-DLP,把白扁豆粉碎成粉末状,95%乙醇浸泡过夜以脱色和除去部分醇溶性杂质,然后放置托盘于水浴锅上挥干乙醇称重备用。将称好的白扁豆粉末中加入水(按1∶10的比例),在90 ℃水浴中搅拌提取4 h,200目筛子过滤,保存滤液,取滤渣再提取一次,合并两次滤液。在滤液中加入3%耐高温淀粉酶,在90 ℃酶解30 min;然后加入3%木瓜蛋白酶,在65 ℃酶解30 min,再加入3%糖化酶,在65 ℃酶解30 min;最后100 ℃立即灭酶10 min。离心除去残渣,用碘-碘化钾试剂验证淀粉已经完全除去,旋转蒸发仪浓缩提取液,用80%乙醇醇沉过夜,然后离心,收集沉淀;离心所得沉淀复溶Sevage法脱蛋白四次,旋蒸除去有机试剂,分别采用流动水、蒸馏水、超纯水透析3 d,最后冻干得白扁豆非淀粉多糖(NS-DLP)。
1.2.3 NS-DLP理化性质分析
1.2.3.1 NS-DLP得率计算 称取m g白扁豆粉末,按照1.2.2所述工艺流程提取多糖,冻干后称得多糖质量为n g,则NS-DLP的得率(%)=(n/m)×100
1.2.3.2 化学成分分析 分别应用苯酚-硫酸法、考马斯亮蓝法和硫酸-咔唑法测得NS-DLP中的中性糖、蛋白质及糖醛酸的含量[12-13]。
1.2.3.3 HPGPC法测定NS-DLP相对分子量 将NS-DLP用0.02% NaN3配成1 mg/mL溶液,过0.22水系滤膜,采用HPGPC法测定NS-DLP的相对分子量。选择 UltrahydrogelTM Linear Column色谱柱,流动相:0.02% NaN3。检测器检测温度和柱温均设置为35 ℃。流速为0.6 mL/min,进样量为20 μL。各葡聚糖(Dextran)标准品用超纯水配制成1 mg/mL的溶液;按上述色谱条件分析,每个样品平行进样3次。以保留时间为横坐标,分子量的常用对数为纵坐标作图。通过已知标准分子量的标准品,计算待测样品的分子量。葡聚糖标准品的标准曲线为lgMw=-0.6136x+13.436(R2=0.9894)。
1.2.3.4 NS-DLP单糖组成分析 参照文献[14]采用硫酸水解并结合高效阴离子交换色谱串联脉冲安培检测器(HPAEC-PAD)分析NS-DLP的单糖组成情况。称取多糖样品5 mg于具塞试管中,冰浴下加入12 mol/L的硫酸0.5 mL,室温下搅拌30 min,然后加水将硫酸稀释至2 mol/L,转移至100 ℃油浴中水解2 h。水解完全后,取出,迅速用冷水冷却,将水解液稀释50~100倍,过0.22 μm微孔滤头,进样。所有实验平行三次。
色谱条件:采用CarboPac PA20分析柱((3 mm×150 mm Dionex,CA))和CarboPac PA20保护柱(3 mm×30 mm Dionex,CA)串联使用。流动相A为250 mmol/L NaOH溶液,B为超纯水,C为1 mol/L NaOAc溶液,梯度洗脱,流速为0.5 mL/min。柱温为30 ℃,系统温度25 ℃;检测方式为脉冲安培检测,工作电极金电极,参比池为钯/氢((Pd/H)参比电极,进样量10 μL,采用Dionex,Chromeleon 6.80软件采集数据。单糖标品(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡萄糖醛酸)配成不同浓度的混标,采用相同的色谱条件进行分析,用于判断样品中单糖和糖醛酸的种类和含量。
1.2.4 红外光谱扫描 取干燥的NS-DLP样品适量与适量KBr混合,光照下研磨使二者混合均匀并制成片状,在4000~400 cm-1条件下用红外光谱仪进行扫描[15]。
1.2.5 NS-DLP的电镜扫描测试 采用离子溅射镀膜法制备NS-DLP多糖样品,在10 kV加速电压下进行扫描分析并采集不同倍速下的照片,观察多糖表面的形态[16]。
1.2.6 NS-DLP抗氧化实验
1.2.6.1 NS-DLP对DPPH自由基的清除能力 参考文献[17-18]稍做改动,配制浓度为6.4、3.2、1.6、0.8、0.4 mg/mL的NS-DLP溶液。以抗坏血酸(5.6、2.8、1.4、0.7、0.35 mg/mL)为对照。取2 mL浓度为0.04 mg/mL的DPPH溶液加入10 mL的EP管中,然后加入2 mL样品溶液,充分混匀,在室温下静置30 min后移取300 μL至96孔板,在517 nm下测定吸光度值。
实验分为样品组、对照组、空白组。样品组:取2 mL DPPH溶液,加入1 mL NS-DLP/VC及1 mL乙醇加入10 mL EP管中,充分混匀,在室温下避光静置30 min后移取300 μL至96孔板,在517 nm下测定吸光度值A2。对照组:取2 mL乙醇,加入1 mL NS-DLP/VC待测液及1 mL乙醇加入具塞试管中,充分混匀,在室温下避光静置30 min后移取300 μL至96孔板,在517 nm下测定吸光度值A1;空白组:测定2 mL DPPH溶液与2 mL无水乙醇混合液的吸光度A0,根据下列公式计算DPPH自由基清除率。
I(%)=[1-(A2-A1)/A0]×100
式中:I表示清除率;A2为2 mL DPPH溶液+1 mL NS-DLP/VC+1 mL乙醇的吸光度值;A1为2 mL乙醇+1 mL NS-DLP/VC+1 mL乙醇的吸光度值;A0为2 mL DPPH溶液+2 mL无水乙醇的吸光度值。
1.2.6.2 NS-DLP对OH自由基的清除能力测定 参考文献[19-20],制备NS-DLP溶液:6.4、3.2、1.6、0.8、0.4、0.2 mg/mL,以抗坏血酸(5.6、2.8、1.4、0.7、0.35、0.175 mg/mL)为对照。步骤:精确吸取6 mmol/L FeSO4溶液1 mL、6 mmol/L水杨酸溶液1 mL、待测液(NS-DLP/VC)1 mL,置于10 mL的EP管中,摇匀;混匀后加入1 mmol/L H2O2溶液1 mL,置于37 ℃恒温水浴中反应60 min后,移取300 μL至96孔板,在波长510 nm处测定吸光度,根据下列公式计算NS-DLP的羟基自由基清除率:
I(%)=[1-(A1-A2)/A0]×100
式中:A1:待测样品的吸光度;A2:用水代替H2O2的待测样品的自身吸光度值;A0:为不加待测样品空白对照的吸光度值。
1.2.7 NS-DLP的抑菌实验
1.2.7.1 供试菌的活化及菌悬液的制备 采用牛肉膏蛋白胨培养基和马丁培养基[21]分别研究NS-DLP对细菌:大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)、志贺氏菌(Shigella)和李斯特菌Listeria)及霉菌:青霉(Penicillium)的影响[22]。活化上述细菌和霉菌:供试菌置于斜面培养基,细菌37 ℃活化24 h,霉菌28 ℃下活化48 h。精挑菌苔于无菌水中,采用比浊法制备成108cfu/mL的菌悬液。
1.2.7.2 NS-DLP对供试菌的最小抑菌浓度(MIC)的测定 配制80 mg/mL的白扁豆多糖溶液,用两倍法稀释多糖液浓度,形成40、20、10、5 mg/mL 5个浓度梯度。采用滤纸片法,即用100 μL各供试菌悬液涂布于平板培养基,取浸泡于多糖溶液2 h的直径6 mm灭菌滤纸片置放于平板上,每平板放3片,细菌平板置37 ℃培养24 h,霉菌置28 ℃培养48 h,观察NS-DLP的抑菌情况,检测该多糖对供试菌的最小抑菌浓度(MIC)[23-24]。以无菌水和苯甲酸钠作为对照。
1.3 数据处理
本实验中的数据分析应用软件为OriginPro 8,SPSS Statistics V17.0。
2 结果与分析
2.1 NS-DLP基本化学成分分析
经脱蛋白和酶解之后冷冻干燥的NS-DLP为米白色易溶于水的蓬松粉末。本实验制得的白扁豆非淀粉多糖得率为0.9%,其多糖得率相对于其他豆类多糖的得率较低。如张旭娜[25]提取的鹰嘴豆多糖得率1.36%,曹楠楠等[26]提取的苦豆子多糖得率8.51%。而本文NS-DLP得率低,部分原因与脱蛋白过程和酶解损耗有关。经测定可知NS-DLP中的中性糖含量较高,达63.77%±0.01%,糖醛酸含量为16.86%±0.02%,则NS-DLP中总糖含量为80.63%,同时含有少量的蛋白质(4.65%±0.01%)。
2.2 NS-DLP相对分子量结果分析
NS-DLP相对分子量测定结果如图1所示,由图1可以看出,在13~20 min内,该多糖出现了两个峰,其中主要组分出峰时间是13.66 min,第二个组分的出峰时间是14.805 min。用不同分子量的一系列葡聚糖标准品进样后得到的标准曲线为lgMw=-0.6136x+13.436(R2=0.9894),通过标准曲线法计算出NS-DLP第一个组分的分子量为2.3×105Da,第二个组分的分子量为2.2×104Da。
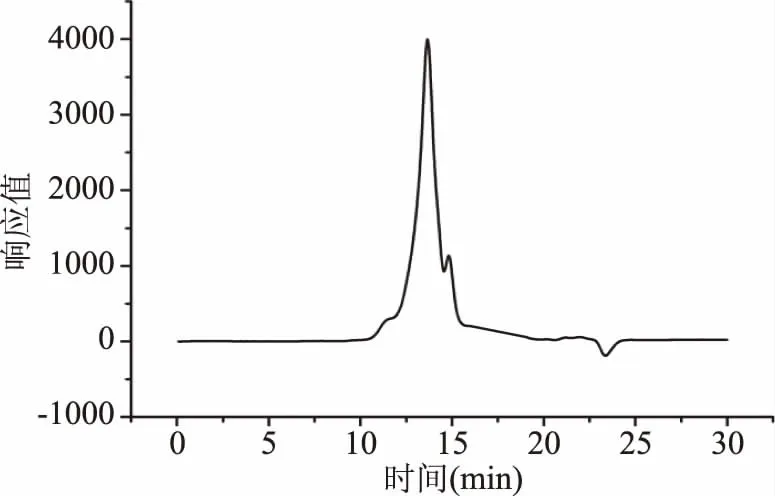
图1 NS-DLP的高效液相图谱
2.3 NS-DLP单糖组成结果
NS-DLP进行单糖组成分析,由图2结果显示,NS-DLP单糖组成由葡萄糖、鼠李糖、半乳糖醛酸、半乳糖、木糖、阿拉伯糖组成,质量百分含量分别为:23.23%、6.2%、5.09%、2.76%、2.4%、0.48%,其中葡萄糖、鼠李糖、半乳糖醛酸为主要单糖,且葡萄糖含量最高,这表明NS-DLP的主要组成为葡聚糖,可为后续对其结构解析提供一定的参考价值。

图2 混合单糖标准和NS-DLP的单糖组成色谱图
2.4 NS-DLP红外图谱分析
NS-DLP的红外光谱分析如图3显示,NS-DLP的红外谱图在3400~3500 cm-1有明显宽峰,这是由羟基O-H的伸缩振动产生的,而2933 cm-1处的峰为C-H键的伸缩振动形成的;NS-DLP在1400~1200 cm-1的特征峰是C-H的变角振动引起的,这些特征峰表明NS-DLP归属于多糖[27]。1240 cm-1处的吸收峰是由羧基中O-H的变角振动产生的,显示NS-DLP中含有糖醛酸。同时,NS-DLP在1649 cm-1处的峰是由N-H的变角振动和C=O的非对称伸缩振动引起的,推断样品有少量的结合蛋白。此外,在950~1200 cm-1处的峰是吡喃环特征吸收峰,且在671 cm-1处发现有一个吸收峰,表明NS-DLP有β-糖苷键。
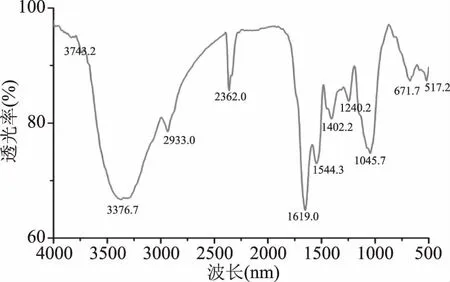
图3 NS-DLP的红外图谱
2.5 NS-DLP的电镜扫描结果
本实验采用SEM表征NS-DLP的表观形貌。如图4所示,NS-DLP在不同倍数下,其表面微观形态呈现出明显的片状。放大100倍的结构如图4a所示,NS-DLP呈不规则的几何外形,表现为片状,碎屑状分布。从进一步放大1000倍的图4b中可以看出NS-DLP表面凸凹不平,带有孔洞的褶皱结构,且4b图中还可看到NS-DLP片状结构上有一些规则纹理,结合参考文献[28]推断NS-DLP在聚集时具有一定的方向性。

图4 NS-DLP扫描电镜图片
2.6 NS-DLP抗氧化活性分析
2.6.1 NS-DLP对DPPH自由基清除能力 NS-DLP对自由基的清除能力用清除率表示,清除率越高则NS-DLP对自由基的清除能力越好。NS-DLP和阳性对照VC对DPPH自由基的清除能力如图5A所示。NS-DLP处于低浓度0.4 mg/mL时,其抗氧化能力很弱,对DPPH自由基的清除率只有5.26%±1.74%;当NS-DLP组浓度由0.4 mg/mL增加到6.4 mg/mL时,NS-DLP对DPPH自由基的清除效率为21.20%±1.33%。低浓度时NS-DLP对DPPH自由基的清除能力明显弱于VC,随着NS-DLP浓度增加,其清除率有一定增加的趋势,但是增加水平有限,这说明NS-DLP对DPPH自由基的清除能力较弱。
2.6.2 NS-DLP对OH自由基的清除能力 生物体受到理化因子的损伤,会在机体内产生多种自由基,如OH自由基,它能和体内大分子发生反应从而造成过氧化损伤。OH自由基产生过程为:Fe2++H2O2→Fe3++·OH+OH-,研究表明在反应中加入水杨酸可清除OH自由基,反应生成物在510 nm处有强吸收峰,因此可以通过吸收峰值判定抗氧化剂清除OH自由基的能力。NS-DLP对OH自由基的清除率如图5B所示,NS-DLP处于低浓度0.2 mg/mL时,其抗氧化能力很弱,对OH自由基的清除率只有4.55%±1.79%;当NS-DLP浓度由0.2 mg/mL增加到6.4 mg/mL时,NS-DLP对OH自由基的清除率为44.43%±2.41%。低浓度时NS-DLP对OH自由基的清除能力明显弱于VC,随着NS-DLP浓度增加,其清除率明显增加,这说明NS-DLP具有较好的清除OH自由基的能力。NS-DLP对自由基的清除效率与浓度呈现剂量依赖关系,这些数据显示NS-DLP对OH自由基具有一定的清除能力,对比2.6.1可以看出NS-DLP对OH自由基的清除率比对DPPH自由基的清除率高,这可为白扁豆以后的产品开发与利用提供理论依据。
2.7 NS-DLP抑菌试验结果
2.7.1 NS-DLP对供试菌最小抑菌浓度(MIC)的测定 NS-DLP对细菌的MIC见表1所示,NS-DLP对志贺氏菌和枯草芽孢杆菌的MIC为20 mg/mL,NS-DLP对大肠杆菌的MIC为40 mg/mL,而对于李斯特菌表现出的MIC则较低,只有10 mg/mL,此外,不同浓度下的NS-DLP对青霉都未有出现抑菌效果,这说明NS-DLP对细菌有抑制作用,对霉菌没有抑制作用。
2.7.2 NS-DLP对细菌的抑菌效果分析 通过观察抑菌圈的存在与否及其直径大小判定NS-DLP的抑菌作用,NS-DLP对细菌的抑菌作用见表2。从表2中可以得出,NS-DLP对4种细菌的抑菌作用不同,NS-DLP在李斯特菌中体现出最明显的抑菌圈,抑菌圈直径达到11.23 mm,在大肠杆菌中次之,抑菌圈直径为10.23 mm,NS-DLP对枯草芽孢杆菌和志贺氏菌的抑制作用较差,这四种细菌的抑菌效果都随着NS-DLP浓度的升高而增强,即NS-DLP浓度与抑菌效果呈正相关。同时,阳性对照组苯甲酸钠测定显示其对李斯特菌的抑制效果最好,抑菌圈直径达到34.35 mm,对枯草芽孢杆菌的抑制效果次之,抑菌圈直径为24.35 m。这些结果显示多糖对细菌的抑制效果相较于苯甲酸钠较弱。
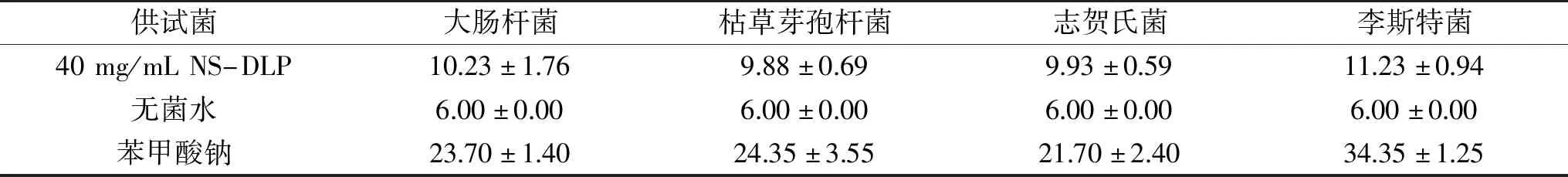
表2 40 mg/mL NS-DLP溶液对细菌的抑菌直径(mm)
3 结论
本研究以白扁豆为原料,通过热水浸提,并应用酶解法结合Sevage脱蛋白,得到非淀粉多糖NS-DLP,进一步对其理化性质、抗氧化性及抑菌性能进行研究。实验结果表明NS-DLP的中性糖含量较高(63.77%±0.01%),糖醛酸含量为16.86%±0.02%,还含有少量的蛋白质(4.65%±0.01%)。NS-DLP为一类分子量在2.3×105Da的以葡萄糖为主的杂多糖;且单糖组成分析结果表明NS-DLP主要含有葡萄糖、鼠李糖和半乳糖醛酸。红外分析结果显示NS-DLP中含有明显的多糖特征官能团结构,且电镜扫描结果显示该多糖表面微观形貌为片状,聚集时具有一定的方向性。同时,抗氧化实验数据显示:NS-DLP具有一定的抗氧化活性,抗氧化活性与该多糖呈现量效关系,与浓度成正比;但对不同自由基,其相应的清除能力有差异。此外NS-DLP的抑菌试验结果表明NS-DLP具有一定的抑菌效果,在枯草芽孢杆菌、志贺氏菌、李斯特菌以及大肠杆菌这四种菌中,NS-DLP对李斯特菌的抑制效果最强,对另外三种菌的抑制较弱。研究结果表明 NS-DLP具有一定的抗氧化性及抑菌性能,可为增加白扁豆的附加值提供依据,为诠释白扁豆的活性功能与高效开发利用白扁豆提供参考。

