S-TACE联合阿帕替尼对中晚期原发性肝癌患者肿瘤血管因子、肝功能和预后的影响
徐新宝 殷杰 吉浩明 钱俐
原发性肝细胞癌(HCC)起病隐匿,进展迅速,恶性程度高,早期诊断较困难,大多患者确诊时已处于疾病的中晚期,失去最佳手术时机,5年的生存率往往低于20%[1]。超选择性肝动脉化疗栓塞术(S-TACE)通过对肿瘤供血动脉的超选择性化疗栓塞,引起病灶组织缺血坏死,阻止和缩小病灶,以创伤轻、精准度和安全性高等优点,已成为HCC非手术治疗的首选方法[2]。但S-TACE术后肿瘤组织缺氧状态下可促使肿瘤细胞因子和血管内皮生长因子等异常表达,诱发肿瘤血管增殖和侧枝循环形成,增加肿瘤复发和转移的风险,影响疾病预后[3]。阿帕替尼是首个小分子抗血管生成靶向药物,可抑制血管内皮细胞生长因子受体-2(VEGFR-2)的磷酸化,抑制肿瘤血管生成治疗完全胃癌,并逐渐成功应用于中晚期HCC患者TACE术后的辅助治疗中[4]。近年来,我们对中晚期HCC患者采用S-TACE联合阿帕替尼治疗,观察其抗肿瘤效果,报道如下。
资料与方法
一、一般资料
选择2017年1月至2018年9月收治的72例中晚期HCC患者,纳入标准[5]:临床确诊为HCC,失去手术时机或患方不愿意手术治疗;未行手术、介入和放化疗等治疗,预期生存期>3个月;BCLC分期B期和C期;患者知情同意,医学伦理批准。排除标准:恶液质期,远处转移,大量腹水;介入和药物治疗禁忌症,凝血功能障碍,意识、精神异常不能配合研究等。根据数字表示法将患者分成观察组和对照组,每组36例。观察组中男性26例,女性10例;年龄41~75岁,平均(58.74±6.18)岁;肿瘤直径 3.4~8.2 cm,平均(5.68±0.52)cm;BCLC分期B期31例,C期5例。对照组中男性25例,女性11例;年龄42~75岁,平均(58.39±6.12)岁;肿瘤直径 3.3~8.1 cm,平均(5.62±0.54)cm;BCLC分期B期30例,C期6例。两组一般资料比较,具可比性(P>0.05)。
二、研究方法
(1)对照组:给予S-TACE治疗[6]:患者仰卧,行右侧股动脉处穿刺置入手术器械,造影观察病灶和确定治疗方案,缓慢注入由奥沙利铂、吡柔比星和5-氟尿嘧啶等组成的碘化油乳剂,根据造影结果按需给予合适的栓塞剂。再采用PVA明胶海绵颗粒栓塞供血动脉近端,观察其血流停滞和门静脉小分支局部显影,结束手术。术后给予异甘草酸镁和丁二磺酸腺苷蛋氨酸抗炎保肝和支持对症治疗。(2)观察组:联合阿帕替尼(厂商:恒瑞医药;国药准字:H20140103;规格:250 mg/片)治疗。术后第1天开始每次500 mg,餐后半小时顿服,4周为1个周期。如果出现手足综合征、粒细胞缺乏、蛋白尿等严重不良反应时可减量至每天250 mg,待症状缓解后恢复原剂量;减量超过2周则于下一周期的S-TACE术后4天继续服用[7]。3个周期为1个疗程。
三、观察指标
(1)生化指标:于治疗前和疗程结束后,采用酶联免疫吸附法检测VEGFR2、基质金属蛋白酶(MMP-9)水平,流式细胞仪检测半胱氨酰天冬氨酸蛋白酶8(caspase-8)水平等肿瘤血管因子指标。采用全自动生化分析仪,测定甲胎蛋白异质体(AFP-L3)、血清丙氨酸氨基转移酶(ALT)和乳酸脱氢酶(LDH)等肝功能水平。(2)疗效指标:统计客观缓解率(ORR)、疾病控制率(DCR)、中位肿瘤进展时间(MTTP)、中位总生存时间(MOS)等指标。(3)安全性指标:观察肝区疼痛、发热、恶心呕吐和食欲下降等栓塞后综合征发生率,以及手足综合征、高血压、皮疹、蛋白尿、腹泻等药物不良反应。
四、统计学方法
采用SPSS 22.0软件处理,计量和计数资料以和(n,%)表示,组间用t检验和χ2比较。P<0.05为差异有统计学意义。
结 果
一、肿瘤血管因子指标的比较
治疗前两组的VEGFR2、MMP-9和caspase-8水平比较无差异(P>0.05);疗程结束后,观察组均较对照组改善(P<0.05)。见表1。

表1 两组肿瘤血管因子指标的比较
二、肝功能指标的比较
治疗前两组的AFP-L3、ALT和LDH比较无差异(P>0.05);疗程结束后,观察组均较对照组下降(P<0.05)。见表2。

表2 两组肝功能变化的比较
三、疗效指标的比较
观察组的ORR和DCR高于对照组,MTTP和MOS大于对照组,有统计学意义(P<0.05)。见表3。
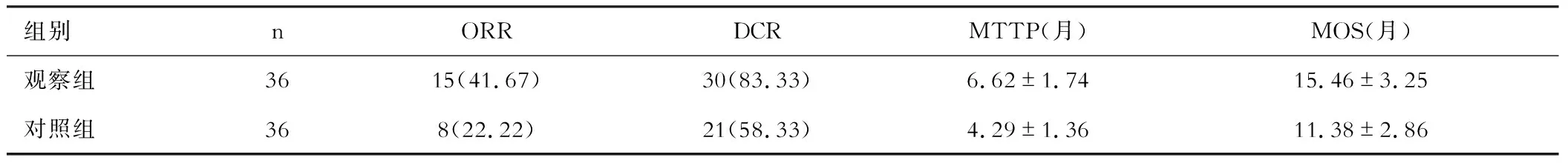
表3 两组疗效指标的比较
四、安全性指标的比较
两组均发生数例肝区疼痛、发热、恶心呕吐和食欲下降等栓塞后综合征,经处理后缓解;观察组为23例(63.89%),对照组为21例(58.33%),组间无统计学意义(χ2=0.946,P=0.382)。两组均发生数例手足综合征、高血压、皮疹、蛋白尿、腹泻等药物不良反应,无骨髓抑制、粒细胞缺乏和药物过敏等严重反应;观察组为15例(41.67%),对照组为10例(27.78%),组间有统计学意义(χ2=1.529,P=0.043)。
讨 论
S-TACE对供血动脉超选择造影和精准治疗,术中可避免遗漏病灶侵袭造成的动静脉瘘,提高栓塞治疗的成功率,对肝脏的损伤较小,副损伤较少[2]。但是肝脏肿瘤病灶组织在血供被阻断后,长时间处于缺血缺氧的状态,会促使肿瘤刺激因子、肿瘤细胞因子和血管内皮生长因子的异常表达,诱导血管内皮细胞增殖和肿瘤新生血管,促进了病灶周围出现代偿性侧支循环,从而增加了病灶转移和复发的概率[8]。因此,对于行TAC治疗的HCC患者,术后应用抗血管生成药物进行联合治疗,可抑制肿瘤血管新生,提高治疗效果。
在肝癌的发生、发展、转移和复发过程中,肿瘤新生血管的形成是最关键的步骤,VEGFR是高特异性和强效的血管生成调控因子[9]。其中VEGFR-2是最重要的亚型,促进新生血管生成和调节淋巴细胞的迁移,与肝癌的发展和转移密切相关,被认为是抗肿瘤血管新生的重要靶点[6]。MMP-9通过酶原激活、基因转录和内肽酶作用,能水解多种细胞外基质(ECM)成分,是MMPs家族中很重要的降解ECM的生理性调节因子,在消化道肿瘤的异常表达,与肿瘤的浸润、分期和转移密切相关[10]。caspase-8是死亡受体介导的外源性细胞凋亡途径中关键的启动子,通过诱发级联反应在肝癌细胞凋亡中发挥重要作用,抑制肝癌细胞的生长和迁移[11]。翁志成等[6]对中晚期HCC行S-TACE治疗的患者联合阿帕替尼口服治疗,S-TACE通过化疗药物栓塞肝脏肿瘤的血供动脉,使病灶内的组织细胞缺血缺氧坏死,阻止或延缓肿瘤生长;阿帕替尼改善了S-TACE术后肿块局部缺血缺氧环境,高选择性抑制VEGFR-2自动磷酸化,降低了VEGFR2和MMP-9的表达水平,抑制新生血管的形成和肿瘤生长及迁移,提高了中晚期HCC患者的临床获益率。吴发宗等[11]对不可手术切除的中晚期肝癌患者给予TACE治疗的同时联合阿帕替尼治疗,降低了VEGF表达水平,抑制肝脏肿瘤血管的再生能力;同时升高了caspase-8的表达水平,增加了增加肿瘤细胞的凋亡,提高了疾病控制效果。在本研究中,观察组患者在S-TACE术后即给予阿帕替尼口服治疗3个周期后,VEGFR-2和MMP-9的表达水平明显降低,caspase-8的表达明显升高(P<0.05),显著抑制了肝脏肿瘤的新生血管和ECM形成,控制了肿瘤的生长和浸润。
AFP-L3是由癌变的肝细胞产生,在HCC患者的血清中异常表达,特异性显著高于AFP,可作为独立的肝癌预后标志物[12];ALT是反映肝细胞损伤程度的最敏感指标,LDH在肝癌时活性明显升高,是HCC患者治疗效果的预测因子[12]。阿帕替尼能高选择性竞争肿瘤细胞内的VEGFR-2的ATP结合位点,阻断其下游信号的转录传导,有效抑制肿瘤新生血管的形成[13]。吴彦彦[12]对中晚期HCC患者采用TACE联合阿帕替尼治疗,调控了新生血管的生成,抑制了肿瘤细胞的增殖,AFP-L3水平显著下降,缩小了肝脏肿瘤的直径,降低了ALT和TBiL等肝功能指标。温时来[14]对晚期肝癌患者给予口服阿帕替尼治疗3个月后,ORR、DCR和生存期等疗效指标明显优于对照组,LDH和AFP等肝功能水平较治疗前显著降低,收到满意的临床治疗效果。在本研究中,观察组的AFP-L3、ALT和LDH等肝功能指标较治疗前和对照组改善(P<0.05),缩小了肿瘤直径,降低了肿瘤的转移和复发概率;观察组的ORR和DCR高于对照组,MTTP和MOS大于对照组(P<0.05),显著提高了患者的临床获益率,改善了疾病预后。
阿帕替尼可抑制VEGFR-2传导通路,可能会损害真皮血管,约在服药3周时发生手足综合征和皮疹[15];抑制血管增殖作用可使外周血管阻力增大,同时介入治疗和长期服药可能增加患者的心理负担,可发生血压升高现象;抑制肾血管的舒张能力,降低肾小球的通透性,出现蛋白尿现象[16]。翁志成等[6]对中晚期HCC行S-TACE治疗的患者加用阿帕替尼口服治疗,手足综合征、高血压和蛋白尿等发生率均高于对照组,恶心呕吐、发热、腹泻等发生率与对照组无差异,经对症处理后均得到缓解,对疗程未产生明显影响,用药安全性得到保障。在本研究中,两组患者的栓塞后综合征比较无差异(P>0.05),观察组的药物不良反应高于对照组(P<0.05),经保持皮肤湿润、减少刺激、心理调节、利尿降压,以及减少剂量等处理后,上述症状均得到缓解;两组均未发生骨髓抑制、粒细胞缺乏和药物过敏等严重反应,经观察阿帕替尼的用药安全性相对较高。
综上所述,对中晚期HCC 患者采用S-TACE联合阿帕替尼治疗,可调节肿瘤血管因子水平,抑制肿瘤新生血管形成,减少复发和转移,控制和缩小肿瘤体积,改善肝脏功能,提高临床获益率,安全性较高。

