燕麦β-葡聚糖对小麦淀粉回生特性的影响
沈 军,王 林,邹恩坤
1.无锡中粮工程科技有限公司 (无锡 214035)
2.中粮面业(泰业)有限公司 (泰兴 225400)
随着主食工业化进程的加快,以稻谷或小麦为原料制作的米面等制品已普遍采用冷链(通常低于4 ℃)进行储藏和配送。淀粉作为小麦粉和大米的主要营养组分,不仅具有半结晶颗粒结构、糊化胶凝性等特点,同时其糊化后的凝胶还具有在低温条件下易发生分子链重排的现象(即回生特性),而这种独特的回生特性已被证实是导致米面制品在低温储存过程中口感变差、品质劣变的主要因素[1-3]。因此,如何通过科学的技术手段来控制米面制品的回生成为主食工业化生产中亟待解决的关键问题。
燕麦β-葡聚糖是一种存在于燕麦籽粒糊粉层和亚糊粉层的植物多糖,其分子链主要是由D-葡萄糖单元通过β-1,3和β-1,4糖苷键混合连接而成。目前,国内外普遍认为燕麦的诸如降低胆固醇、提高免疫力、降低血糖等功能特性主要与其所含的β-葡聚糖的高黏度特性有关[4,5]。此外,燕麦β-葡聚糖的高黏度、高持水性以及乳化稳定性使其具有优越的加工特性,也是一种理想的食品添加剂。因此,研究β-葡聚糖对于小麦淀粉回生特性的影响将有利于米面制品的工业化生产。基于此,本文考察了不同分子量的燕麦β-葡聚糖对小麦淀粉回生特性的影响,旨在从分子角度阐述燕麦β-葡聚糖与小麦淀粉间的相互作用,从而为控制小麦淀粉回生提供思路和理论依据。
1 材料与方法
1.1 原料与试剂
小麦淀粉,实验室自制;燕麦β-葡聚糖(纯度70%),购自张家口一康生物科技有限公司;二甲亚砜(DMSO),色谱纯;其余试剂均为分析纯。
1.2 实验仪器
快速黏度仪(RVA-TecMaster),瑞典Perten公司;Haake-RS6000旋转流变仪,德国Thermofisher公司;Q20差示扫描量热仪(DSC),美国TA公司;高效液相色谱仪(HPLC)和示差检测器(RI),美国Agilent公司;多角度激光检测器(MALLS)和,美国Wyatt公司。
1.3 实验方法
1.3.1酸解法制备不同分子量的β-葡聚糖
采用盐酸水解法制备不同分子量的燕麦β-葡聚糖,具体步骤如下:配置1%(w/v)的β-葡聚溶液,60 ℃水浴振荡混合2 h后加入1mol /L HCl溶液,使HCl浓度为0.2 mol/L,待反应一段时间后加入4 mol/L NaOH溶液,冰水浴15 min终止反应;然后无水乙醇进行沉淀,离心, 40 ℃热风干燥沉淀,得到不同分子量的β-葡聚糖,分别记为0 min-β-葡聚糖、30 min-β-葡聚糖、60 min-β-葡聚糖。
1.3.2β-葡聚糖分子量的测定
将不同分子量的β-葡聚糖样品溶于含0.05 mol/L LiBr的DMSO溶液,配制适宜浓度,过0.45 μm有机滤膜,上样至HPSEC-MALLS-RI系统进行测定,相关数据采用ASTRA6.0软件分析。
1.3.3β-葡聚糖-小麦淀粉混合物的制备
不同分子量的燕麦β-葡聚糖分别按照1%、2%、3%的比例取代小麦淀粉,充分混合均匀制备不同比例的β-葡聚糖/小麦淀粉混合物(D/WS),并以WS作为空白对照。
1.3.4β-葡聚糖-小麦淀粉混合物的糊化特性测定
参照GB/T 24853—2010的方法测定β-葡聚糖-小麦淀粉混合物的糊化特性,每个样品均测试3次。
1.3.5淀粉凝胶短期回生特性的测定
β-葡聚糖对小麦淀粉凝胶短期回生特性的影响以测定淀粉凝胶的流变学性质来表征,具体内容参照张晓宇[6]的方法,稍作修改。
(1)温度扫描测试:配置浓度为10%的样品悬浮液,并用磁力搅拌器不停的搅拌保持均匀(60 min),用移液管量取样品约1 mL置于流变仪的不锈钢平台上,平衡2 min后开始测量。温度扫描测试的程序为:以5 ℃/min的加热速率从25 ℃加热到95 ℃,测量储能模量(G′)、损耗模量(G″)随温度的变化。测试过程中角频率和应变值分别固定为1 Hz和1%。
(2)动态粘弹性测试:对温度扫描后的样品,立即进行动态频率扫描测试。相关指标参照张晓宇的方法进行。
(3)稳态剪切流变测试:采用温度扫描后的样品,进行稳态流变测试。在25 ℃温度下,剪切速率从0 s-1增加到200 s-1(上行曲线),再从200 s-1降低到0 s-1(下行曲线),测试剪切应力随剪切速率的变化。
1.3.6淀粉凝胶长期回生特性的测定
有关淀粉凝胶长期回生特性的测定采用田耀旗[7]的方法。为保证样品的平行性和实验的重现性,测定的样品均为经上述RVA糊化后的淀粉凝胶,依据在4 ℃下保存的时间,分别记为0、1、3、7 d后的淀粉凝胶样品。
2 结果与讨论
2.1 不同酸解时间下的β-葡聚糖分子量测定
由图1可知,随酸解时间的延长,LS和RI的信号图谱峰逐渐后移,表明酸解时间的增加可导致β-葡聚糖的洗脱体积增大,相关β-葡聚糖的分子量如表1所示。

表1 不同酸解时间下β-葡聚糖的分子量
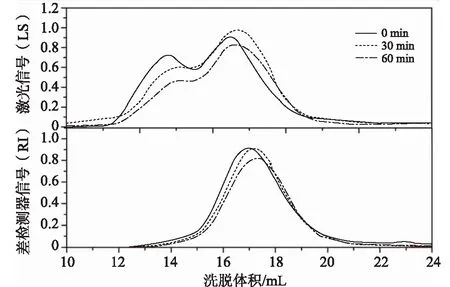
图1 不同酸解时间下的β-葡聚糖的HPSEC-MALL-RI的信号图谱
2.2 燕麦β-葡聚糖对小麦淀粉糊化特性的影响
添加不同分子量β-葡聚糖的小麦淀粉糊化特性参数见表2。由表2可知,β-葡聚糖的添加使得小麦淀粉的峰值黏度、谷值黏度、最终黏度均明显降低。这与Brennan[8]和Sharma[9]等研究结果一致,推测是因为β-葡聚糖的吸水能力大于小麦淀粉,在糊化过程中与小麦淀粉竞争水分,限制淀粉颗粒的溶解和膨胀,从而导致小麦淀粉的峰值黏度、最终黏度、谷值黏度出现降低[8,10]。李渊、Satrapai和Banchathanakij[11-13]等在研究大麦葡聚糖对小麦淀粉的糊化特性时也发现添加大麦葡聚糖的存在会降低小麦淀粉的糊化黏度。
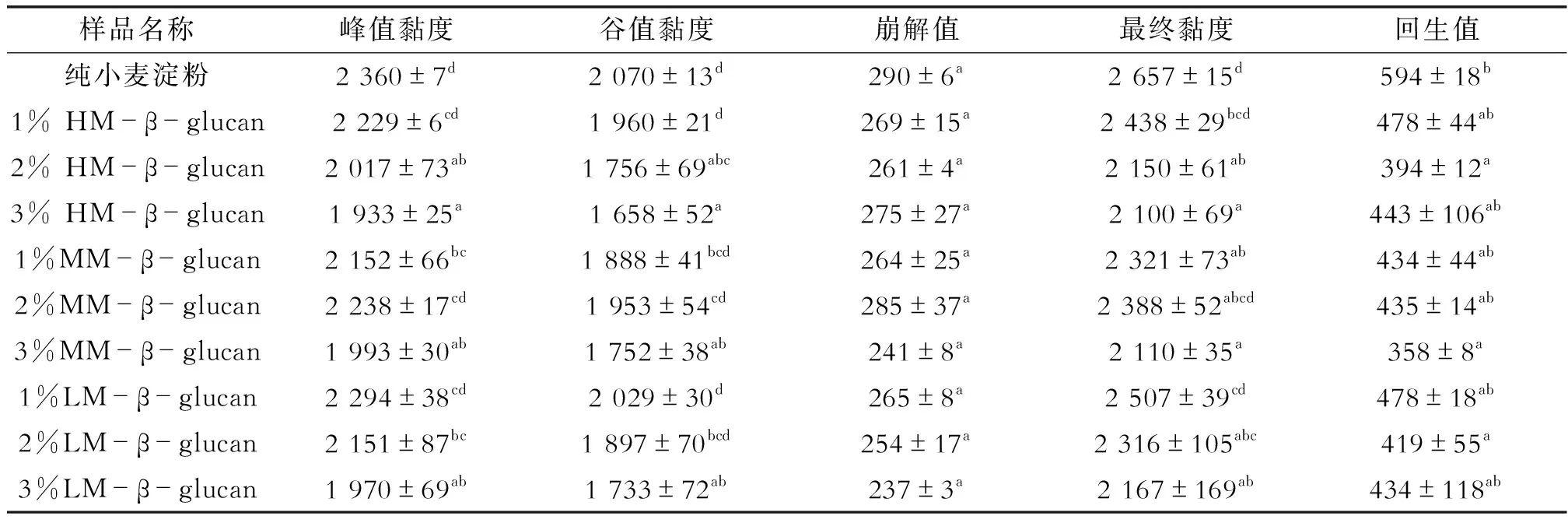
表2 添加不同比例燕麦β-葡聚糖的WS体系的糊化参数 cp
崩解值是峰值黏度和谷值黏度之差,崩解值越小,淀粉凝胶的热稳定性越高;崩解值越大,凝胶的耐剪切性越差[14];由表2可以看出,燕麦β-葡聚糖的存在虽然使得小麦淀粉的崩解值和回生值均有所下降,但不同分子量和添加量的β-葡聚糖间的崩解值间无显著差异。回生值反映的是淀粉糊化后分子重新结晶的程度,回生值越大越容易老化。当添加量为2%时,添加高分子量的β-葡聚糖(HM--β-glucan)的小麦淀粉回生值最低,表明其回生抑制效果最好。推测这可能是由于燕麦β-葡聚糖的分子链缠绕在小麦淀粉颗粒表面,形成空间位阻,阻碍了淀粉的短期回生[10,15]。因此,接下来重点研究了添加量为2%时的淀粉凝胶回生特性变化。
2.3 β-葡聚糖对小麦淀粉流变学特性的影响
2.3.1动态流变性质
2.3.1.1 温度扫描
从图2可知,添加不同分子量燕麦β-葡聚糖的小麦淀粉与纯小麦淀粉的弹性模量(G′)均呈现先升高后降低的趋势,这主要与糊化过程中淀粉三维凝胶网络的形成与破坏有关[16-18]。然而,与纯小麦淀粉相比,含燕麦β-葡聚糖的小麦淀粉体系均表现出较低的弹性模量,推测这是由于β-葡聚糖具有高持水性,它的存在会抑制淀粉颗粒的吸水膨胀,从而限制直链淀粉的浸出,阻碍淀粉凝胶三维网络结构的形成,进而导致其弹性模量低于原淀粉体系。此外,从图中可以看出,随着β-葡聚糖分子量的减小,糊化过程中的弹性模量逐渐降低,说明淀粉凝胶的刚性随β-葡聚糖分子量的降低而降低。在本实验的温度扫描过程中,模拟的是淀粉糊化后短期回生的过程,而淀粉的短期回生主要是淀粉中直链淀粉分子的重排。因此,β-葡聚糖的添加所带来的淀粉凝胶刚性的降低从侧面表明其对小麦淀粉的短期回生具有抑制作用。另外,分子量小的β-葡聚糖流动性大,这使得其与直链淀粉相结合的几率增加,这可能是低分子量β-葡聚糖对淀粉短期回生的抑制作用增强的主要原因。
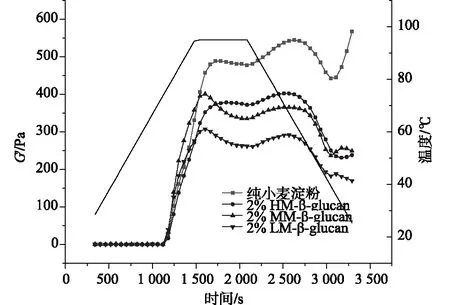
图2 含不同分子量燕麦β-葡聚糖的小麦淀粉温度扫描曲线(添加量为2%)
2.3.1.2 频率扫描
含不同分子量燕麦β-葡聚糖的小麦淀粉凝胶动态频率扫描曲线如图3所示。从图3a中可以看出,随着扫描频率的增加,淀粉凝胶的弹性模量(G′)和损耗模量(G″)都逐渐增加,且G′值高于相应的G″值,表明含或不含β-葡聚糖的淀粉凝胶体系均具有良好的黏弹性。对于含β-葡聚糖的淀粉凝胶体系来说,其弹性模量显著地小于不含β-葡聚糖的纯小麦淀粉凝胶体系,这可能是由于β-葡聚糖的加入使得凝胶体系中β-葡聚糖分子和淀粉分子链间的缠结加剧,增大了混合物凝胶体系的网络架构密度[19,20]。此外,β-葡聚糖自身属于高粘度的溶液,推测这也是导致淀粉凝胶弹性模量下降,黏性增大的原因之一。由图3b可以看出,含或不含β-葡聚糖的淀粉凝胶体系的损耗正切角tanδ均小于1,表现为一种典型的弱凝胶流体学特征[21,22];同时随着β-葡聚糖分子量的减小,凝胶体系的tanδ呈现先增大后减小的趋势,这说明β-葡聚糖的加入倾向于增加淀粉凝胶体系的黏性,而黏性高的淀粉凝胶可增加淀粉分子链在回生过程中进行分子重排的阻力,从而具有抑制淀粉回生的能力。
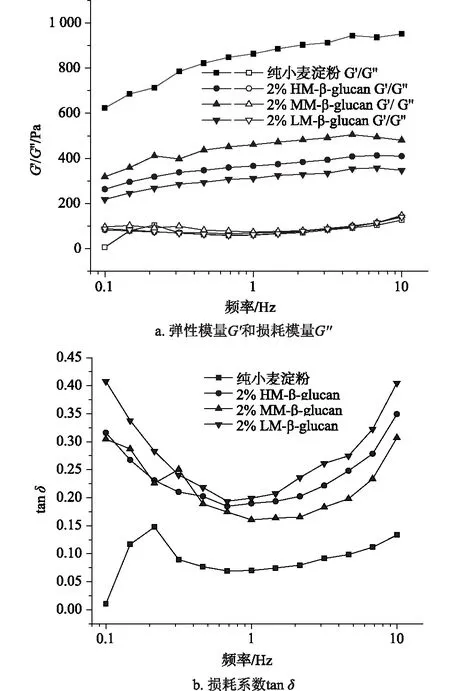
图3 含不同分子量燕麦β-葡聚糖的小麦淀粉动态频率扫描曲线(添加量为2%)
2.3.3静态流变性质
图4为添加不同分子量燕麦β-葡聚糖的小麦淀粉凝胶体系的静态流变性质。由图可发现,含不同分子量β-葡聚糖的淀粉凝胶体系在流动中所受的剪切应力随着剪切速率的增大而增大(上行线),且上行线的数据大于下行线,这说明含β-葡聚糖的淀粉凝胶具有剪切变稀的性质[19]。与不添加β-葡聚糖的小麦淀粉凝胶体系相比,当添加量为2%β-葡聚糖时,淀粉凝胶体系的剪切应力降低,且随着β-葡聚糖分子量的减小其降低幅度增大。这表明β-葡聚糖的存在会弱化淀粉凝胶体系的网络结构,从而抑制淀粉的短期回生行为。
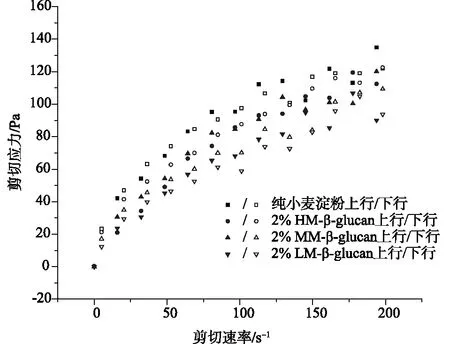
图4 含不同分子量燕麦β-葡聚糖的小麦淀粉静态流变曲线(添加量为2%)
2.4 β-葡聚糖对小麦淀粉长期回生的影响
DSC是测定淀粉回生的常用方法,DSC曲线可用于反映淀粉的回生性质。表3为含不同分子量β-葡聚糖的淀粉的长期回生参数。由表3可知,纯小麦淀粉和添加不同分子量β-葡聚糖的小麦淀粉的起始温度To均在100 ℃左右,这是由于低温时的回生淀粉的结晶较少,无法在DSC曲线上形成显著的峰,所以100 ℃以下无显著的回生焓值。从表中可以看出,回生0 d时,相比于纯淀粉,含β-葡聚糖的淀粉体系的To、Tp、Tc显著下降,表明在此期间葡聚糖/淀粉混合体系新生成了许多不稳定或者不完美的结晶;加入β-葡聚糖后淀粉体系的回生焓ΔH显著降低,说明β-葡聚糖能抑制淀粉体系的长期回生。另外,随β-葡聚糖分子量的减小,同等添加量下的淀粉体系ΔH逐渐降低,表明β-葡聚糖分子越小,对淀粉体系回生的抑制能力越强。这可能是由于随着分子量的减小,β-葡聚糖的支链数量增加,能更多的与支链淀粉相互作用,形成空间位阻,阻碍了直链淀粉和支链淀粉聚合重排,从而对小麦淀粉的长期回生呈现出显著的抑制作用。这与BeMiller等人的研究结果:水胶体可以改变淀粉的表观粘度,减缓淀粉糊在冷冻(Sae-kang等)或冻藏(Mali等)过程中的回生速度的结果相符合[21]。
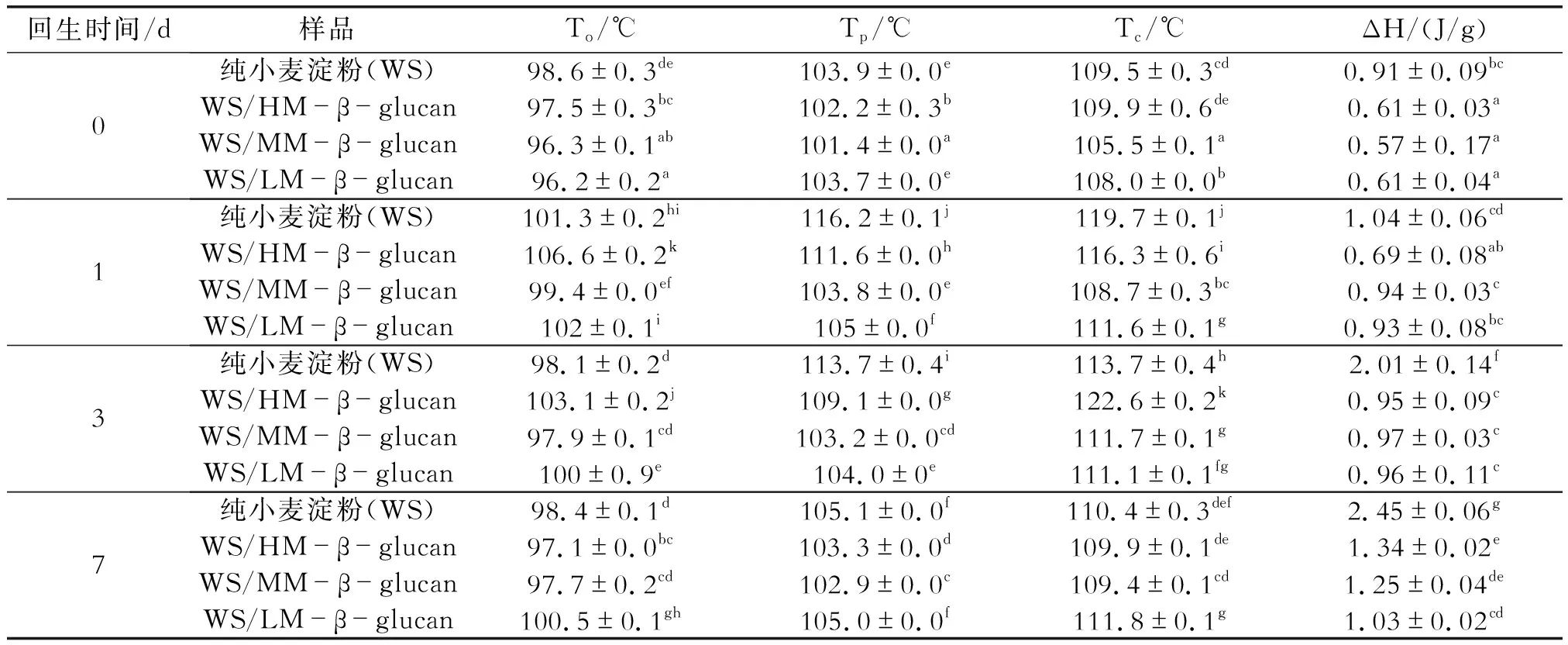
表3 含不同分子量β-葡聚糖的小麦淀粉的长期回生参数(2%)
3 结论
燕麦β-葡聚糖的存在使得小麦淀粉的回生值显著降低,将糊化后的样品4 ℃储存7 d后,其回生焓显著降低;添加燕麦β-葡聚糖在降低淀粉的粘弹性的同时与淀粉间的相互作用延缓了淀粉的短期回生,且随燕麦β-葡聚糖分子量的减小,燕麦β-葡聚糖对淀粉长期回生的抑制作用增强。

