开菲尔粒中酵母菌与乳酸菌共生机制的研究
张 培, 李亚慧, 娄 越, 卢钊炜, 李枢妍, 于 岚
(湖州师范学院 生命科学学院, 浙江 湖州 313000)
开菲尔粒是一种传统的多菌共生发酵菌种,其发酵牛奶所得的发酵乳——开菲尔,具有独特的风味、营养价值高等特点,一直受到国内外人民的广泛喜爱[1].对开菲尔粒所含有的微生物种类、微生物共生机制、开菲尔发酵机制等的研究一直是全世界研究者们关注的热点.
近30年对开菲尔粒的研究主要集中在对其微生物菌相的分析,以及发酵机制和发酵工艺的研究.至目前从开菲尔粒中筛选获得的微生物至少有30种[2-4].细菌属主要有:乳杆菌属、醋酸杆菌属、葡糖杆菌属、芽孢杆菌属、双歧杆菌、乳球菌属、孔链球菌属、肠球菌属和明串珠菌属等.酵母菌主要有:克鲁维酵母属、假丝酵母属、酒香酵母属、毕赤氏酵母属、酿酒酵母属和Kazachstania酵母属[5-6].学者们对这些微生物进行了发酵特性研究,认为在发酵过程中的优势菌主要为酵母菌和乳酸菌[7][8]3 146-3 148.一些学者根据开菲尔粒中发酵优势菌的生长和发酵特性,筛选出几种优势菌进行混合培养,制备出一些新型的混合发酵菌和发酵乳饮品.这些新型发酵乳在口味和营养方面虽然显著优于单一的乳酸菌发酵产品[9-11],但与混合菌发酵的新型乳制品相比,利用原始菌种发酵获得的开菲尔在风味和营养成分等方面仍然更胜一筹,这主要是由于开菲尔粒中参与发酵的菌相数量更多,因而赋予发酵乳更丰富的营养[12-13].对开菲尔发酵工艺的研究表明,由于开菲尔粒包含多种微生物,发酵条件略有不同就可能会造成不同生产批次的开菲尔的风味和营养成分差异较大[10].有研究表明,开菲尔粒不能依靠纯培养后的微生物混合培养形成,只能在已经存在的开菲尔粒的基础上继续生长,而且其机制尚未明确[14].因此,要深入了解开菲尔粒的发酵机制,实现对开菲尔这种传统的发酵乳生物活性成分的代谢调控和质量控制,首先要了解开菲尔粒中微生物之间的共生机制.
近年来,一些学者开展了对开菲尔粒中微生物的共生机制研究.如利用电子显微镜观察开菲尔粒表面和内部微生物的分布情况,发现存在几种不同的共生现象:酵母菌在中间,外围被乳酸菌包围[15];酵母菌分布在外围,而杆状菌内外都有[16].有学者在研究乳酸菌和酵母菌特性时发现,马乳酒样乳杆菌和酿酒酵母菌表现出很强的自聚能力,因此他们推测短杆菌占据开菲尔粒表面,而长杆菌开菲尔囊乳杆菌占据开菲尔粒中心[14].尽管观察到了开菲尔粒中共生菌相的分布,但目前它们之间的相互作用机制、共生机制尚未明确.一些学者基于发酵食品中常见的酵母和乳酸菌共发酵现象,以酵母菌和乳酸菌为研究对象,分析其共生机制.研究结果发现,酵母菌和乳酸菌之间存在着营养互惠互利的机制.如:Gulloux等[17]通过变温培养研究酵母菌和乳酸菌的共生特性,结果发现,先采用30 ℃温度条件培养,酵母菌先生长;后采用37 ℃温度培养,酵母菌的代谢产物能够被乳酸菌利用,从而大量繁殖;先采用37 ℃温度培养,乳酸菌快速生长,并将乳糖分解为半乳糖、葡萄糖等单糖;后采用30 ℃温度培养,酵母菌能够利用这些单糖大量繁殖.在共生条件下酵母菌和乳酸菌的增殖量显著高于纯培养条件.Ponomarova等[18]的研究结果表明,酵母菌能够代谢产生苏氨酸,而乳酸菌可以利用苏氨酸进一步代谢产生乙醛.乳酸菌借助酵母菌强大的氨基酸合成能力大量合成乙醛,从而抑制有害细菌的生长,同时改善酸奶的口味以及产生对人体有益的其他代谢产物.这些前期的研究结果表明,开菲尔粒中酵母菌和乳酸菌的共生机制是通过代谢产物的相互利用实现互惠互利的,从而实现共生.尽管前期的研究成果获得了非常有意义的信息,但对开菲尔中多种微生物在共生过程中存在的其它相互作用机制,以及微生物共生对开菲尔粒“生长”、环境压力应答的影响等方面,目前还知之甚少[6-13].
本文基于前期工作中从开菲尔粒中筛选获得的优势发酵菌[8]3 240,以优势酵母菌和乳酸菌为研究对象,对酵母菌和乳酸菌之间对各自细胞损伤修复的影响和抗环境压力的影响进行研究.通过分析酵母菌和乳酸菌之间在受损伤情况和压力条件下的相互作用,探讨其共生机制,为深入挖掘开菲尔粒发酵微生物“团队”的形成和共生机理提供有意义的信息.
1 材料与方法
1.1 实验材料
开菲尔粒来源的酿酒酵母(Saccharomycescerevisiae)、假丝酵母(Candidadattila)、保加利亚乳杆菌(Lactobacillusdelbrueckiisubspbulgaricusspecies)、嗜热链球菌(Streptococcusthermophilus)、大肠杆菌DH5α菌株(由本单位发酵工程实验室筛选并保藏)、天然培养基原料(采用市售光明鲜牛奶),以及其他试剂均为普通生化试剂.
1.2 实验方法
1.2.1 培养基
YPG培养基按参考文献[19]配制;MRS培养基按参考文献[20]配制;M-17培养基按参考文献[21]配制.
1.2.2 荧光定量PCR
以基因组DNA为模板,采用酵母菌18S rRNA的通用引物18sF(5’-ATTGGAGGGCAAGTCTGGTG-3’)和18sR(5’-CCGATCCCTAGTCGGCATAG-3’),以及乳酸菌16S rDNA的通用引物8f(5’-AGA GTT TGA TCC TGG CTC AG-3’)和1512r(5’-AAG GAG GTG ATC CAG CCG CA-3’)[22],进行qPCR的18S rRNA和16S rRNA基因表达量测定.qPCR的反应体系(共25 μL)含有模板1 μL、引物各0.2 μM、2×SYBR premix Ex Taq 12.5 μL.qPCR的程序为在95 ℃温度下,30 s后开始30个循环:95 ℃ 5 s、58 ℃ 30 s、72 ℃ 30 s.最后在55~95 ℃温度范围内测定溶解曲线.
1.2.3 不同SDS浓度对酵母菌和乳酸菌破损率的影响
从平板上挑选酵母单菌落至5 mL的YPG液体培养基中,在30 ℃温度下,以150 r/min振荡培养至OD600 nm=1.取2 mL菌液10 000 r/min,在常温条件下离心收集菌体.采用2 mL不同浓度的SDS溶液悬浮菌体10 min,振荡均匀后取0.1 mL菌液,离心收集菌体细胞后采用4,6-diamidino-2-phenylindole(DAPI,Invitrogen)染料对细胞染色.由于DAPI脂的不溶性,短时间内无法透过细胞膜,而破损细胞由于表面破裂,所以DAPI染料可以直接进入细胞[23].在荧光显微镜405 nm条件下观察细胞的染色情况,计算细胞的破损率,选择破损率为90%左右的菌液进一步实验.每个样品做3个重复平行.
从MRS平板上选取保加利亚乳杆菌,从M-17平板上选取嗜热乳酸链球菌,分别置于5 mL MRS和M-17液体培养基中,在37 ℃温度下,取2 mL菌液10 000 r/min,常温条件下离心收集菌体.采用2 mL不同浓度的SDS溶液悬浮菌体10 min,振荡均匀后取0.1 mL菌液,离心收集菌体细胞后采用DAPI染料对细胞染色,在荧光显微镜405 nm条件下观察细胞的染色情况,计算细胞的破损率,选择破损率为90%左右的菌液进一步实验.每个样品做3个重复平行.
1.2.4 共生条件下乳酸菌对酵母菌受损修复的影响
离心收集2 mL经SDS处理的酵母菌体细胞,常温下10 000 r/min离心5 min,收集菌体.用10 mL新鲜的YPG培养基重悬菌体,同时加入2 mL新鲜培养的乳酸菌(OD600 nm=1),在30℃温度下,经150 r/min振荡培养8 h后取2 mL菌液离心收集菌体,提取基因组序列.以基因组DNA为模板进行qPCR测定18S rRNA的表达量(方法见1.2.2).另外,取2 mL菌液,稀释10倍后取0.2 mL用于涂布YPG平板,在30 ℃温度条件下培养3 d后根据菌落的形态对菌落进行计数.将每毫升菌液中的菌落数除以荧光定量PCR的结果即为菌体的个数,绘制菌体生长曲线[18].每个实验条件设置3个平行,并在测定时设置3个平行重复,实验结果为6个重复的平均值.
以单独培养经SDS处理的酵母菌,以及大肠杆菌DH5α和酵母菌共培养物分别作为对照,观察酵母菌和乳酸菌在共生条件下乳酸菌对酵母菌受损修复的影响.
1.2.5 酵母菌对乳酸菌受损修复的影响
取2 mL SDS处理的乳酸菌细胞,常温下10 000 r/min离心5 min,收集菌体.用10 mL新鲜的MRS或M-17培养基重悬菌体,同时加入2 mL新鲜培养的酵母菌(OD600 nm=1),在37 ℃温度下,经150 r/min振荡培养8 h后取2 mL菌液离心收集菌体,提取基因组序列.以基因组DNA为模板进行qPCR测定16S rRNA的表达量(方法见1.2.2).另外,取2 mL菌液,稀释10倍后,取0.2 mL用于涂布MRS或M-17平板,在37 ℃温度条件下培养2 d后根据菌落的形态对菌落进行计数.将每毫升菌液中的菌落数除以荧光定量PCR的结果即为菌体的个数,绘制菌体生长曲线[18].每个实验条件设置3个平行,并在测定时设置3个平行重复,实验结果为6个重复的平均值.以单独培养经SDS处理的乳酸菌,以及大肠杆菌DH5α和乳酸菌的共培养物分别作为对照.
1.2.6 共生对酵母菌和乳酸菌压力应答的影响
(1) 共生对热压力的应答.酵母菌和乳酸菌细胞分别在YPG、MRS和M-17培养基中培养至OD600 nm=1,分别取1 mL以1∶1的体积比混合.在50 ℃温度条件下热激20 min,常温下10 000 r/min离心5 min收集菌体,分别接种于10 mL YPG、MRS或M-17培养基中,在30 ℃和37 ℃温度下,以150 r/min分别振荡培养8 h,按上述方法分别测定酵母菌和乳酸菌的生长曲线.以50 ℃温度条件下热激处理的酵母菌和乳酸菌单菌培养物作为对照.
(2) 共生对pH压力的应答.酵母菌和乳酸菌细胞分别在YPG、MRS和M-17培养基中培养至OD600 nm=1,分别取1 mL以1∶1的体积比混合.在醋酸钠缓冲液(0.05 mol/L,pH3)中悬浮20 min后,在常温下10 000 r/min离心5 min收集菌体,分别接种于10 mL YPG、MRS或M-17培养基中,在30 ℃和37 ℃温度下,经50 r/min分别振荡培养8 h,按上述方法分别测定酵母菌和乳酸菌的生长曲线.以醋酸钠缓冲液(0.05 mol/L,pH7)中悬浮处理20 min后的酵母菌或乳酸菌单菌培养物作为对照.
2 结果与分析
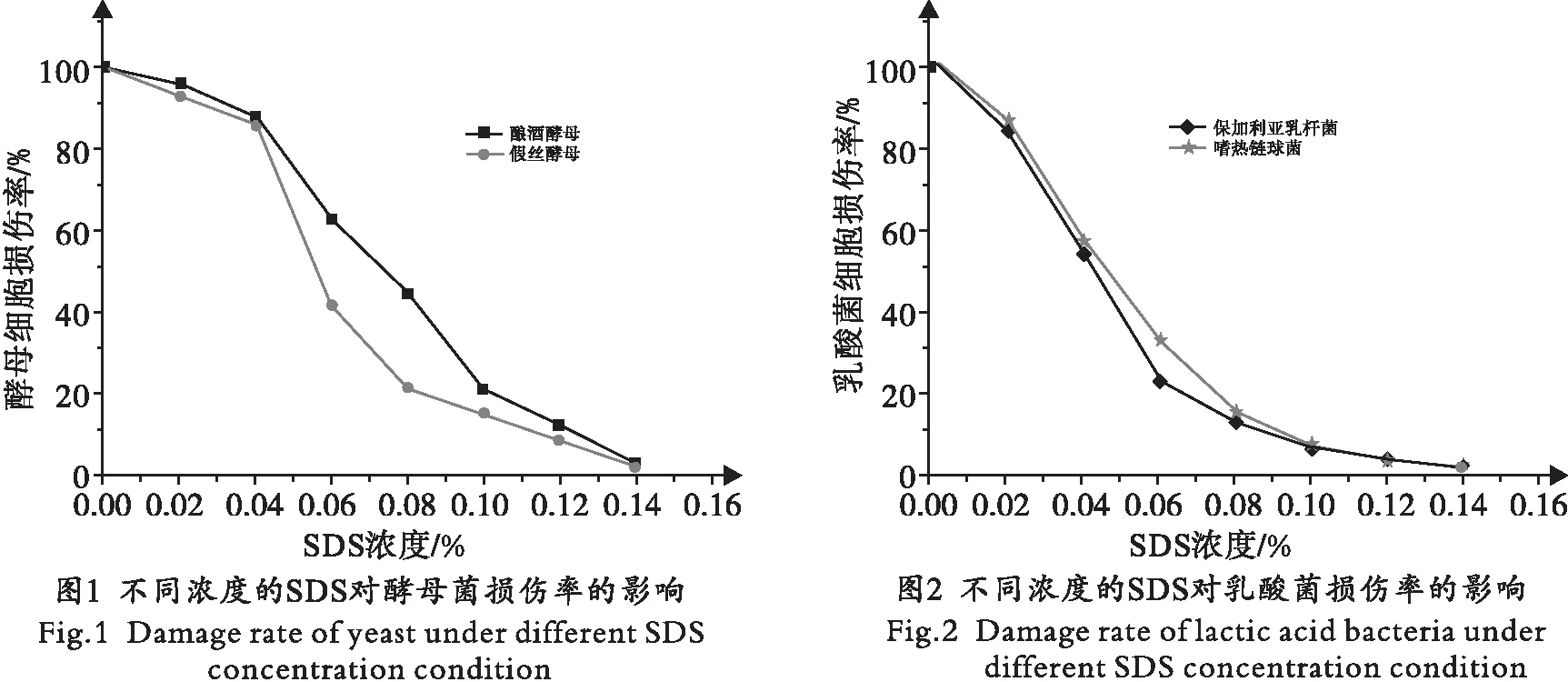
2.1 不同浓度的SDS对酵母菌和乳酸菌损伤的影响
采用DAPI对经不同浓度SDS处理的酵母细胞和乳酸菌进行染色,并在荧光显微镜下观察,结果见图1、图2.为避免细胞破损严重而自我修复率太低,不利于后期实验统计细胞修复率,筛选细胞损伤率约为90%的SDS浓度作为后续实验的处理条件.实验结果表明:酵母细胞用0.1%的SDS溶液处理后,90%以上的酵母细胞有损伤;乳酸菌经0.08%的SDS溶液处理后,约90%的乳酸菌细胞有损伤,因此选择细胞损伤率为0.1%和0.08%的SDS浓度分别作为处理酵母菌和乳酸菌的最佳浓度.
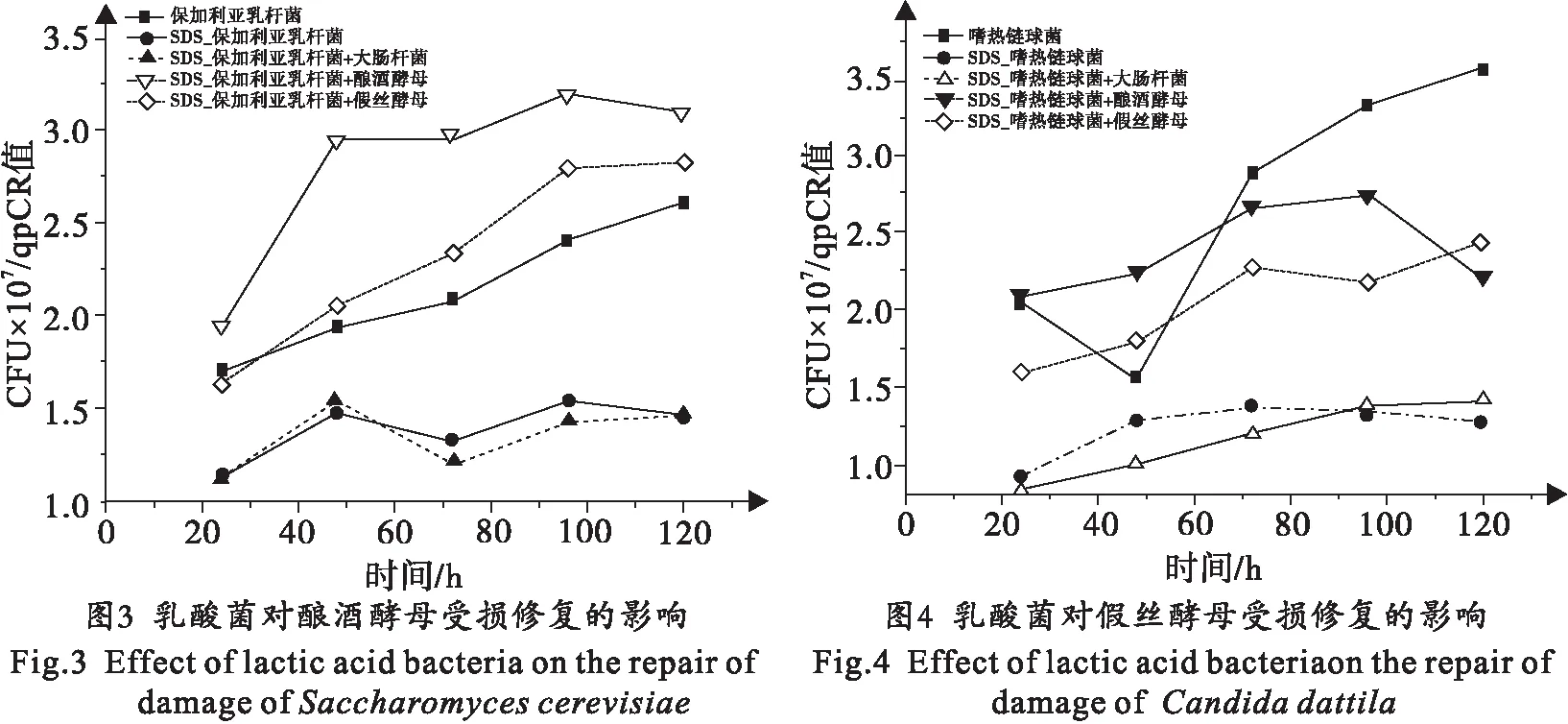
2.2 乳酸菌对酵母菌受损修复的影响
为观察开菲尔粒中乳酸菌对酵母菌受损修复的影响,将SDS处理后的酵母菌和无损伤的乳酸菌进行共同培养,测定不同培养时间内酵母菌的个数,并绘制生长曲线.采用大肠杆菌和经SDS处理的酵母菌混合培养作为阴性对照.结果表明(图3、图4):经SDS处理的酿酒酵母在后期培养过程中有些细胞可以自我修复并存活下来,与大肠杆菌混合培养时酿酒酵母的修复细胞个数与单独培养时相比并没有显著差异,但当酿酒酵母和保加利亚乳杆菌或嗜热链球菌混合培养时,修复并存活的酿酒酵母细胞更多,其中,保加利亚乳杆菌对酿酒酵母损伤修复的影响较嗜热链球菌显著;经SDS处理的假丝酵母能够存活一部分细胞,但在与保加利亚乳杆菌和嗜热链球菌共生条件下假丝酵母的存活率均显著提高,而与大肠杆菌混合培养时假丝酵母的存活细胞数并没有显著增加.实验结果证明:在乳酸菌存在的环境中受损的酵母菌更容易修复并存活.
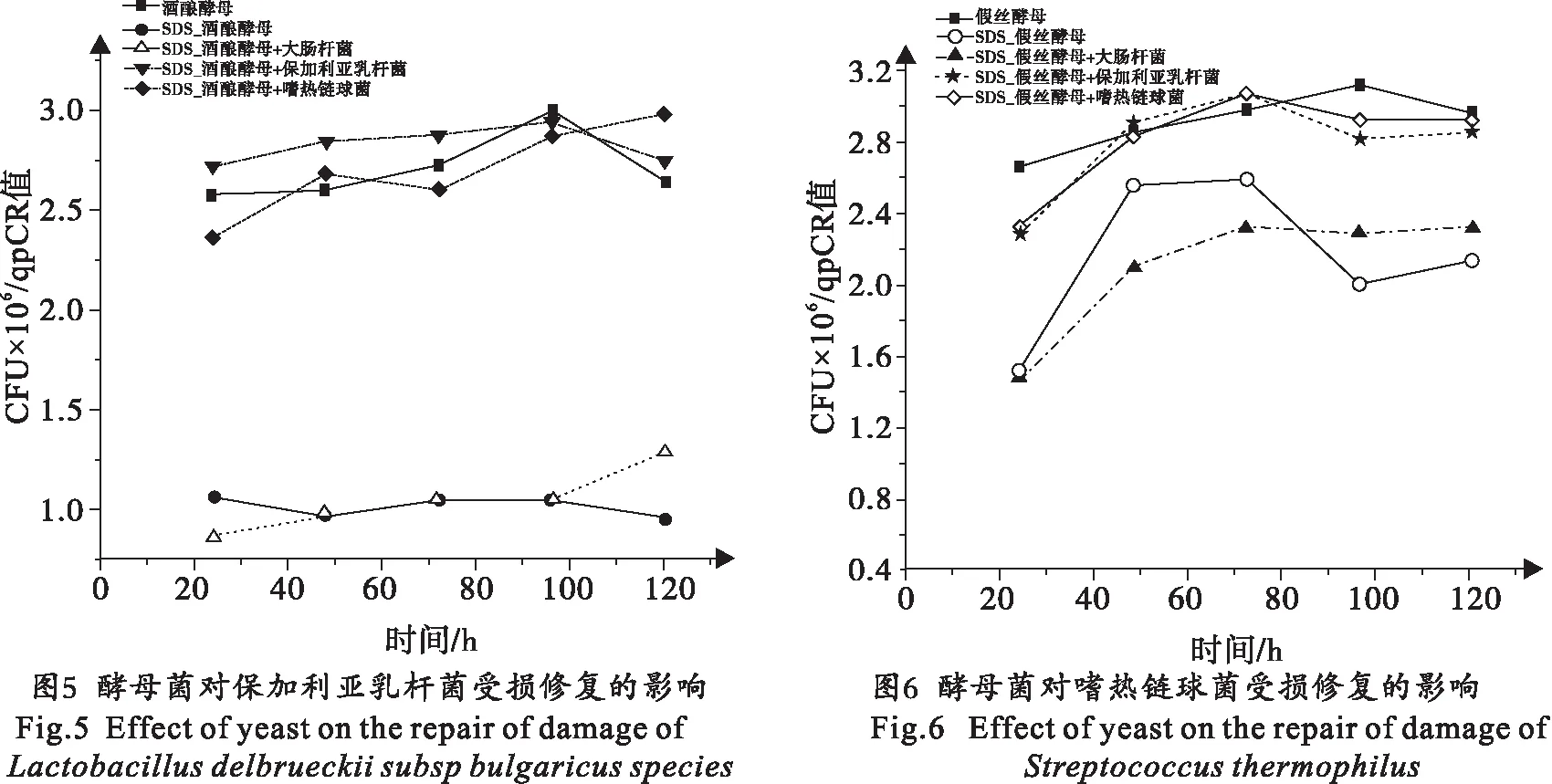
2.3 酵母菌对乳酸菌受损修复的影响
为观察开菲尔粒中酵母菌对乳酸菌受损修复的影响,将受损的乳酸菌细胞与未受损的酵母菌细胞进行混合培养,并测定乳酸菌的生长曲线.采用大肠杆菌和受损的乳酸菌细胞共培养作为阴性对照.结果表明:酿酒酵母和假丝酵母均能显著提高保加利亚乳杆菌的细胞修复能力,共生条件下保加利亚乳杆菌的生长比单独培养或与大肠杆菌混合培养更好(图5);对嗜热链球菌而言,在与酵母菌共生条件下嗜热链球菌的修复能力显著提高(图6).实验结果证明:在酵母菌存在的情况下对开菲尔粒中保加利亚乳杆菌和嗜热链球菌的受损修复有显著的促进作用.
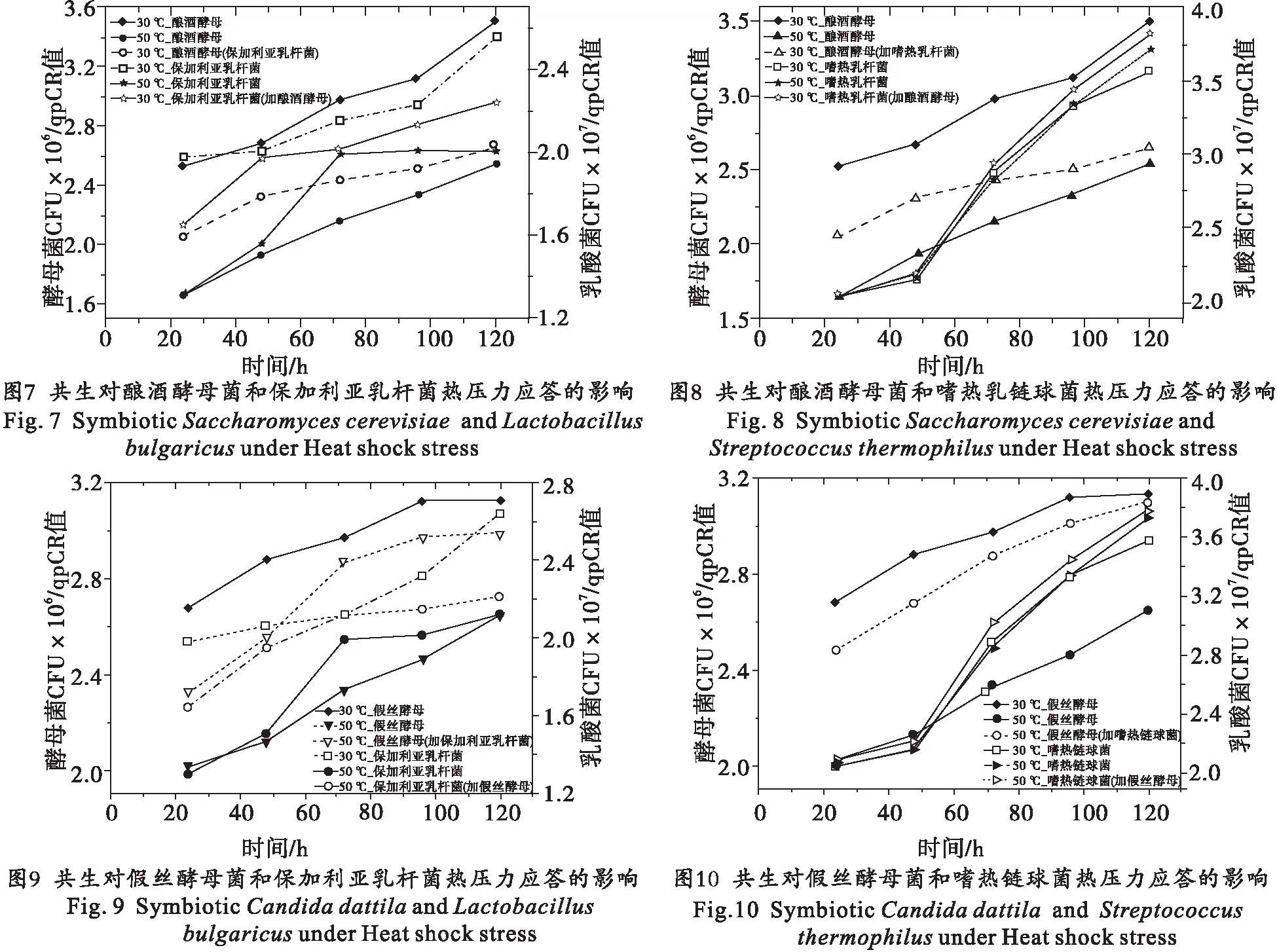
2.4 共生对酵母菌和乳酸菌压力应答的影响
考虑到开菲尔粒是一个多菌混合的发酵原种,在漫长的传代过程中始终保持着多菌相共生体系.在采用开菲尔粒进行发酵时关键的控制条件之一是温度[24-25],在利用这种多菌共生体进行发酵时产生的生物热很大,如不能及时降温则会严重影响微生物的生长(尤其是酵母菌的生长)以及发酵产物的产量.为观察热压力条件下酵母菌和乳酸菌共生对它们生长的影响,利用酿酒酵母、假丝酵母、保加利亚乳杆菌和嗜热链球菌两两混合培养,分别观察在50 ℃温度下热激后酵母菌和乳酸菌的生长情况.结果表明:在热激处理后,酿酒酵母菌、假丝酵母和保加利亚乳杆菌的生长显著受到抑制,但在共培养条件下这3种菌在不同的培养阶段均显著高于单独培养的菌体量(图7、图8),证明共生条件下更利于酿酒酵母菌、假丝酵母和保加利亚乳杆菌对抗热激压力;50 ℃热激处理对嗜热乳链球菌的生长影响不显著,这可能是因嗜热乳酸链球菌具有耐热特性,50 ℃对其不造成生长压力;嗜热乳链球菌在受到热激后对酿酒酵母和假丝酵母的生长具有显著的促进作用(图9、图10).实验结果证明:酵母菌和乳酸菌在混合共生条件下对这两种微生物的抗热压力应答有显著的促进作用.
在利用开菲尔粒进行发酵的过程中,pH是另一个重要的控制参数[24-25].乳酸的积累必然引起pH下降,从而抑制开菲尔粒中酵母菌和乳酸菌的生长,甚至损伤细胞.为进一步观察在pH压力下共生环境是否更利于乳酸菌和酵母菌的生长,将酿酒酵母、假丝酵母、保加利亚乳杆菌和嗜热链球菌这4种发酵优势菌经pH3醋酸缓冲液处理后添加未处理的乳酸或酵母菌进行共培养,绘制酵母菌和乳酸菌的生长曲线.结果表明:酸处理对酿酒酵母的损伤显著,与保加利亚乳杆菌共培养能够显著促进酿酒酵母的生长,而与嗜热链球菌共培养对酿酒酵母的生长影响不明显(图11、图12);假丝酵母经酸处理后与乳酸菌混合培养能够显著促进其生长(图13、图14);酿酒酵母和假丝酵母对酸处理的保加利亚乳杆菌的生长有显著促进作用(图11、图13),对嗜热链球菌的生长无显著影响(图12、图14).实验结果证明:在共生条件下乳酸菌对酵母菌的抗酸能力有显著促进作用,酵母菌对保加利亚乳杆菌的抗酸能力有显著促进作用,但对嗜热链球菌的影响不大.
3 结 论
开菲尔粒对开菲尔酸乳的发酵是至关重要的,因为通常无法采用开菲尔乳作为发酵剂来进一步发酵获得相同活性成分的酸奶.开菲尔粒作为发酵剂被重复使用可达几十年,在漫长的传代过程中,其相对稳定的菌相比例、不容易受污染等特性与其包含的菌相及这些微生物的相互作用具有密切关系[26-27].本实验结果证明:开菲尔粒中酵母菌和乳酸菌的共生机制除了具有营养互惠机制[18]外,还能帮助其他微生物修复细胞,从而维持整个“团队”中微生物数量的“平衡”.研究结果为开菲尔粒中多菌相共生机制的研究提供了有意义的信息,为深入研究复杂的微生物共生系统提供了理论基础.

