药品微生物实验室水系统分离37株微生物的鉴定及分析
袁 力,余 萌,王似锦,马仕洪*
(1.河南省食品药品检验所,河南 郑州 450018;2.中国食品药品检定研究院,北京 100050)
《中国药典》2015年版二部共收载了纯化水、注射用水及灭菌注射用水3种水[1]。药典凡例中指出,试验用水除另有规定外,均系指纯化水。目前,纯化水可作为配制普通药物制剂用的溶剂或试验用水,非灭菌制剂用器具的精洗用水。纯化水在实验室的培养基配制和消毒液配制、试验器皿清洗、样品稀释和处理等方面发挥着重要作用。注射用水可作为配制注射剂、滴眼剂等的溶剂或稀释剂,及用于容器的精洗。药品生产洁净区的清洗、消毒剂的配制、料液的配制都离不开注射用水。随着微生物检验技术不断发展,人们对实验室用水带来实验风险的认识不断深化和提高。制药行业洁净区环境菌(人、空气、表面)以革兰阳性菌为主[2],这是因为革兰阳性菌通常不适合在液体环境中生存。但水系统中以革兰阴性菌为主[3],常见叶杆菌属和鞘氨醇单胞菌属。某些革兰阴性菌喜欢水生栖息,并容易在水系统和其他潮湿环境形成生物膜[4]。生物膜对抗生素和宿主免疫防御机制的抗性很强。成熟的生物膜通过蔓延、部分脱落或释放出浮游菌等进行扩展,脱落或释放的细菌重新变成浮游菌,又可在物体的表面形成新的生物膜,且形成生物膜之后对消毒剂或抗生素的耐受性有可能增强[5]。因此,本研究对某药品微生物实验室的水系统进行了污染微生物的分离与鉴定,对水系统中分离菌的分布特点进行了分析,并比较了常见的鉴定方法对水系统微生物的鉴定效果差异。
1 仪器与材料
1.1 仪器与设备
Milli-Q®HX 7080纯水仪(德国Merck);Elix®纯水仪(德国Merck);SQ810C型压力灭菌器(日本Yamato);EZ-S StreamTM(美国Millipore);NU-543-600S型生物安全柜(美国Nuaire);KD-240恒温培养箱(德国Binder);BX53光学显微镜(美国Olympus);T100型PCR仪(美国Biorad);Biolog MicroStation 微生物自动鉴定系统(美国Biolog);Riboprinter全自动微生物基因指纹鉴定系统(美国Dupont);BX53光学显微镜(日本Olympus)。
1.2 试剂与培养基
一次性EZ滤杯(规格:100 ml;孔径:0.45 μm;材质:尼龙膜);PrepGEM Bacteria PBA0100型DNA提取试剂盒(ZyGEM);2×Taq Plus PCR MasterMix(Tiangen);Riboprinter细菌鉴定套装(美国Dupont);BiologGENⅢ细菌鉴定板(美国Biolog);R2A琼脂培养基(美国BD公司)。
2 实验方法
2.1 分离与纯化
使用Milli-Q®HX 7080 Water Purification System和Elix®Reference Water Purification System。二者均为二级纯水系统,HX7080系统制备纯水用于实验室消毒液配制、玻璃器皿清洗、高压灭菌设备等日常使用,共包括5个取水点:进场洗手池口、A区准备区西口、A区准备区东口、B区灭菌区口、消毒液配制口。Elix®Reference制备纯水用于微生物培养基、缓冲溶液、试剂等的配制,共包括两个取水点:B区准备区配制口,B区仪器口。取样时,两台纯水仪处于开机状态,打开各纯水取水点开关,持续出水3 min后,用无菌离心管分别在7个出口接取纯化水各10 ml。
参照中国药典2015年版四部通则1105,从上述无菌离心管中各取供试液1 ml,经薄膜过滤法处理,采用R2A琼脂培养基[6],32.5 ℃培养24 h,然后22.5℃低温继续培养至5 d[7]。根据菌落特征,挑取平板中菌落,继续用R2A平板划线分离纯化菌落,用于革兰染色和微生物鉴定,并保存。
2.2 鉴定
2.2.1 革兰染色 分离微生物经固体培养基划线纯化获得单菌落,在生物安全柜中,用无菌接种环挑取少量单菌落涂布于滴加无菌生理盐水的载玻片上,自然晾干后,加热固定,经结晶紫初染1 min,碘液媒染1 min,酒精脱色20~30 s,番红复染1 min,自然晾干后,光学显微镜下油镜观察。
2.2.2 16S rDNA序列分析 纯化后的分离微生物用D N A提取试剂盒提取基因组,作为模板备用;16SrDNA序列引物为27f:5’AGAGTTTGATCMTGGCTCAG3’;1492R:5’TACGGYTACCTTGTTACGACTT3’。每25 μl反应体系中包括2×Taq Plus PCR MasterMix,上下游引物各0.2 μmol,模板10 ng。扩增条件:95 ℃预变性4 min;95 ℃变性30 s,50 ℃引物退火45 s,72 ℃延伸90 s,35个循环;72 ℃延伸5 min。PCR产物测序交由北京诺赛基因组研究中心有限公司完成。所得拼接结果输入BLAST数据库比对。
2.2.3 Riboprinter全自动微生物基因指纹鉴定 采用Riboprinter对纯化过的分离微生物进行核糖体基因指纹图谱分析。根据16S rDNA序列分析结果,针对各个出水口分离微生物,选择不同属水平代表菌株进行Riboprinter分析。
2.2.4 生化鉴定 采用Biolog微生物自动鉴定系统对纯化过的分离微生物进行生化鉴定分析。
3 结果
3.1 实验室水系统微生物群落分布
对实验室7个出水口中收集到的37株微生物进行鉴定分析。7个出水口的纯化水来源于两台纯水仪,按要求对各出水口纯化水进行检测,从培养滤膜上,选取生长表型(菌落大小,形态,颜色等)存在差异的菌落进行进一步分离纯化,某些取水口菌株重复性较高,组成类似,而某些取水口菌落则相对单一。培养基配制所用纯化水由一台纯水仪单独制备,取水位点分别为纯水仪制水口和经过滤膜过滤之后的培养基配制口。由16S rDNA序列分析结果可知,本实验室群落由8属组成,分别为鞘氨醇单胞菌属(Sphingomonas),草螺菌属(Herbaspirillum),青枯菌属(Ralstonia),甲基杆菌属(Methylobacterium),叶杆菌属(Phyllobacterium),生根瘤菌属(Mesorhizobium),新鞘氨醇菌属(Novosphingobium),Methylorubrum属;各属占比分别为38 %,3 %,16 %,8 %,27 %,5 %,3 %,3 %,见图1。
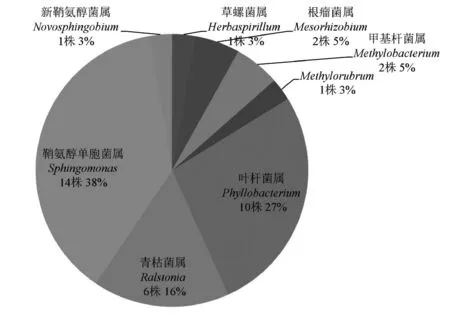
图1 水系统微生物群落分布图
3.2 水系统微生物鉴定结果
3.2.1 镜检结果 分离得到的37株菌染色结果均为革兰阴性。占比最多的鞘氨醇单胞菌属和叶杆菌属染色镜检见图2。鞘氨醇单胞菌属为专性需氧的革兰阴性菌,无芽胞,呈杆状或略弯;叶杆菌属为直杆状革兰阴性菌。

图2 分离微生物部分镜检结果
3.2.2 鉴定方法比较 本实验共分离水系统中微生物37株,对这些微生物全部进行16S rDNA序列分析,部分进行Biolog生化鉴定及Riboprinter基因指纹图谱鉴定(见表1)。Biolog鉴定系统主要是利用不同碳源进行新陈代谢过程中产生的氧化还原酶与显色物质反应导致的颜色变化及由于微生物生长造成的浊度差异,通过与标准菌株数据库比较,得出鉴定结果。Riboprinter 鉴定系统是利用核糖体DNA在不同菌株中的拷贝数存在差异,用限制性内切酶对细菌基因组进行酶切,菌株之间的酶切片段长度、数量存在差异,经特异性探针标记,形成菌株专一的指纹图谱,通过与数据库中的图谱比对,得到鉴定结果。相似度值高于0.85时,结果可信,相似度值低于0.85时,结果不可信[8]。16S rDNA序列分析对上述微生物能给出属/种水平的鉴定结果;Biolog给出鉴定结果的有13株,在属水平与16S rDNA序列分析一致的有5株;Riboprinter给出鉴定结果的有17株,其中相似度值大于0.85的只有2株,在属水平与16S rDNA序列分析一致的有11株。以上结果显示本实验所采用的生化鉴定方法和核糖体分型方法对水系统中微生物的鉴定能力不足,究其原因,通过比对Biolog和Riboprinter的菌种数据库,发现这两个数据库对我们所分离的目标微生物覆盖不足,即这些水系统中的微生物并未纳入这两个鉴定系统的数据库中,成为导致鉴定成功率较低的原因之一。此外,对于核糖体分型系统而言,即使数据库中收载了相应种/属的微生物,但建库所用菌株太少,以致代表性不足,也可能导致鉴定准确性降低。

表1 3种鉴定方法分析结果对比
4 讨论
目前有关实验室水系统微生物群落分布规律的报道较少。试验用水广泛应用于微生物实验室的培养基及消毒剂的配制、器皿洗涤、样品稀释和处理等方面。微生物检验结论正确的前提是使用的培养基未受污染,而影响培养基质量的因素除培养基本身的配方质量、保存条件、灭菌条件等,配制培养基使用的试验用水中微生物污染情况是另一个重要因素,加强试验用水的日常监控和微生物污染状况的研究,对于合理、有效地规范制水系统和储水装置的消毒、清洗周期和频率有重要的参考意义。
4.1 菌株分离纯化方法的选择
对于纯净水的微生物限度检查,各国药典的规定见表2。由表2可见,中国药典和欧洲药典均采用薄膜过滤法,使用R2A琼脂培养基,30~35 ℃培养5 d,而美国药典的检验方法并未固定,培养基、培养温度和培养时间均可根据具体实验情况进行选择[9]。研究发现,方法一:采用R2A培养基于32.5 ℃培养5 d;方法二:采用R2A培养基于32.5 ℃培养24 h后再于22.5 ℃低温继续培养至5 d;二者相比,R2A培养基先高温再低温培养产生的微生物种类和数量较32.5 ℃恒温培养更多,原因是有些水生微生物适合低温生长[7]。故最后选用方法二进行试验。
4.2 纯化水的微生物分布特点
分析本实验室水系统微生物的构成,鞘氨醇单胞菌属占38 %,叶杆菌属占27 %,分布特点与国外水系统监测相关报道[10]基本一致。
4.3 不同方法对水系统中微生物的鉴定效果比较
本实验分别运用基因型(16S rDNA序列分析)、Riboprinter全自动微生物基因指纹鉴定系统),表型(Biolog微生物自动鉴定系统)鉴定方法对检出微生物进行分析。16S rDNA序列分析作为细菌鉴定或系统发育分析最常见的基因型方法[11],对水系统中分离微生物,在属水平至种水平具有良好的鉴定效果。前期实验中发现Riboprinter基因指纹图谱鉴定技术对于水系统中微生物的鉴定效果不佳,推测由于数据库相关菌种的带型收录量不足导致,因此未对所有菌株进行该项目的分析。但此种分析方法具备溯源分析的能力(见表1)。以生化反应为鉴定依据的Biolog微生物自动鉴定系统分析鉴定结果与16S rDNA序列分析相比,属水平的鉴定准确率为35 %,种水平则为13.5 %,原因是水系统中微生物具有寡养、嗜低温、生长缓慢的特性,Biolog微生物自动鉴定系统建库条件为33 ℃,最长36 h的培养,这些菌株在此条件下往往未能将其代谢特征充分表达,因此在鉴定失败时,系统给出的原因往往是阳性反应孔少,无法与数据库中录入菌株进行比较。综上,对于水系统中微生物的鉴定分析,16S rDNA序列分析能获得较准确的鉴定结果。
4.4 分离微生物特性
16S rDNA序列分析的鉴定结果显示,占比最多的是鞘氨醇单胞菌属[12],其次是叶杆菌属和青枯菌属。这些菌的共同特点是常见于潮湿的环境中,如土壤、河流、湖泊等。青枯菌属在水系统管道中易形成生物膜[12],能分解芳香烃和酚类物质,因此能耐受酚类消毒剂。文献报道[13]纯化水中常见分离微生物类群基本一致,这些微生物均为革兰阴性杆菌,对营养要求不高,通常可在水为介质的寡养条件下生长。一般认为,无论是无菌药品还是非无菌药品,污染革兰阴性杆菌的危害会高于其他种类的细菌[9]。近年,与微生物相关的召回事件明显增加,美国食品药品监督管理局(FDA)在非无菌召回事件中,一半以上的召回是因为革兰阴性杆菌的污染。因此,要对水系统中污染微生物的数量和种类加以关注,必要的情况下,应采取适当的措施[14]。

表2 纯净水微生物限度检查各国药典对比
4.5 污染原因分析及建议
与制药工业中的纯水系统相比,本实验室的水系统未使用循环水设计,除终端取水口装有除菌过滤器外,7个出水口均未采取有效的消毒灭菌措施。依靠终端过滤器仅能对储水器和流经管路的水进行单次纯化,无法有效地降低微生物滋生的风险。另外,实验室水系统配置的储水器容积偏大,或管路过长,特别是取样部位和分路支管存有积水,同样会增大样本微生物污染的风险。
为减少微生物污染,建议实验室水系统选择较小的储水器,储水器前端和终端均安装除菌过滤器,必要时可在储水器中安装加热消毒装置、紫外线消毒装置或定期使用化学试剂消毒,并保证系统的管道尽可能短。
5 结论
本研究对微生物实验室的水系统进行了微生物检验,并对分离菌进行了鉴定与分析,分离得到的37株菌均为革兰阴性菌,大多数菌具有寡营养、嗜低温、易形成生物膜的特点,有些菌为条件致病菌。本研究初步表明:采用16S rDNA序列分析技术对水系统中微生物鉴定效果较好,Riboprinter全自动微生物基因指纹鉴定系统则更适用于近缘微生物的分型溯源,自动生化鉴定系统对于水系统微生物的鉴定效果不佳。建议对实验室水系统要定期进行微生物检验,并根据监测情况定期采取消毒措施,如热消毒、化学试剂消毒、冲洗或排放等方法。若纯化水用于培养基或消毒剂的配制,使用前可使用滤膜过滤,并定期更换滤膜。

