玉米赤霉烯酮化学发光免疫分析检测系统设计
吴才章,刘冬冬,胡 良
·研究速报·
玉米赤霉烯酮化学发光免疫分析检测系统设计
吴才章,刘冬冬,胡 良
(河南工业大学电气工程学院,郑州 450001)
为了保障粮食安全,该研究根据玉米赤霉烯酮抗原抗体反应,以及辣根过氧化物酶催化鲁米诺过氧化氢反应产生化学发光,设计一款应用于粮食行业的玉米赤霉烯酮检测系统。采用侧窗型高精度光电倍增管MD983以及16位AD转换芯片,实现化学发光强度信号的准确测量;步进电机驱动旋转精密转台,通过优化步进电机的S型脉冲驱动控制曲线参数,完成转台的高精度定位控制,实现光电倍增管的测试窗口和化学发光孔精确对准;通过精密直线导轨滑台驱动加样器的进给,实现反应液微米量级的准确微量加样。利用竞争性免疫分析方法,使得赤霉烯酮毒素为0g/kg情况下,化学发光反应具有最大发光量,解决真菌毒素低浓度情况下的检测精度难题。经过试验验证,系统检出限为0.1g/kg,样品加标回收率在90%以上,标准曲线决定系数为0.996 5,系统检测玉米赤霉烯酮的线性范围为0~60g/kg。研究表明建立的玉米赤霉烯酮检测系统满足国家粮食行业对于粮食中玉米赤霉烯酮含量检测要求,为真菌毒素检测仪器的国产化提供参考。
粮食;检测系统;玉米赤霉烯酮;化学发光免疫分析;光电倍增管
0 引 言
粮食是活的生命体,储藏期间由于自身的呼吸氧化、各种霉的活动,以及外界环境的影响,粮食在不断发生各种生理和化学变化[1]。粮食微生物在粮食中普遍存在且种类多样,包括细菌,放线菌,以及真菌类中的霉菌。粮食中的霉菌特别是一些有害霉菌不仅可以导致粮食发生霉变,而且还可以产生具有强烈毒性和致癌性的真菌毒素物[2]。以玉米赤霉烯酮为例,它能对肝脏、肾脏、生殖系统和免疫系统产生明显的损伤,对细胞和遗传性也有毒性作用,能引起细胞凋亡、畸形、损害DNA等[3]。随着社会的发展和人民生活水平的不断提高,人们的饮食观念也在发生转变,已不再满足于吃饱吃好,更关注吃得安全、吃得健康,粮食储藏过程中真菌毒素的存在已经成为我国粮食、食品安全的重要隐患。为了减少粮食中玉米赤霉烯酮对人体的危害,国家出台了相关的法律法规限制食品中和动物饲料中的玉米赤霉烯酮含量,国家标准规定饲料中的检测限小于50g/kg,食品中的检测限小于60g/kg[4]。
目前检测真菌毒素常用的方法主要有高效液相色谱法[5]、气相色谱法[6]和免疫学检测法[7]等。前两种方法检测灵敏度和准确度高,但是需要昂贵的专业设备和专业人员的复杂操作,检测周期也比较长[8-9]。免疫学检测方法是利用抗原与抗体的特异性结合,再通过同位素、荧光素或酶等标记技术加以放大和显示[10-11]。该方法与其他方法相比,具有特异性强、灵敏度高的特点,较为典型的是酶联免疫法(Enzyme-Linked ImmunoSorbent Assay),但是该方法有时会出现交叉反应、假阳性反应,组织样品处理时间长,pH值有时会影响检测结果等现象,因此检测的稳定性差、准确性不能得到保证。
为了克服酶联免疫法的缺点,科研工作者进一步研究出了化学发光免疫分析法[12-13]。其利用化学发光作为抗原抗体反应的指示系统,发光物质直接作为抗原抗体的标记物,具有灵敏度高、线性宽、操作简单、结果准确等优点[14]。化学发光免疫分析方法最早应用于临床,在医学领域已经成为一类普遍采用的快速检测方法[15]。由于化学发光免疫法能够安全快速、准确检测出需要检测的抗原抗体,因此国内外的学者试图把该方法引进到食品检测中,开展了一些初步的试验研究[16]。但是中国粮食产品的附加值比较低,粮食储藏企业对真菌毒素检测的价格较为敏感。化学发光免疫分析所用的试剂盒成本较高,再加上检测仪器价格昂贵,导致该方法在粮食行业的应用受到了很大的限制。研制低成本的储粮真菌毒素化学免疫发光快速检测仪器,可满足中国粮食储藏企业的需要,成为当务之急。本文针对中国粮食中玉米赤霉烯酮的检测问题,设计一款应用于粮食行业的玉米赤霉烯酮检测系统。根据化学发光免疫反应产生化学发光,采用竞争性免疫分析方法,并进行试验测试,结果为真菌毒素检测仪器的国产化提供参考。
1 化学发光酶免疫分析检测系统设计
1.1 系统整体设计
系统主要由化学反应池、定位控制系统、加样控制系统、数据采集系统4个部分组成。反应池是由5个位于旋转精密转台上的化学发光孔组成;定位控制系统由步进电机和精密转台组成;加样系统由直线导轨滑台和加样器组成;数据采集系统由光电倍增管模块MD983、AD转换器件和单片机组成。化学反应池、光电倍增管模块、旋转转台、加样器、采样系统置于恒温箱内部,恒温箱购自上海一恒科学仪器有限公司,恒温箱置于暗室内,控制恒温箱的温度误差范围为±0.5 ℃。免疫分析仪结构示意图如图1所示[17-18]。
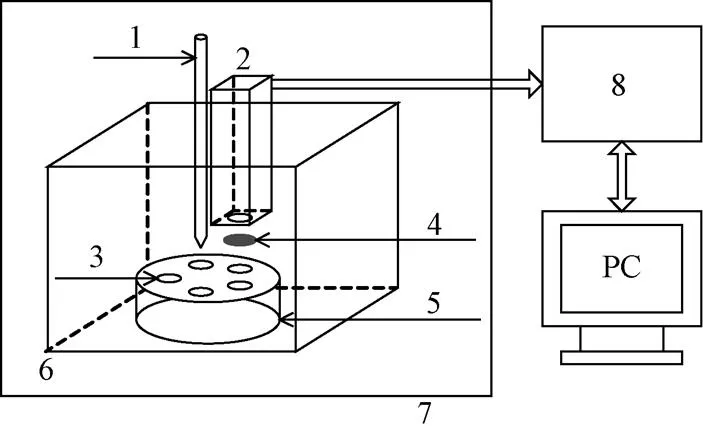
1.加样器 2.MD983 3.反应池 4.滤光片 5.精密转台 6.恒温箱 7.外暗室 8.单片机
1.2 数据采集系统设计
数据采集系统以嵌入式微处理器STM32F103ZET6为核心,化学发光强度检测采用PerKin Elmer的MD983光子计数模块,内置高压电路,测量精度可达单光子量级。MD983输出模拟电压信号,需要进行模数转换,尽管STM32内置了12位高速A/D转换器,但是这种内置的A/D转换器很难满足系统的精度要求。因此,系统外接美国Analog Devices, Inc.生产的A/D转换专用芯片AD7606,该芯片属于逐次逼近型16位模拟数字转换器,内置数字滤波器,最高采样频率可达200 ksps,可满足系统的精度要求[19]。
AD7606提供串行和并行两种接口模式,系统采用SPI串行方式与单片机进行通讯和数据交换。AD7606 OS[2:0]是采样倍率选择引脚,与STM32单片机的PF[13:15]连接。RANGE是模拟输入电压范围选择引脚,接单片机的PB8。PAR/SER是通讯接口模式选择引脚,高电平时为SPI串行接口模式,低电平时为并行接口模式,与单片机的PB15连接。RD/SCLK是时钟输入引脚,DB7/Dout串行数据输出引脚,分别接单片机的PB13和PB14。CS是片选引脚,接单片机的PA4,RST为复位引脚,接单片机的PB5。CVA和CVB是开始转换引脚,CVA控制V1~V4通道,CVB控制V5~V8通道,接单片机的PB6和PB7。STM32单片机与AD7606接口电路如图2所示。
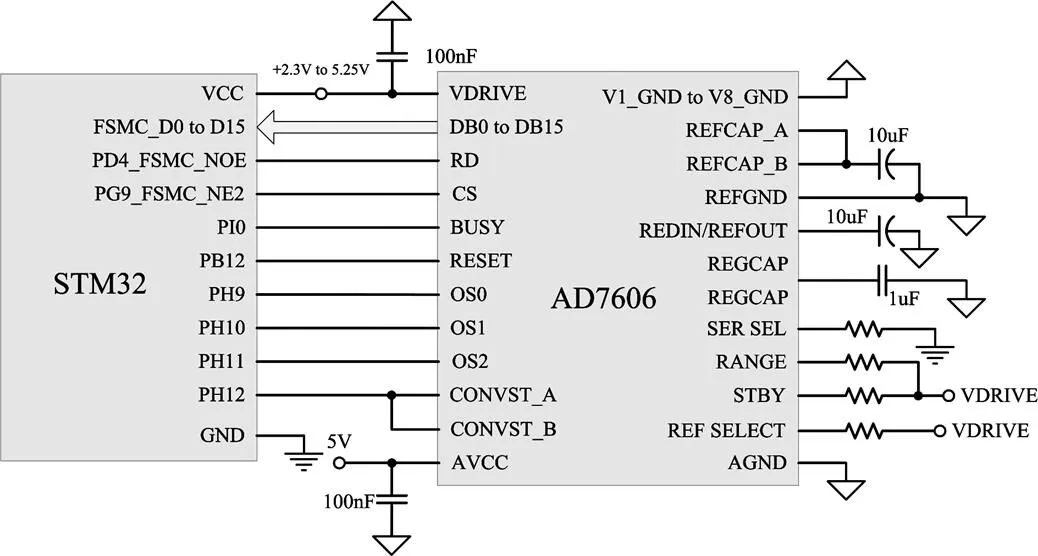
图2 STM32单片机与AD7606接口电路图
1.3 加样控制系统设计
微量加样系统采用步进电机、丝杠导轨滑台、进样器以及固定板组成,加样系统的结构示意图如图3所示。为了实现加样量的精确控制,加样系统加装了旋转编码器。设置完滴定液体积后,单片机控制步进电机驱动丝杆的上下运动,进而带动加样器的活塞运动,实现设置体积滴定液加注功能。加样系统在保证化学发光反应加样量的一致性、控制反应进程、提高检测精度、控制测量成本等方面具有重要作用。
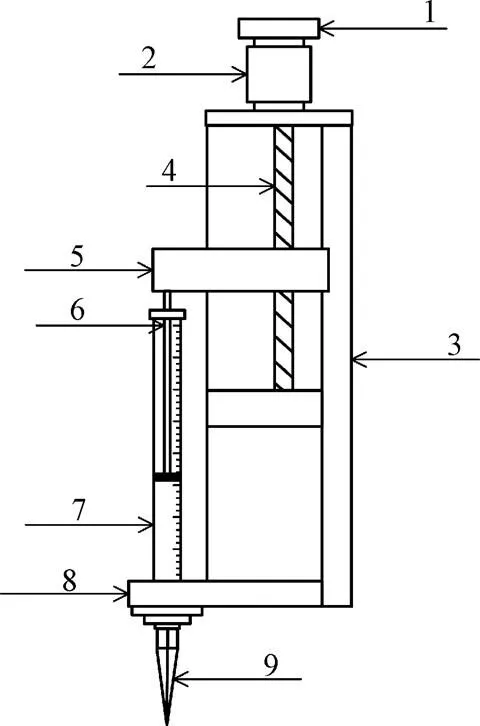
1.编码器2.步进电机3.圆柱导轨4.滚珠丝杆5.提拉固定板6.柱塞杆7. 250 μL进样器8.固定板9.滴定头
加样分辨率是检测系统重要的参数。加样器采用上海高鸽工贸有限公司的250L进样器。控制器发送脉冲数与进样量的关系如式(1)。
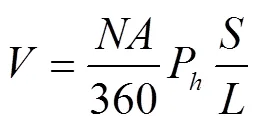
式中为进样量,L;为脉冲数;为步进电机步距角,(°);P为丝杆导程,mm;为进样器总容量,L;为进样器行程,mm。
加样系统中传动机构采用滚珠直线导轨滑台(含42步进电机),其直线丝杆的导程=5 mm,进样器总容量=250L,进样器行程=50 mm。为避免电机转子在非整步位置停止时产生振动和噪音,控制步进电机整步运行为1,这样步进电机的步距角度为1.8°,当步进电机接收到一个脉冲以后,加样系统的加样分辨率如式(2)。
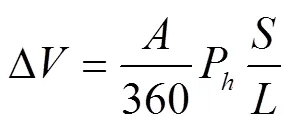
由式(2)可知,加样系统的加样分辨率Δ=0.125L。考虑到丝杆和导轨等的机械误差和间隙,加样量很难控制到这个量级,具体加样量的多少还要通过高精度的旋转编码器计算。
1.4 转台定位控制系统
如图1所示,5个化学反应发光孔均匀分布在精密转台的一个圆周上,每两个孔之间的夹角是72°。加样器加样孔和光电倍增管的测试孔位于一个同样大小的圆周上,位于加样孔所在圆周的正上方,两者之间的夹角也是72°。工作时首先将加样孔对准化学发光孔,单片机控制加样器滴定一定量的化学发光试剂到化学反应发光孔,发生化学发光反应。然后步进电机驱动转台,实现光电倍增管测试窗口和化学发光孔精确对准,单片机即可采集相应的化学发光信号。定位控制系统由步进电机和旋转精密转台组成,转台的定位精度和旋转运动精度是实现分析仪高精度测量的关键。
旋转台的定位采用两级方式定位,即通过霍尔元件实现粗定位,通过发光强度测试实现精定位。旋转台安装若干霍尔元件实现定位功能,但是霍尔元件定位存在一定的误差,难以实现毫米量级的精确定位,为此考虑通过化学发光强度的实时检测,实现旋转台的精确定位。由于反应池中的化学免疫发光反应的发光会持续一段时间,而且发光强度会保持基本恒定。在此时间段内,左右移动转台,可以通过寻找最大化学发光强度的方法进行旋转台的精确定位。
在精确定位的基础上,转台的旋转精度主要通过严格控制步进电机的驱动脉冲数来实现,然而在一定负载下,步进电机启动和停止时,容易出现丢步现象,影响转台的旋转精度,进而影响化学发光孔和光电倍增管的测试窗口精确对准。由于购置的精密转台难以安装旋转编码器等位置传感器,为了消除步进电机的失步现象,采用S形加减速曲线对步进电机的驱动脉冲频率进行控制[20]。
2 玉米赤霉烯酮检测系统检测试验
2.1 试验材料
96孔玉米赤霉烯酮抗原包被反应板、玉米赤霉烯酮标准样品溶液、Lluninol-H2O2化学发光试剂(鲁米诺浓度为2.5 mol/L、过氧化氢的浓度为4×10-3mol/L)、抗体工作液、酶标二抗(辣根过氧化物酶)、洗涤液等均购自上海生工生物股份有限公司;纯净玉米样品购买于郑州市某粮食市场;含玉米赤霉烯酮的实际样品购买于郑州市某粮食收购站,在实验室潮湿条件下经过不同时间的存放;化学发光免疫分析检测系统为自主研制。
2.2 试验步骤
1)将玉米样品利用专用粉碎机进行粉碎,得到玉米粉试验样品,并进行编号。
2)每组样品称取4 g,然后加入100 mL按照体积比7:3配置好的甲醇水溶液,震荡摇匀5 min,使得溶液充分溶解。
3)每组样品取10 mL,设置高速离心机的转速为5 000 r/min,离心3~5 min以后,分别取出上清液即为待测样液。
4)根据需要检测的样品数量,在精密转台反应池内插入相应数量的酶标板微孔。通过更换进样器,由计算机控制加样器在各个微孔中加入50L待测样品溶液。
5)控制加样器分别在标准样品孔和待测样品孔加入50L抗体工作液和50L酶标二抗溶液,然后在恒温箱中恒温25 ℃孵育30 min左右。
6)孵育结束后,人工取出微孔板,倒掉微孔里面的液体溶液,加入250L洗涤液,放置1 min以后倒掉液体,重复洗涤3~5次以后,拍干微孔板里面的残余的液体。将充分反应以后的微孔放回到恒温箱中,加入发光试剂,通过检测系统检测发光强度。
2.3 化学发光免疫分析定标曲线的建立
根据《食品安全国家标准食品中真菌毒素限量》GB2761-2017规定储粮及粮食制品中玉米赤霉烯酮(Zearalenone)的检测限小于60g/kg。以0、5、20、40、60g/kg 浓度的玉米赤霉烯酮(Zearalenone)标准样品进行测试,绘制定标曲线。每组反应测量时间是5 min,第4分钟作为有效采样,此后每秒种采样一次,采样60次,计算平均值X和标准差[21-22]。
由于采用竞争性化学发光酶免疫分析的方法,理论上0g/kg标准样品浓度有最大的发光值,因此以0g/kg为参考对象,其他浓度发光强度和0g/kg发光强度比值的百分数作为相对发光强度。不同浓度条件下ZEN化学发光相对强度定标曲线如图4所示,通过origin软件拟合标准曲线为=−0.013+0.990,拟合曲线呈现良好的线性,决定系数为0.996 5。

图4 玉米赤霉烯酮化学发光相对强度定标曲线
2.4 加标回收率试验
在纯净玉米样品中分别添加标准玉米赤霉烯酮(Zearalenone)抗原,添加后形成加标样品(ZEN含量分别为20、50、100g/kg),按照试验步骤进行测试,每个浓度检测3次。ZEN标准样品的加标回收率试验结果如表1所示。结果表明该方法检测的ZEN线性范围内回收率在90%以上,并且呈现出浓度越低回收率越高的规律,说明设计的检测系统提取率、重现率良好。
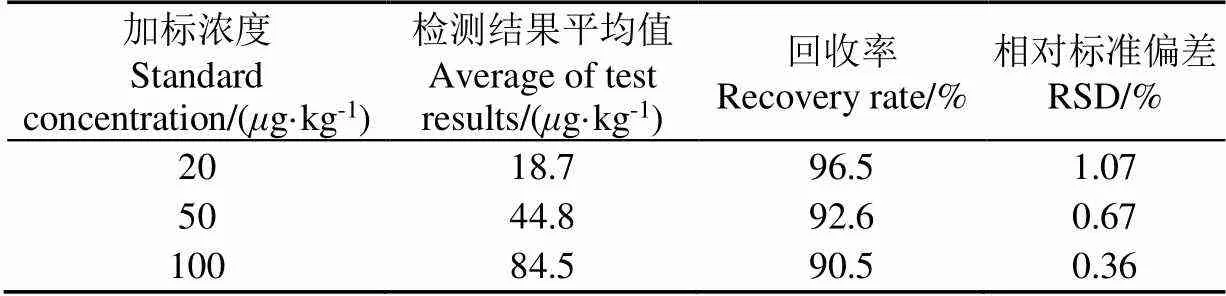
表1 玉米赤霉烯酮标准样品的加标回收率
为了验证自主研制的真菌毒素检测仪的准确性,对3种未知实际样品进行测量比对。本文方法和酶联免疫分析法样品测定比对结果如表2所示。

表2 化学发光免疫分析法和酶联免疫法比对结果
2.5 检出限测量及计算
对0g/kg样品(最大发光强度)平行测定20次,计算其相对发光强度的平均值和标准差,将3倍标准差乘以ZEN化学发光相对强度定标曲线的斜率(置信常数取3)[16,23],得到的浓度即为检出最低浓度,该方法检出限为0.1g/kg。
3 结 论
1)本文采用化学发光免疫分析法,根据玉米赤霉烯酮抗原抗体反应,以及辣根过氧化物酶催化鲁米诺过氧化氢反应产生化学发光,设计一款应用于粮食行业的玉米赤霉烯酮检测系统。
2)采用高性能的STM32F103ZET6作为化学发光免疫分析仪的主控芯片,光电倍增管作为数据采集系统的核心器件,配合定位控制系统、加样控制系统和采样系统实现化学免疫发光强度的测量。最终完成玉米真菌毒素含量的定量检测。
3)经过试验验证,该方法标准样品加标回收率在90%以上,标准曲线决定系数为0.996 5,线性范围为0~60g/kg,检出限为0.1g/kg,说明该检测系统具有良好的重现性,满足国家粮食行业对于粮食中玉米赤霉烯酮含量的检测要求。
[1]黄淑霞,蔡静平,田海娟. 主要粮食品种储藏期间霉菌活动特性研究[J]. 中国粮油学报,2010,25(1):99-102.
Huang Shuxia, Cai Jingping, Tian Haijuan. An effective method for genomic DNA extraction from rat intestinal microflora[J]. Journal of the Chinese Cereals and Oils Association, 2010, 25(1): 99-102. (in Chinese with English abstract)
[2]汪阿恋,叶燕珠,张贤金,等. 谷物中玉米赤霉烯酮化学发光免疫分析方法的建立[J]. 福建师范大学学报:自然科学版,2018,34(1):65-70.
Wang Alian, Ye Yanzhu, Zhang Xianjin, et al. Establishment of chemiluminescence immunoassay for zearalenone in cereals[J]. Journal of Fujian Normal University: Natural Science Edition, 2018, 34(1): 65-70. (in Chinese with English abstract)
[3]王青,周丹朝,赵煜,等. 玉米赤霉烯酮的生殖毒性研究进展[J]. 畜牧兽医杂志,2014,33(4):32-35.
Wang Qing, Zhou Danchao, Zhao Yu, et al. The development of zearalenone reproduction toxicity[J]. Journal of Animal Science and Veterinary Medicine, 2014, 33(4): 32-35. (in Chinese with English abstract)
[4]国家食品药品监督管理总局. 食品安全国家标准食品中真菌毒素限量:GB2761-2017[S]. 北京:中国标准出版社,2017.
[5]朱孟丽,彭聪,洪振涛. 高效液相色谱法对饲料中玉米赤霉烯酮的测定[J]. 饲料工业,2007,28(1):37-38.
Zhu Mengli, Peng Cong, Hong Zhentao. HPLC determination of zearalenone in feed[J]. Feed Industry, 2007, 28(1): 37-38. (in Chinese with English abstract)
[6]徐一达,袁晓,王海鸣,等. 色谱法检测真菌毒素的研究进展[J]. 粮油食品科技,2018,26(6):54-61.
Xu Yida, Yuan Xiao, Wang Haiming, et al. Research progress in detection of mycotoxins by chromatography[J]. Science and Technology of Cereals, Oils and Foods, 2018, 26(6): 54-61. (in Chinese with English abstract)
[7]Nicholas W T, Heli B, Monika Szabo-Vezse, et al. Analytical methods for determination of mycotoxins: An update (2009–2014)[J]. Analytica Chimica Acta, 2015, 901: 12-33.
[8]张亮亮,付时雨,谢传龙,等. 高效液相色谱法测定醋酸羟丙基甲基纤维素琥珀酸酯中的酰基含量[J]. 造纸科学与技术,2012,31(4):71-75.
Zhang Liangliang, Fu Shiyu, Xie Chuanlong, et al. Determination of acyl content in hydroxypropyl methylcellulose acetate succinate by high performance liquid chromatography[J]. Paper Science & Technology, 2012, 31(4): 71-75. (in Chinese with English abstract)
[9]王韦岗,强敏,端礼钦. 复合免疫亲和柱-高效液相色谱法同时测定谷物及其制品中9种真菌毒素[J]. 色谱,2018,36(12):1330-1336.
Wang Weigang, Qiang Min, Duan Liqin. Simultaneous determination of nine mycotoxins in cereal and cereal products by high performance liquid chromatography with composite immunoaffinity clean-up column[J]. Chinese Journal of Chromatography, 2018, 36(12): 1330-1336. (in Chinese with English abstract)
[10]李江,綦艳,佘之蕴,等. 酶联免疫法对食用油中黄曲霉毒素B1的检测[J]. 广东化工,2017,44(11):73-74.
Li Jiang, Qi Yan, She Zhiyun, et al. Detection of aflatoxin B1 in edible oil by enzyme-linked immunosorbent assay[J]. Guangdong Chemical Industry, 2017, 44(11): 73-74. (in Chinese with English abstract)
[11]王川,程郁菁,雷静,等. 探讨酶联免疫法与胶体金法检测乙肝表面抗原的效果[J]. 生物化工,2018,4(6):72-78.
Wang Chuan, Cheng Yujing, Lei Jing, et al. To investigate the effect of enzyme-linked immunosorbent assay and colloidal gold assay on detection of hepatitis b surface antigen[J]. Biological Chemical Engineering, 2018, 4(6): 72-78. (in Chinese with English abstract)
[12]丁丽华,于斐,张冠军,等. 脱氧雪腐镰刀菌烯醇的高灵敏化学发光磁酶免疫法检测[J]. 郑州大学学报:医学版,2017,52(2):134-137.
Ding Linhua, Yu Fei, Zhang Guanjun, et al. Determination of deoxynivalenol by a sensitive method of magnetic enzyme chemiluminescence immunoassay[J]. Journal of Zhengzhou University: Medical Sciences, 2017, 52(2): 134-137. (in Chinese with English abstract)
[13]金茂俊,王静,杨丽华, 等. 化学发光免疫分析方法在食品安全检测中的研究进展[J]. 食品安全质量检测学报,2014,5(3):840-845.
Jin Maojun, Wang Jing, Yang Lihua, et al. Latest progress of chemiluminescent immunoassay in food safety detection[J]. Journal of Food Safety and Quality, 2014, 5(3): 840-845. (in Chinese with English abstract)
[14]邱云青,王伟,李凤琴. 食品中玉米赤霉烯酮化学发光酶免疫方法建立[J]. 中国公共卫生,2010,26(12):1561-1563.
Qiu Yunqing, Wang Wei, Li Fengqin. Development of a chemiluminescent immunoassay for detection of zearalenone in foods[J]. Chinese Journal of Public Health, 2010, 26(12): 1561-1563. (in Chinese with English abstract)
[15]肖勤,林金明. 化学发光免疫分析方法的应用研究进展[J]. 分析化学,2015,43(6):929-938.
Xiao Qin, Lin Jinming. Advances and applications of chemiluminescence immunoassay in clinical diagnosis and foods safety[J]. Chinese Journal of Analytical Chemistry, 2015, 43(6): 929-938. (in Chinese with English abstract)
[16]陈永忠,何磊良,王纳纳,等. 呕吐毒素化学发光酶联免疫分析方法的建立及应用[J]. 河南工业大学学报,2018,39(4):79-84.
Chen Yongzhong, He Leiliang, Wang Nana, et al. Development and application of enhanced chemiluminescence enzyme-linked immunoassay on the determination of deoxynivalenol[J]. Journal of Henan University of Technology: Natural Science Edition, 2018, 39(4): 79-84. (in Chinese with English abstract)
[17]吴才章,王继伟. 小麦超弱延迟发光测试系统[J]. 光子学报,2014,43(2):121-126.
Wu Caizhang, Wang Jiwei. Testing system of the ultra-weak delayed bioluminescence from wheat[J]. Acta Photonica Sinica, 2014, 43(2): 121-126. (in Chinese with English abstract)
[18]刘冬冬,吴才章. 基于化学发光的玉米赤霉烯酮检测系统设计[J]. 粮食加工,2019,44(1):51-54.
Liu Dongdong, Wu Caizhang. Design of zearalenone detection system based on chemiluminescence[J]. Grain Processing, 2019, 44(1): 51-54. (in Chinese with English abstract)
[19]陶海军,张一鸣,曾志辉. 基于AD7606的多通道数据采集系统设计[J]. 工矿自动化,2013,39(12):110-113.
Tao Haijun, Zhang Yiming, Zeng Zhihui. Design of data collection system with multi-channel based on AD7606[J]. Industry and Mine Automation, 2013, 39(12): 110-113. (in Chinese with English abstract)
[20]周团坤,张莹,杨晓明,等. 基于STM32的步进电机离散化S形曲线加减速控制方法[J]. 自动化与仪表,2017,32(6):57-61.
Zhou Tuankun, Zhang Ying, Yang Xiaoming, et al. Discrete S-curve acceleration and deceleration control method for stepper motors based on STM32[J]. Automation & Instrumentation, 2017, 32(6): 57-61. (in Chinese with English abstract)
[21]熊挺,蒋蔚,韩阳瑞,等. 家禽饲料中玉米赤霉烯酮化学发光酶联免疫分析方法的建立[J]. 畜牧与兽医,2018,50(2):122-130.
Xiong Ting, Jiang Wei, Han Yangrui, et al. Development of chemiluminescence enzyme immunoassays for determining zearalenone in poultry feed[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(2): 122-130. (in Chinese with English abstract)
[22]刘贝贝,于斐,玉崧成,等. 增强化学发光酶联免疫分析用于伏马菌素B1的快速检测[J]. 郑州大学学报:理学版,2017,49(4):76-81.
Liu Beibei, Yu Fei, Yu Songcheng, et al. Enhanced chemiluminescence enzyme-linked immunoassay for rapid detection of fumonisin B1[J]. Journal of Zhengzhou University: Natural Science Edition, 2017, 49(4): 76-81. (in Chinese with English abstract)
[23]叶云锋,李研东,吴雨洋,等. 化学发光免疫分析方法检测粮食谷物中赭曲霉毒素A残留[J]. 食品安全质量检测学报,2017,8(7):2787-2791.
Ye Yunfeng, Li Yandong, Wu Yuyang, et al. Determination of ochratoxin a residues in grains and cereals by chemiluminescence immunoassay[J]. Journal of Food Safety & Quality, 2017, 8(7): 2787-2791. (in Chinese with English abstract)
Design of chemiluminescence immunoassay detection system for zearalenone
Wu Caizhang, Liu Dongdong, Hu Liang
(450001,)
In order to ensure food safety, a zearalenone(ZEN) detection system was developed based on the measurement of the weak chemiluminescence signal of the reaction between the luminol and hydrogen peroxide(H2O2) catalyzed by horseradish peroxidase (HRP) labeled by ZEN for the food industry. The high-precision photomultiplier tube MD983 with side window and 16-bit AD conversion chip were used to realize accurate measurement of the chemiluminescence intensity signal. Rotating precision turntable was drived by the stepping motor. By optimizing the parameters of S-type pulse drive control curve of the stepping motor, the high-precision positioning control of the turntable was completed, and the test window of the photomultiplier tube and the chemiluminescence hole were accurately aligned. The accurate micro-sampler was driven by a linear guide slide table, and the accurate micro-sample injection of the micron level of the reaction liquid was realized. The competitive immunoassay method was adopted. When the concentration of ZEN was equal to 0g/kg, there was a maximum amount of luminescence, which solved the problem of detection accuracy under the condition of low concentration of ZEN. The results showed that the detection limit of the system was 0.1g/kg, the standard addition recovery was more than 90%, the determination coefficient of the standard curve was 0.995 6, and The linear range of the system for detecting zearalenone was 0-60g/kg. The results show that the Zen detection system can meet the requirements of national food industry for Zen content detection in cereals, and provide a reference for the localization of mycotoxin detection instruments.
grain; detection system; zearalenone; chemiluminescence immunoassay; photomultiplier tube
吴才章,刘冬冬,胡良. 玉米赤霉烯酮化学发光免疫分析检测系统设计[J]. 农业工程学报,2020,36(17):308-312. doi:10.11975/j.issn.1002-6819.2020.17.036 http://www.tcsae.org
Wu Caizhang, Liu Dongdong, Hu Liang. Design of chemiluminescence immunoassay detection system for zearalenone[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(17): 308-312. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.17.036 http://www.tcsae.org
2020-02-12
2020-06-04
河南省科技攻关项目(182102110461)
吴才章,教授,研究方向:光电检测技术在粮油食品方面的应用研究。Email:wucaizhang@haut.edu.cn
10.11975/j.issn.1002-6819.2020.17.036
S24; TS207.4
A
1002-6819(2020)-17-0308-05

