基于“证据推理与模型认知”核心素养下的主题式教学实践
谭华 邓小国

摘 要:普通高中化学课程标准明确提出高中化学要全面落实化学核心素养,从而实现课程标准提出“立德树人”的任务。核心素养的落实需要在课堂教学过程中实施,通过以“氧化还原反应第一课时”教学为载体尝试探索“证据推理与模型认知”的核心素养的培养,为全面提高学生综合素养而奠定基础。
关键词:证据推理与模型认知;主题式;教学实践
一、教材分析
“氧化还原反应”知识处在人教版《必修1》第二章第三节。有关氧化还原反应知识的教学在中学新课程体系中分为三阶段进行:第一阶段是在初中化学中从得氧和失氧的角度对氧化还原进行学习;第二阶段是在高中化学必修1中在初中学习的基础上进一步学习,要求学生能用化合价升降和电子转移的观点来理解并掌握氧化还原反应以及掌握常见的氧化剂和还原剂;第三阶段是通过后续元素及其化合物的学习:如金属及其化合物和非金属及其化合物的学习,对氧化还原反应有了更深入更全面的理解。本节教学内容处在第二阶段,在回顾初中的基本类型反应和氧化还原反应的重要知识的前提下以此为铺垫展开对氧化还原反应的较深层次的学习,同时也为后续元素及其化合物的学习起到了桥梁和纽带的作用。氧化还原反应知识是高中化学重要理论知识之一,不仅本章节的教学重点,同时也是整个高中化学的教学重点。
二、学情分析
有关氧化还原的知识,学生在初中就已经从得、失氧的角度学习过,因此有了一定的知识基础,同时学生也具备了一定实验操作基础,也具备了一定的分析和归纳问题的能力,因此在本節教学中学生通过催原子结构模型的认知能推测出氧化还原反应的一般规律,再通过具体实验进一步验证了猜想,对具体的实例进行比较和归纳从而得出氧化还原反应的规律,架构起学习理论的一般认识模型。高一的学生好奇心强、热情比较高,所以将探究的任务交给学生完成,以激发学习兴趣,从而培养学生的实验探究能力。
三、教学目标
(一)通过本节课的学习,掌握现实生活中氧化还原反应是普遍存在的,在给人类带来益处的同时也给社会造成了很大的损失,培养学生用辩证的思维来看待问题。
(二)通过学生对已熟知的H2还原CuO为切入口,先从得失氧角度来分析,然后在从化合价、最后从得失电子角度学习,将知识在潜移默化的过程得到了落实,使学生不仅能从化合价角度判断氧化还原反应、同时也理解氧化还原反应的实质是电子的转移,进一步培养学生从多角度看待问题的能力。
(三)将问题设计成实验探究形式,在实验探究和理论推理的过程中培养学生合作共赢的思想,再通过对常见化学方程式的分析建构起四种基本反应类型与氧化还原反应的关系,充分的培养学生模型建构思想。
四、教学重点与难点
在复习初中学习过H2还原CuO时,变换视角从化合价分析氧化还原反应,再通过实验探究和从微观结构分析化合价变化的原因是电子转移,从而将重难点都得以突破和落实。
五、教学过程:
【导入】展示:一个新切开的苹果,另一个是切开很久的苹果,为什么呈现的颜色不一样呢?你知道为什么铁链等放置久了会生锈?它们都发生了什么反应?
【学生】氧化反应。
【思考】现代炼铁(Fe2O3或Fe3O4→Fe)过程中发生了什么反应?
【学生】回答不出。
【资料】早期科学家因金属矿石中与金属结合的氧被移除了,金属矿石因此被还原成金属单质,称还原反应(有减轻、减少之意)。
【思考】初中我们学过什么叫做氧化反应,什么叫做还原反应?
【学生】得氧的反应是氧化反应,失氧的反应是还原反应。
【小结】这两种反应分类的依据:得氧还是失氧。
【思考与交流1】尝试从得氧失氧角度分析氧化还原反应。
Fe2O3 + 3CO 2Fe + 3CO2
【学生】Fe2O3失去氧,发生还原反应。
CO得到氧,发生氧化反应。
【问题】两种反应在时间上是怎样关系?
【学生】氧化反应和还原反应是同时进行。
【思考交流2】请标出变价元素的化合价,并分析哪些物质发生氧化反应,哪些物质发生还原反应。
(1)在加热条件下:H2还原CuO;
(2)在加热条件下:CO还原CuO;
(3)在高温条件下:C与H2O反应。
【学生1】H2由0价升高到+1价,发生氧化反应;CuO中的Cu由+2价降到0价,发生还原反应。
【学生2】CO中的C由+2价升高到+4价,发生氧化反应;CuO中的Cu由+2价降到0价,发生还原反应。
【学生3】C由0价升高到+2价,发生氧化反应;H2O中的H由+1价降到0价,发生还原反应。
【问题】这几种反应有什么共同的特征?
【学生】都是氧化还原反应,同时都有化合价变化。
【追问】你知道化合价升降与氧化还原反应的关系?
【学生】氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
【小结】氧化还原反应:凡是有元素化合价升降的化学反应。
【实验探究】实验并分析下列反应是否是氧化还原反应?若是则判断哪种物质发生氧化反应、哪种物质发生还原反应?
实验1:铁与硫酸铜溶液反应。
实验2:锌与稀盐酸反应。
【学生1】实验1:铁片上出现铜,属于氧化还原反应,铁元素化合价升高发生氧化反应,铜元素化合价降低发生还原反应。
【学生2】实验2:锌片上有H2生成,属于氧化还原反应,锌元素化合价升高发生氧化反应,氢元素化合价降低发生还原反应。
【问题】你是如何判断出是氧化还原反应的?
【学生】有元素化合价发生变化。
【小结】化合价变化是判断氧化还原反应的另一种依据。
【思考交流3】你知道氧化还原反应中化合价变化的原因?
【视频】金属钠与氯气的反应。
【思考】化学反应的实质是什么?(阅读课本P36页2、3段)
【学生】化学反应实质是原子间的重新组合。
【问题】你知道如何从原子结构来分析原子间重新组合的吗?
【学生】最外层电子要达到稳定结构,而化合价的升降与电子转移密切相关。
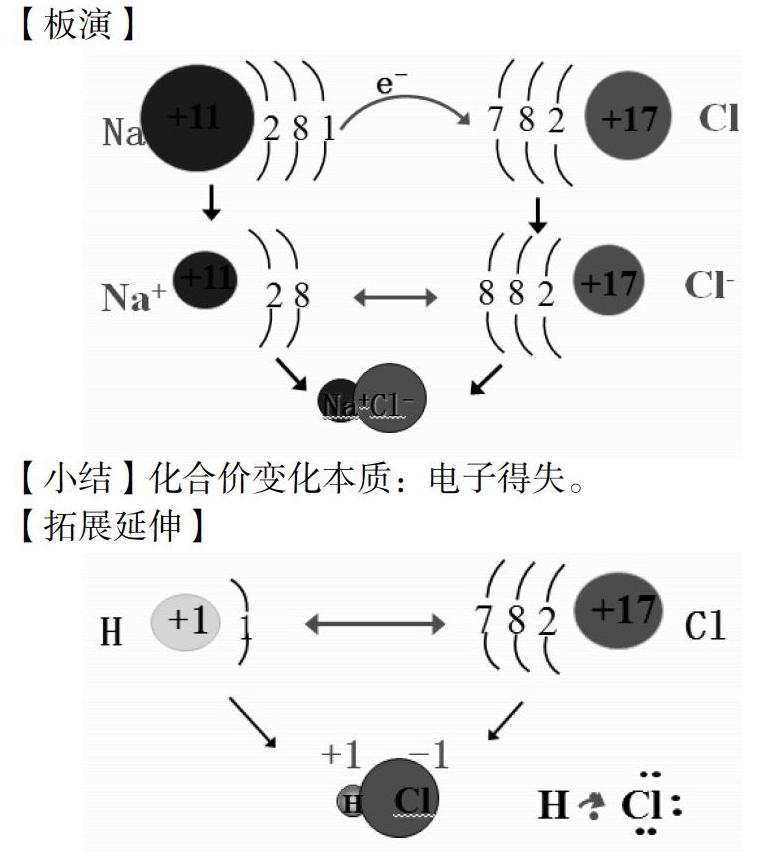
【板演】
【小结】化合价变化本质:电子得失。
【拓展延伸】
【小结】化合价变化本质:电子对的偏移。
【总结】电子的转移(得失或偏移)是元素化合价发生变化的原因,这也是氧化还原反应的本质。
【任务】标出并分析下列反应中电子转移、化合价变化、发生反应类型。
Zn+ CuSO4 = ZnSO4 + Cu
【学生】Zn元素的化合价升高、失去电子、被氧化、发生氧化反应。
Cu元素的化合价降低、得到电子、被还原、发生还原反应。
【思考】你是如何理解氧化还原反应与化合价和电子之间的关系?
【学生】失去电子化合价升高被氧化发生氧化反应。
【问题】你知道氧化还原反应与四种基本反应类型的关系?
提示:用“图示”来表示。
【学生】
【总结】氧化还原反应广泛存在于生产与生活中。但在生产和生活中同时具有正、负两方面的影响,当我们做到趋利避害,才能更好的服务于我们。
课题研究:本成果是西藏自治区教育科学研究2019年度一般课题,课题批准号XZJKY19330成果之一)

